背景介紹
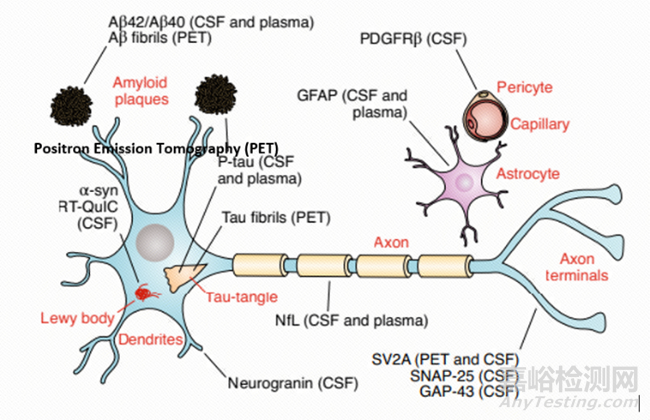
神經(jīng)退行性疾病是一組表現(xiàn)為腦細(xì)胞(即神經(jīng)元)逐漸喪失數(shù)量和功能的復(fù)雜多樣的神經(jīng)系統(tǒng)疾病�。目前全球已有數(shù)以百萬(wàn)計(jì)的人群深受其害���,其中以阿爾茲海默?��。ˋlzheimer’s Diseases,AD)和帕金森?��。≒arkinson’s Diseases����,PD)最為常見。AD的主要疾病特征表現(xiàn)為記憶力減退并伴隨有多種其它認(rèn)知功能障礙(如語(yǔ)言、執(zhí)行和視覺空間等方面的困難)�,最終發(fā)展為癡呆[1]����。研究發(fā)現(xiàn)AD患者的大腦海馬體和皮質(zhì)等部位常見受損或死亡的神經(jīng)元����,這被認(rèn)為與神經(jīng)元外淀粉樣蛋白(amyloid-β���,Aβ)沉積和神經(jīng)元纖維(含高度磷酸化的Tau蛋白,p-Tau)纏結(jié)密切相關(guān)[1,2]�。而PD患者則主要有運(yùn)動(dòng)遲緩����、肌肉僵硬、靜息性震顫以及姿勢(shì)和步態(tài)障礙癥狀���,這些特征多數(shù)與大腦黑質(zhì)致密部中產(chǎn)生多巴胺的神經(jīng)元減少有關(guān)[1]����。α-突觸核蛋白(α-synuclein����,α-syn)在神經(jīng)元內(nèi)路易小體(Lewy bodies)和路易軸突(Lewy neurites)的異常堆積是PD的主要病理學(xué)特征之一[3]���。
圖1神經(jīng)退行性疾病的生物標(biāo)志物[1]
腦脊液和血液生物標(biāo)志物檢測(cè)在AD和PD等神經(jīng)退行性疾病的診斷和治療中具有重要作用���。如腦脊液中Aβ42、總Tau蛋白(t-Tau)和p-Tau在AD的輕度認(rèn)知障礙期可達(dá)到95%以上的靈敏度和特異性����,是AD癡呆期的診斷標(biāo)志物[4]�。另外���,通過檢測(cè)腦脊液中α-突觸核蛋白也能準(zhǔn)確地鑒別和診斷PD患者[1]。同時(shí)����,多項(xiàng)研究也表明血漿中Aβ42/40���、p-Tau(181、217)和神經(jīng)絲輕鏈蛋白(neurofilament light���,NfL)以及膠質(zhì)纖維酸性蛋白(glial fibrillary acidic protein,GFAP)等生物標(biāo)志物與AD發(fā)生發(fā)展關(guān)系密切���,其在替代或補(bǔ)充CSF生物標(biāo)志物參與AD診斷和治療方面具有很大潛力[1,4]。但是血腦屏障的存在導(dǎo)致血液中神經(jīng)退行性疾病生物標(biāo)志物的超低濃度范圍(pg/mL或者fg/mL級(jí)別)���, 同時(shí)血液中大量的基質(zhì)蛋白(如IgG),可能存在的蛋白酶降解����,以及肝臟代謝和腎臟清除作用�,均會(huì)進(jìn)一步干擾低豐度靶標(biāo)蛋白的檢測(cè)[4]����。因此���,迫切需要開發(fā)出超高靈敏度的檢測(cè)方法與平臺(tái)才能進(jìn)一步滿足神經(jīng)退行性疾病生物標(biāo)志物的臨床檢測(cè)需求���。
超高靈敏度的simoa檢測(cè)平臺(tái)
近來���,隨著超靈敏免疫檢測(cè)技術(shù)的進(jìn)步�,單分子陣列 (SIMOA)法基于數(shù)字蛋白的檢測(cè)原理,靈敏度比傳統(tǒng)免疫分析法高1000倍����,是目前最靈敏的蛋白檢測(cè)技術(shù)�,已成功實(shí)現(xiàn)了血液中AB�、Tau蛋白和神經(jīng)絲輕鏈蛋白 (NfL)的定量檢測(cè)���,具有超高的靈敏度���。
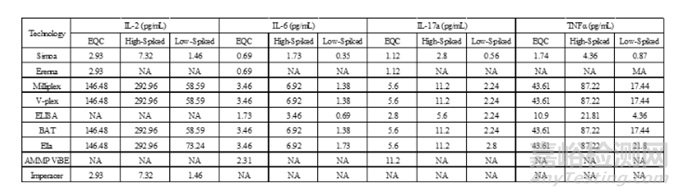
表1.從不同平臺(tái)比較PBMC中提取4種細(xì)胞因子水平(包含spike高濃度和低濃度樣品及內(nèi)源性質(zhì)控樣品(EQC,Endogenous quality control))[5]
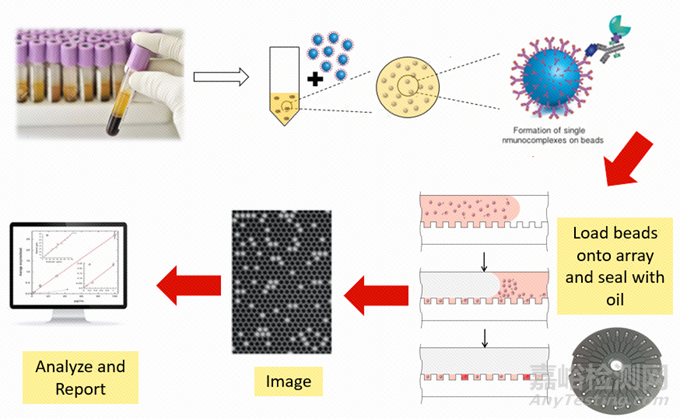
Simoa的檢測(cè)原理:通過磁珠酶聯(lián)反應(yīng)與微孔列陣芯片的結(jié)合���,實(shí)現(xiàn)單分子蛋白檢測(cè)�。
圖2. Simoa平臺(tái)的檢測(cè)原理[6]
1.利用表面標(biāo)記有捕獲抗體的磁珠捕獲樣品中的抗原;
2.使用Biotin標(biāo)記的檢測(cè)抗體對(duì)被捕獲的抗原進(jìn)行標(biāo)記;
3.加入鏈霉親和素-半乳糖苷酶復(fù)合物,與檢測(cè)抗體上的Biotin結(jié)合�;
4.將反應(yīng)洗凈后的磁珠與底物混合,加載到含有微孔陣列的檢測(cè)芯片中�,利用磁場(chǎng)使磁珠落入與其尺寸完全匹配的微孔中���,加入油相���,使得微孔之間物理隔離;
5.含有半乳糖苷酶的微孔由于酶分子催化底物產(chǎn)生熒光產(chǎn)物�;
6.對(duì)微孔陣列進(jìn)行熒光成像����,通過對(duì)發(fā)出熒光信號(hào)的微孔個(gè)數(shù)對(duì)照標(biāo)準(zhǔn)曲線實(shí)現(xiàn)定量檢測(cè)����。
生物分析策略
生物標(biāo)志物在藥物的開發(fā)過程中被科學(xué)家和監(jiān)督機(jī)構(gòu)廣泛用于各種目的���,但考慮其復(fù)雜性����,法規(guī)部門并沒有發(fā)布統(tǒng)一的生物標(biāo)志物方法驗(yàn)證的指南����。M10指導(dǎo)法規(guī)���、中國(guó)藥典和歐洲藥品管理局(EMA)等涉及臨床生物分析的法規(guī)沒有明確針對(duì)生物標(biāo)志物的內(nèi)容�。FDA在2013年的《生物分析驗(yàn)證法規(guī)指南》中提到����,對(duì)于生物標(biāo)志物可以使用‘fit-for-purpose’的生物分析策略[7]���。在最新版的FDA Guidance(Bioanalytical Method Validation, Guidance for Industry, 2018)上,描述為在藥物開發(fā)過程中�,生物標(biāo)志物可用于各種各樣的目的���;因此���,在確定方法驗(yàn)證的適當(dāng)范圍時(shí)����,應(yīng)使用‘fit-for-purpose’分析策略[8]。工業(yè)界也發(fā)表不少文章來討論如何進(jìn)行‘fit-for-purpose’分析驗(yàn)證����。2019年Critical Path Institute 發(fā)表的“Points to Consider document: scientific and regulatory considerations for the analytical validation of assay used in the qualification of biomarkers in biological matrices”���,比較詳細(xì)描述了如何進(jìn)行生物標(biāo)志物的方法或驗(yàn)證[9]���。
參考文獻(xiàn)
1.Hansson O. Biomarkers for neurodegenerative diseases. Nat Med. 2021 Jun;27(6):954-963.
2.Alzheimer's Association. 2013 Alzheimer's disease facts and figures. Alzheimers Dement. 2013 Mar;9(2):208-45.
3.Spillantini MG, Goedert M. Neurodegeneration and the ordered assembly of α-synuclein. Cell Tissue Res. 2018 Jul;373(1):137-148.
4.Blennow K, Zetterberg H. Biomarkers for Alzheimer's disease: current status and prospects for the future. J Intern Med. 2018 Dec;284(6):643-663.
5.David Yeung, Shawn Ciotti, Shobha Purushothama, et al. Evaluation of highly sensitive immunoassay technologies for quantitative measurements of sub-pg/mL levels of cytokines in human serum. Journal of Immunological methods.2016 Aug;S0022-1759(16):30156-9.
6.https://zhuanlan.zhihu.com/p/618477934
7.Draft Guidance for Industry. Bioanalytical Method Validation. US Department of Health and Human Services. 2013.
8.U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Veterinary Medicine (CVM). Bioanalytical method validation, guidance for industry. May 2018.
9.Critical Path Institute. Points to consider document: scientific and regulatory considerations for the analytical validation of assay used in the qualification of biomarkers in biological matrices. Jun 2019.