2023年12月6日�����,賽諾醫(yī)療科學技術股份有限公司(簡稱“賽諾醫(yī)療”)宣布����,已于2023年6月向中國臺灣行政院衛(wèi)生署食品藥品管理局(簡稱“TFDA”)遞交了公司 NC Rockstar 非順應性冠狀動脈球囊擴張導管的注冊申報資料,并于近日收到 TFDA 通知�����,公司 NCRockstar 非順應性冠狀動脈球囊擴張導管獲得 TFDA 的批準����。
注冊證內容
注冊證編號:衛(wèi)部醫(yī)器陸輸字第 001509 號
簽審文件號碼:DHA09200150900
產品名稱:“賽諾”巖星非順應性冠狀動脈球囊擴張導管
結構及組成型:該產品由 TIP 頭�����、球囊保護鞘、球囊�����、球囊內管��、Marker�����、球囊外管��、金屬導管����、護套、接頭��、洞口和金屬導管的兩個標記組成��。產品經環(huán)氧乙烷滅菌�����,一次性使用,貨架有效期 3 年��。
適用范圍:該產品適用于為動脈粥樣硬化患者改善心肌灌注而針對自體冠狀動脈或搭橋狹窄部位所進行的球囊導管擴張����。該產品還適用于球囊擴張支架(裸金屬和藥物洗脫支架)的遞送后擴張。
產品介紹
本次獲得中國臺灣注冊證的 NC Rockstar 非順應性冠狀動脈球囊擴張導管����,在產品在設計上采用了雙層球囊,平衡了高爆破壓力和低順應性的要求�����。
另一方面��,更短的肩部設計和三層內管設計��,能夠確保更高的球囊擴張精確度����,并提供更加良好的追蹤性能及抗壓性能,有效防止手術過程中導絲抱死�����,較市場上其他同類產品��,其具有更小的通過外徑��,可實現(xiàn)與 2.00-4.00mm 直徑球囊的全規(guī)格對吻��。
該產品于 2022 年 10 月 28 日獲得中國國家藥品監(jiān)督管理局(以下簡稱“國家藥監(jiān)局”)頒發(fā)的《中華人民共和國醫(yī)療器械注冊證》����。于 2022 年 12 月、2023 年 6 月分別獲得美國 FDA 認證(510(k))和泰國《醫(yī)療器械注冊證》����。
賽諾醫(yī)療
賽諾醫(yī)療科學技術股份有限公司(簡稱:賽諾醫(yī)療,股票代碼:688108)����,是一家根植于中國,面向全球市場��,專注于高端介入醫(yī)療器械研發(fā)��、生產��、銷售的國際化公司�����。
公司于2007年在天津經濟技術開發(fā)區(qū)創(chuàng)立,在北京����、蘇州、香港����、美國、日本�����、荷蘭����、法國設有全資子公司。2019年10月��,公司登陸上海證券交易所����,成為科創(chuàng)板上市企業(yè)。
經過十余年的發(fā)展,賽諾醫(yī)療建立了具有國際水平的研發(fā)��、生產和運營體系�����,業(yè)務涵蓋心血管��、腦血管�����、結構性心臟病等介入治療的重點領域�����。
目前����,公司在全球范圍內擁有專利數(shù)200余件�����,覆蓋中國�����、美國、歐洲等主流國家和地區(qū)����;承擔國家級、省級科研項目7項��,包括“十三五”國家重點研發(fā)計劃課題等����。
成立至今,公司主營產品冠脈藥物支架�����、冠脈球囊��、顱內快速交換球囊�����、顱內藥物洗脫支架等累計使用超過140萬個��,進入兩千余家醫(yī)院�����,全球數(shù)十萬患者因此獲益。
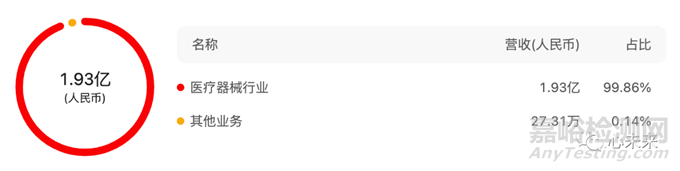
據(jù)公司發(fā)布的2022年報顯示�����,公司實現(xiàn)總營收1.93億元�����,具體構成如下圖所示: