今日頭條
海創(chuàng)URAT1抑制劑獲批痛風Ⅱ期臨床����。海創(chuàng)藥業(yè)URAT1抑制劑HP501緩釋片獲FDA批準開展Ⅱ期臨床,擬評估用于治療痛風相關的高尿酸血癥的潛力���。目前已完成多項單藥治療的Ⅰ/Ⅱ期試驗數(shù)據(jù)顯示����,HP501在治療高尿酸血癥/痛風方面具有良好的療效及安全性����。值得一提的是,海創(chuàng)藥業(yè)還計劃開展HP501聯(lián)合黃嘌呤氧化酶抑制劑用于長期治療原發(fā)性高尿酸血癥的臨床研究�。
國內(nèi)藥訊
1.康諾亞IL-4R抗體報皮炎NDA。康諾亞旗下康諾行生物司普奇拜單抗注射液的上市申請獲國家藥監(jiān)局受理�。這是國產(chǎn)首款、全球第2款IL-4R抗體���,可通過靶向IL-4Rα來雙重阻斷白介素4(IL-4)及白介素13(IL-13)的信號傳導�。今年11月,該產(chǎn)品已被CDE擬納入優(yōu)先審評����,用于治療外用藥控制不佳或不適合外用藥治療的成人中重度特應性皮炎。
2.和黃Syk抑制劑擬納入優(yōu)先審評�。和黃醫(yī)藥Syk抑制劑醋酸索樂匹尼布片獲CDE擬納入優(yōu)先審評,擬定適應癥為:既往接受過一線標準治療(糖皮質(zhì)激素����、免疫球蛋白)無效或復發(fā)的成人原發(fā)慢性免疫性血小板減少癥(ITP)�。今年8月,和黃醫(yī)藥宣布索樂匹尼布用于治療ITP的中國關鍵III期研究(ESLIM-01)達到主要終點以及所有的次要終點���。與安慰劑相比����,索樂匹尼布治療顯著提高患者的臨床應答率�。
3.映恩Trop-2靶向ADC獲批新臨床。映恩生物自主研發(fā)第三代Trop2靶向ADC藥物注射用DB-1305獲國家藥監(jiān)局批準開展新的臨床試驗���,針對的適應癥為“晚期/轉(zhuǎn)移性實體瘤”����。公布于2023ESMO會議上的I/IIa期研究初步結果顯示,DB-1305治療晚期實體瘤的客觀反應率(ORR)為30.4%���,疾病控制率(DCR)為87.0%�。今年8月���,映恩生物已將該產(chǎn)品的全球(不包大中華區(qū))開發(fā)�、生產(chǎn)和商業(yè)化權益授予BioNTech公司���。
4.星眸首款AAV基因療法報眼科IND�。合肥星眸生物1類生物制品“XMVA09注射液”的臨床試驗申請獲CDE受理����。XMVA09是星眸生物首款基因治療藥物,擬開發(fā)用于玻璃體注射(IVT)治療“濕性年齡相關性黃斑變性(wAMD)”引起的視網(wǎng)膜色素上皮細胞(RPE)感染患者�。星眸生物是中國科大先研院孵化的創(chuàng)新企業(yè),專注于基因療法領域�。去年3月, 星眸生物完成數(shù)千萬人民幣pre-A輪融資���。
5.中美瑞康sarRNA藥物報IND���。中美瑞康雙鏈saRNA藥物RAG-01在澳大利亞提交Ⅰ期臨床試驗申請���,擬評估RAG-01在對卡介苗(BCG)無應答的非肌層浸潤性膀胱癌(NMIBC)患者中的安全性、耐受性����、藥代動力學和初步療效。RAG-01通過RNAa機制激活p21基因的表達���,以達到抑制腫瘤細胞增殖���、誘導細胞凋亡和衰老的效果�。在臨床前研究中,RAG-01已在膀胱癌動物模型中顯示出抑制腫瘤生長的潛力�。
國際藥訊
1.創(chuàng)新口服TTR穩(wěn)定劑報產(chǎn)。BridgeBio公司新一代轉(zhuǎn)甲狀腺素蛋白(TTR)小分子穩(wěn)定劑acoramidis已向FDA提交新藥申請(NDA)���,用于治療伴有心肌病的轉(zhuǎn)甲狀腺素蛋白介導的淀粉樣變性(ATTR-CM)患者����。在Ⅲ期試驗ATTRibute-CM中����,30個月隨訪結果顯示�,acoramidis治療較安慰劑使患者全因死亡風險降低35.5%(p=0.0008)�;患者總體生存率達到81%(vs74%)。
2.RARα激動劑聯(lián)合治療AML的Ⅱ期臨床積極�。Syros公司維甲酸受體α(RARα)激動劑tamibarotene聯(lián)合venetoclax和阿扎胞苷(azacitidine)一線治療RARA基因過表達的急性髓系白血病(AML)患者的Ⅱ期SELECT-AML-1臨床達到主要終點。與venetoclax和阿扎胞苷相比���,tamibarotene組合實現(xiàn)完全緩解CR/完全緩解伴血液學不完全恢復CRi的患者比例更高(100%vs70%)���;tamibarotene聯(lián)合用藥耐受性良好,未顯示疊加性毒性或新的安全性信號���。
3.膀胱癌溶瘤病毒獲FDA快速通道資格�。CG Oncology公司溶瘤病毒療法cretostimogene grenadenorepvec(CG0070)獲FDA授予快速通道資格和突破性療法認定�,用于治療高危卡介苗(BCG)無反應性非肌層浸潤性膀胱癌(NMIBC)原位癌���,這些患者伴有或不伴有Ta或T1(乳頭狀)腫瘤����。公布于SUO2023年會上的Ⅲ期試驗數(shù)據(jù)顯示,CG0070單藥治療的BCG無應答NMIBC患者的完全緩解率為75.7%(n=50/66)����。樂普生物擁有該新藥的中國開發(fā)權益。
4.強生吉西他濱改良型新藥獲BTD認定���。強生吉西他濱改良型新藥TAR-200獲FDA授予突破性療法認定(BTD)���,用于治療對卡介苗(BCG)不應答的高風險、不適合根治性療法的非肌肉浸潤性膀胱癌(HR-NMIBC)患者�。在Ⅱb期臨床SunRISe-1中,TAR-200單藥的完全緩解率為77%����。TAR-200是TARIS公司(已被強生收購)藥物遞送技術開發(fā)的可在膀胱內(nèi)持續(xù)數(shù)周連續(xù)釋放化療藥物吉西他濱的創(chuàng)新產(chǎn)品。
5.默克BTK抑制劑III期臨床未達主要終點����。默克BTK抑制劑evobrutinib治療復發(fā)性多發(fā)性硬化癥(RMS)的兩項III期EVOLUTION研究(evolutionRMS 1和evolutionRMS 2)未達到主要終點�。與特立氟胺相比,evobrutinib在156周治療期間未能降低患者年化復發(fā)率(ARR)指標����;藥物安全性與之前報道一致。默克表示,在全面評估研究數(shù)據(jù)后����,再公布具體結果。
6.艾伯維87億美元收購神經(jīng)科學公司Cerevel�。艾伯維將以每股45美元的現(xiàn)金價格(總股權價值約為87億美元)收購Cerevel公司,并獲得該公司臨床階段多款候選產(chǎn)品(Emraclidine���、Tavapadon和CVL-354)�。Emraclidine是一款靶向毒蕈堿M4的正向變構調(diào)節(jié)劑(PAM)����,正在兩項II期研究中評估治療精神分裂癥的潛力;Tavapadon是一款口服多巴胺D1和D5受體選擇性部分激動劑�,正在III期臨床單藥、以及輔助治療療帕金森?���。籆VL-354是一種kappa型阿片受體(KOR)拮抗劑�。
醫(yī)藥熱點
1.英國發(fā)現(xiàn)豬流感H1N2變異株。11月27日�,英國衛(wèi)生安全局報告該國首例人感染甲型H1N2流感變異病毒的案例,這是首次在人類身上發(fā)現(xiàn)這種流感病毒���。與世界其他地方近期出現(xiàn)的人類甲型H1N2流感病例不同����,這一病毒毒株與英國的豬流感病毒相似。英國衛(wèi)生服務局正在跟進追蹤該病例的密切接觸者���。目前該病例感染源尚未確定�,亦不清楚這種病毒能否在該人體內(nèi)復制���,發(fā)生人傳人現(xiàn)象�。
2.國產(chǎn)機器人首次完成三地遠程手術���。11月29日����,北京大學第一醫(yī)院聯(lián)合海南省中醫(yī)院�、中南大學湘雅三醫(yī)院在“三地三院”5G+固網(wǎng)遠程模式下,成功為一名72歲的海南患者在?���?谑虚_展了國產(chǎn)機器人輔助腹腔鏡根治性前列腺切除術+盆腔淋巴結清掃術����。該例手術是全球范圍內(nèi)首次使用國產(chǎn)手術機器人進行三地遠程控制����,開展的手術為泌尿外科手術中病情最復雜����、術野范圍最廣的術式。
3.陜西省耳鼻咽喉頭頸外科醫(yī)療質(zhì)控中心成立���。12月3日���,陜西省耳鼻咽喉頭頸外科專業(yè)醫(yī)療質(zhì)量控制中心正式成立。該中心掛靠在空軍軍醫(yī)大學第一附屬醫(yī)院西京醫(yī)院����,西京醫(yī)院耳鼻咽喉頭頸外科查定軍主任任該質(zhì)控中心主任委員。查定軍主任在表態(tài)發(fā)言中表示���,中心成立后���,將積極借鑒經(jīng)驗做法,不斷探討質(zhì)量管理的新模式和新方法����,提升全省耳鼻咽喉頭頸外科醫(yī)療安全質(zhì)量�,為患者提供更安全���、優(yōu)質(zhì)的醫(yī)療服務���。
評審動態(tài)
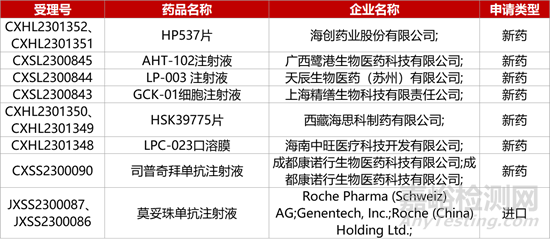
1. CDE新藥受理情況(12月07日)
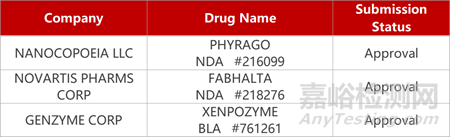
2. FDA新藥獲批情況(北美12月06日)