摘要
目的��,推進(jìn)進(jìn)口藥品管理制度的改革創(chuàng)新,為藥品高質(zhì)量發(fā)展?fàn)I造良性發(fā)展的制度環(huán)境��。方法 通過文件及文獻(xiàn)梳理等方式了解我國進(jìn)口藥品的相關(guān)管理制度,總結(jié)相關(guān)管理制度對藥品監(jiān)督檢臉的影響,分析各地��、各部門積黑實踐經(jīng)驗下取消進(jìn)口藥品逐批檢春(以下稱批批檢)的意義,并提出完善我國進(jìn)口藥品的監(jiān)管建議��。結(jié)果����,隨著進(jìn)口藥品望易規(guī)模的持續(xù)擴(kuò)大,以及藥品治理改華和創(chuàng)新的總體思路和制度框架的確立,現(xiàn)行管理辦法已不適應(yīng)行業(yè)發(fā)展需求����。進(jìn)口藥品的檢驗不合格率很低,取消批批檢制度在物流、通關(guān)��、檢驗����、倉儲等方面為企業(yè)和監(jiān)管部門均帶來了極大便利。結(jié)論,通過加快法律法規(guī)的修訂進(jìn)程��。部署取消批批檢品種的抽檢工作,完善信息數(shù)據(jù)庫系統(tǒng)建設(shè),可提升臨床用藥的可及性����。
進(jìn)口藥品在充實藥品資源、保障用藥需求方面發(fā)揮了重要作用����。我國不斷加強(qiáng)對進(jìn)口藥品的管理,進(jìn)口藥品管理工作邁進(jìn)了新的發(fā)展時期����。目前,我國實施的《藥品進(jìn)口管理辦法》(以下簡稱《辦法》)是由原國家食品藥品監(jiān)督管理局�、海關(guān)總署于 2003 年 8 月共同頒布的。在國內(nèi)國際雙循環(huán)發(fā)展新格局�、我國藥品監(jiān)管體制機(jī)制轉(zhuǎn)變、信息化數(shù)字化轉(zhuǎn)型進(jìn)程��、政府“放管服”和優(yōu)化營商環(huán)境等政策環(huán)境的不斷變化下����,對進(jìn)口藥品相關(guān)管理制度進(jìn)行研究具有一定的必要性和緊迫性。在此��,本研究中探討了我國進(jìn)口藥品管理制度對藥品檢驗工作的影響和啟示。現(xiàn)報道如下��。
一�、我國進(jìn)口藥品監(jiān)管的理論與實踐基礎(chǔ)
1.1 我國藥品進(jìn)口管理的法規(guī)政策背景
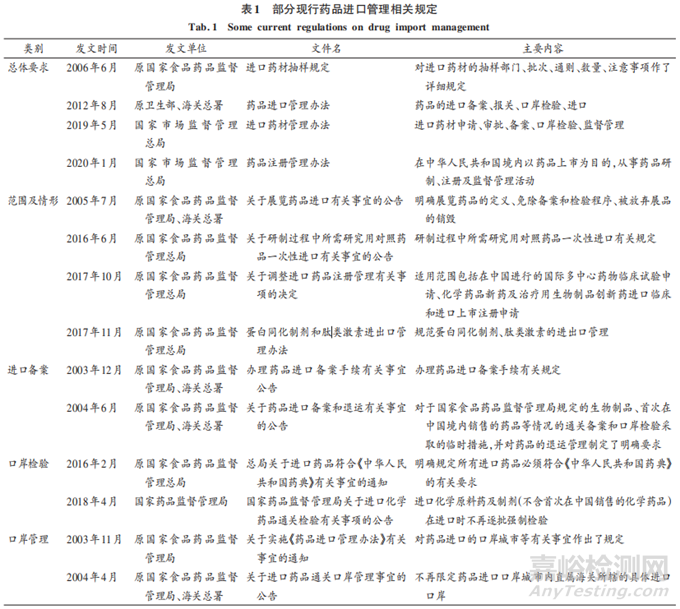
我國已頒布一系列法規(guī)對進(jìn)口藥品的管理進(jìn)行完善。2003 年��,原國家食品藥品監(jiān)督管理局��、海關(guān)總署頒布了《辦法》��,規(guī)范了我國進(jìn)口藥品的備案�、報關(guān)、口岸檢驗等工作��;2012年�,原衛(wèi)生部��、海關(guān)總署對 2003年版《辦法》按《中華人民共和國行政強(qiáng)制法》的要求進(jìn)行了兩處修改�;2017年,中國加入人用藥品技術(shù)要求國際協(xié)調(diào)理事會(ICH)��,為加快與國際通行規(guī)則接軌進(jìn)程����,相關(guān)部門發(fā)布一系列藥品技術(shù)指導(dǎo)原則����;2019年�,新修訂的《藥品管理法》《進(jìn)口藥材管理辦法》重新對進(jìn)口藥品審批檢驗等作出相應(yīng)規(guī)定;2020年��,國家市場監(jiān)督管理總局頒布了《藥品注冊管理辦法》��,對境外生產(chǎn)藥品的注冊申請作出規(guī)定��。2003 年版《辦法》分為總則��、進(jìn)口備案��、口岸檢驗��、監(jiān)督管理�、附則五章共四十五條;2012 年����,原衛(wèi)生部、海關(guān)總署對《辦法》進(jìn)行了修改�,但對程序性規(guī)定等基本原則未作修改?���!掇k法》不是對藥品進(jìn)口全流程進(jìn)行管理的文件����,除上述文件外����,我國陸續(xù)發(fā)布了50 多部藥品進(jìn)口管理相關(guān)法規(guī)政策文件。部分文件見表 1��。
1.2 “一帶一路”地區(qū)成為醫(yī)藥外貿(mào)新增長點
近年來�,進(jìn)口藥品的貿(mào)易規(guī)模不斷擴(kuò)大。隨著我國一系列審評新政的實施����,進(jìn)口藥品在國內(nèi)上市的速度加快,帶動了市場擴(kuò)大和需求增長����。根據(jù)海關(guān)數(shù)據(jù)顯示����,2017年至2021年,我國醫(yī)藥材及藥品進(jìn)口數(shù)量和進(jìn)口金額整體均呈增長趨勢�;2021年��,我國醫(yī)藥材及藥品進(jìn)口數(shù)量達(dá) 22. 61 萬噸�,同比增長 3. 1%����;2021 年,我國醫(yī) 藥 材 及 藥 品 進(jìn) 口 金 額 達(dá) 2 884 億 元 ��,同 比 增 長11. 8%[1]��。值得注意的是��,我國與“一帶一路”沿線國家和地區(qū)的醫(yī)藥外貿(mào)比全球其他市場更加活躍��。根據(jù)海關(guān)數(shù)據(jù)顯示��,2019年��,我國從“一帶一路”地區(qū)和國家進(jìn)口的醫(yī)藥保健品達(dá)65億美元����,同比增長26. 1%[2]。近年來����,我國醫(yī)藥品的進(jìn)口量呈持續(xù)增長態(tài)勢��。
1.3 對進(jìn)口藥品分類有利于高效監(jiān)管
《辦法》及進(jìn)口相關(guān)法律��、法規(guī)文件均未明確進(jìn)口藥品的定義和分類����,業(yè)內(nèi)一般將在中國境外(或境內(nèi)關(guān)外)完成生產(chǎn)�,并申請進(jìn)入中國境內(nèi)的各類具有藥用用途的產(chǎn)品統(tǒng)稱為進(jìn)口藥品。從監(jiān)管實踐經(jīng)驗出發(fā)��,進(jìn)口藥品在不同的劃分標(biāo)準(zhǔn)下呈現(xiàn)不同類型(表2)�。但這無法代表所有分類,如臨床急需藥品就不包含在其中�;且分類之間存在交叉,只能區(qū)分主要類型�。故對進(jìn)口藥品進(jìn)行明確定義和區(qū)分,有利于在具體工作中進(jìn)行符合實際情況����、高效、精準(zhǔn)的監(jiān)管����?���!渡唐访Q及編碼協(xié)調(diào)制度》(以下簡稱 HS)是國際貿(mào)易商品的分類體系����,是我國為商品的國際貿(mào)易流通而設(shè)立的進(jìn)出口稅則��,編碼原則側(cè)重于征稅的統(tǒng)計功能�。海關(guān)不根據(jù)商品品名,而是以商品編碼(HS編碼)認(rèn)定商品分類����。HS編碼中以“藥品”命名的章節(jié)為第三十章,其中商品范圍涉及6個大類�。另外,某些與藥品相關(guān)的商品散布于第三十章以外����,包括第二十八章、第二十九章的原料藥��,以及HS編碼以1302開頭的醫(yī)藥浸膏等��。首次進(jìn)口藥品的歸類工作非常關(guān)鍵����。進(jìn)口藥品的化學(xué)成分和用途非常復(fù)雜�,尤其是難以界定不屬于法定意義的藥品�,如研發(fā)用物品(非上市藥品)和非藥用藥材,難免出現(xiàn)藥品監(jiān)管部門對商品歸類意見與海關(guān)稅則不一致的情形����。即通關(guān)申報用途(如食用)與申報要求(如藥用)不一致[3],導(dǎo)致各個部門對查驗文件的要求不一致��,影響后續(xù)監(jiān)管處置�。
二、現(xiàn)行管理制度對藥品檢驗的影響
2.1 進(jìn)口藥品行業(yè)進(jìn)入有序發(fā)展的新階段
2003年 8 月公布的《辦法》對規(guī)范進(jìn)口藥品的通關(guān)備案��、口岸檢驗等管理工作起到了積極作用��,但實施以來相繼出現(xiàn)了新的情況�。一是近年來國家出臺和修訂了一系列法律法規(guī),《藥品管理法》《進(jìn)口藥材管理辦法》《藥品注冊管理辦法》等固化了藥品治理改革和創(chuàng)新的總體思路和制度框架����,并進(jìn)一步規(guī)范相關(guān)制度,如追溯管理制度�、藥品記錄與數(shù)據(jù)管理制度、《藥品技術(shù)審評質(zhì)量管理規(guī)范》(GRP)��、藥物警戒制度等。二是我國醫(yī)藥行業(yè)加快了與國際標(biāo)準(zhǔn)接軌的步伐�,2017 年我國加入 ICH�,相關(guān)部門發(fā)布了一系列藥品技術(shù)指導(dǎo)原則,進(jìn)一步縮小了藥物研發(fā)注冊要求和國際要求的差異����,助推藥品研發(fā)和注冊進(jìn)入全球化時代。三是國家關(guān)于進(jìn)口藥品安全管理有了新要求��,特別是為了保障國內(nèi)患者的重大疾病用藥需求��,支持更多進(jìn)口醫(yī)藥產(chǎn)品進(jìn)入中國市場�,出臺了境外上市臨床急需藥品審批程序,優(yōu)化藥品臨床試驗審批程序��,取消進(jìn)口化學(xué)藥品逐批檢驗等政策����,進(jìn)一步加快境外新藥的上市速度。四是各地藥品監(jiān)管部門和海關(guān)部門在實施進(jìn)口藥品安全管理工作中積累了大量的實踐經(jīng)驗�,應(yīng)進(jìn)行認(rèn)真總結(jié)和吸收。
建立健全我國藥品進(jìn)口管理制度����,是提升國內(nèi)患者臨床用藥的可及性����,滿足廣大群眾日益增長的健康生活需求的必然要求��。通過實地調(diào)研�、專家咨詢等方式,了解到 2012 年 8 月發(fā)布的《辦法》在長期實施過程中存在如下問題:
1)部分配套文件等法律法規(guī)需要更新�,部分操作細(xì)則需進(jìn)一步完善,未完全涵蓋非常規(guī)商業(yè)化用途的產(chǎn)品����;
2)與其他部門的協(xié)調(diào)有待加強(qiáng),各監(jiān)管部門對同一品名商品的監(jiān)管互認(rèn)機(jī)制有待建立��;
3)完善信息系統(tǒng)建設(shè)��,需進(jìn)一步完善技術(shù)支撐�;
4)通關(guān)便利性有待進(jìn)一步加強(qiáng)。
2.2 口岸檢驗是把控藥品質(zhì)量的重要環(huán)節(jié)
進(jìn)口藥品在到港口岸藥品監(jiān)督管理局備案后��,由口岸藥品檢驗機(jī)構(gòu)對需檢驗的藥品品種進(jìn)行現(xiàn)場核驗�、資料查驗、抽樣��、檢驗����、復(fù)驗等��,口岸局根據(jù)檢驗結(jié)果確定是否予以進(jìn)口備案����,經(jīng)檢驗合格的藥品才可用于藥物研發(fā)��、臨床試驗�、商業(yè)銷售等��。進(jìn)口藥品的生產(chǎn)地在境外��,無法對生產(chǎn)環(huán)節(jié)進(jìn)行監(jiān)管��,故通關(guān)檢驗成了保護(hù)國門藥品質(zhì)量安全的第一道防線�。從口岸檢驗情況看,2021年中國食品藥品檢定研究院(以下簡稱中檢院)及19 個口岸藥檢機(jī)構(gòu)對涉及54 個國家或地區(qū)的9056批次����、188. 52 億美元的申請進(jìn)口藥品進(jìn)行了檢驗,其中檢驗不合格藥品 77批次(0. 85%)[4]�;從藥品抽檢情況看,2021年國家共抽檢進(jìn)口藥品 590批次�,其中口岸環(huán)節(jié) 232 批次�、生產(chǎn)環(huán)節(jié) 14 批次�、經(jīng)營環(huán)節(jié) 288 批次、使用環(huán)節(jié) 56 批次�,所檢項目均符合規(guī)定,合格率為100.00%[5]�。
自1999年起,我國開始實施進(jìn)口藥品逐批檢驗(以下簡稱批批檢)制度����。2018年,《國家藥品監(jiān)督管理局關(guān)于進(jìn)口化學(xué)藥品通關(guān)檢驗有關(guān)事項的公告》規(guī)定����,非首次進(jìn)口化學(xué)藥改為憑企業(yè)檢驗結(jié)果通關(guān),不再需要逐批強(qiáng)制檢驗�。取消批批檢可解決 2 個突出問題:一是按批次檢驗經(jīng)濟(jì)成本較高,包括樣品成本�、檢驗費、倉儲費用等��;二是檢驗時間較長����,一般情況下口岸檢驗機(jī)構(gòu)的檢驗時間至少為 1 個月,而中檢院的檢驗時間更長(3個月)[6]����,物流周期延長��,易導(dǎo)致國內(nèi)上市時間推后����。2018年取消批批檢后����,在物流、通關(guān)����、檢驗��、倉儲等方面為企業(yè)和監(jiān)管部門帶來了極大便利��。
三��、取消批批檢對日常檢驗工作的積極意義
3.1 抽樣數(shù)量減少�,降低檢驗成本
在通關(guān)檢驗抽樣時,由于需對樣品進(jìn)行多次重復(fù)檢驗��,不僅同一批藥品要被抽取多件樣品��,檢驗機(jī)構(gòu)還需投入大量人力和物力保證檢驗工作的進(jìn)行[7];抽取的藥品除檢驗用量消耗外�,剩余藥量作為留樣,至少需在專門設(shè)置的留樣間儲存 3 年����。上述要求對實驗儀器、耗材和場地提出了較大需求�。另外,過期的留樣藥品還需委托專業(yè)機(jī)構(gòu)進(jìn)行無害化銷毀��。
3.2 抽樣與檢驗任務(wù)減少��,促使合理分配檢驗資源
化學(xué)藥片劑�、注射劑及相關(guān)原料藥是抽樣和檢驗任務(wù)的重點。隨著抽樣和檢驗任務(wù)的大幅減少�,藥品檢驗機(jī)構(gòu)可優(yōu)化檢驗人員、實驗儀器耗材��、相關(guān)服務(wù)保障的資源配置����,以及現(xiàn)場核驗、資料查驗��、抽樣、檢驗�、復(fù)驗等過程中的流程,提高進(jìn)口藥品通關(guān)報驗和檢驗效率�。
3.3 釋放檢驗機(jī)構(gòu)的檢驗?zāi)芰?/span>
國家對口岸檢驗機(jī)構(gòu)的實驗室建設(shè)、儀器設(shè)備購置維護(hù)��、人員培訓(xùn)等已投入大量經(jīng)費����,檢驗機(jī)構(gòu)可著重提升實驗室技術(shù)和管理能力,提高檢驗機(jī)構(gòu)技術(shù)水平和質(zhì)量控制能力��,完善實驗室質(zhì)量管理體系����,以及申請適用于本機(jī)構(gòu)的其他資質(zhì)認(rèn)定等。此外�,通過加強(qiáng)對檢驗人員的考核和培訓(xùn)�,提升在藥品注冊標(biāo)準(zhǔn)的探究性研究、特殊藥品(如捐贈藥品)檢驗標(biāo)準(zhǔn)研究��、強(qiáng)化與其他部門在進(jìn)口藥品的風(fēng)險評估����、檢測鑒定和后續(xù)處置的協(xié)作等研究項目的研發(fā)能力,為進(jìn)口藥品的監(jiān)管提供堅強(qiáng)的技術(shù)支持����。
四��、政策建議
4.1 加快法律法規(guī)的修訂進(jìn)程
取消非首次進(jìn)口化學(xué)藥批批檢最大的啟示����,就是要全面加強(qiáng)現(xiàn)行進(jìn)口藥品相關(guān)法規(guī)和政策間的銜接��,相關(guān)法規(guī)及其配套文件也需作出相應(yīng)調(diào)整��。因《辦法》不是對藥品進(jìn)口管理全流程的程序性規(guī)定�,目前涉及進(jìn)口方面的法規(guī)眾多,部分配套文件需要更新����,且部分操作細(xì)則需進(jìn)一步完善。在相關(guān)規(guī)定調(diào)整到位前�,若進(jìn)口藥品的進(jìn)口備案、口岸檢驗�、監(jiān)督管理等現(xiàn)行規(guī)定存在與未廢除規(guī)定不相匹配的情況,需用新規(guī)定取代�。近年來,有關(guān)藥品監(jiān)管領(lǐng)域的改革舉措都涉及法律規(guī)定的創(chuàng)新與調(diào)整��,如何制訂科學(xué)、嚴(yán)謹(jǐn)?shù)恼咝杞y(tǒng)籌考慮�,如緊密聯(lián)合商務(wù)委員會、海關(guān)�、國家衛(wèi)生健康委員會、體育局�、農(nóng)業(yè)局等其他部門;建立并完善分層法規(guī)體系��,用相關(guān)配套文件等與《辦法》進(jìn)一步銜接等��。
4.2 部署取消批批檢品種的抽檢工作
取消非首次進(jìn)口化學(xué)藥批批檢改變了口岸管理的原有程序����,對進(jìn)口藥品質(zhì)量把關(guān)工作將由口岸檢驗環(huán)節(jié)變?yōu)檫M(jìn)口備案環(huán)節(jié)承擔(dān),但批批檢制度的取消不意味著所有檢測的取消�。進(jìn)口藥品一直主要由口岸所檢驗,而市場抽樣計劃相對較少��,取消批批檢的同時�,也減弱了第一道質(zhì)量把關(guān)的防線。因此��,監(jiān)管部門應(yīng)強(qiáng)化對進(jìn)口藥品的日常監(jiān)管��,如在藥品抽檢買樣制度條件下��,省級藥品年度抽檢計劃制訂過程中需把握監(jiān)管成本與質(zhì)量風(fēng)險間的平衡��,包括如何覆蓋更多的進(jìn)口 藥 品 品 種 �、根 據(jù) 不 同 季 節(jié) 和 原 料 藥 進(jìn) 行 動 態(tài) 抽檢等。
4.3 完善信息數(shù)據(jù)庫系統(tǒng)建設(shè)
信息電子化通報對于取消非首次進(jìn)口化學(xué)藥批批檢后進(jìn)口藥品檢驗工作的管理十分必要�,完善信息數(shù)據(jù)庫系統(tǒng)建設(shè)顯得十分迫切。建議藥品監(jiān)督管理局和海關(guān)等部門內(nèi)部或部門之間建立可供查核和推送信息的數(shù)據(jù)庫系統(tǒng)����,包括藥品進(jìn)口注冊證、原產(chǎn)地證��、出廠檢驗報告書��、批簽發(fā)原件及其他重要數(shù)據(jù)��;國家與省級監(jiān)督管理部門之間要及時通報涉及進(jìn)口藥品的案件和預(yù)警信息�,便于省級藥品監(jiān)督管理部門增強(qiáng)對藥品市場檢查監(jiān)督的針對性;在對進(jìn)一步完善電子通關(guān)系統(tǒng)的基礎(chǔ)上��,通過電子證照(密鑰)����、區(qū)塊鏈加密等方式核驗申報材料,并探討解決多口岸同時報關(guān)的問題�。
參考文獻(xiàn)
[1]中華人民共和國海關(guān)總署 . 2021年12月進(jìn)口主要商品量值表(人民幣值)[EB / OL].(2022-01-18)[2023-01-05].http://www.customs.gov.cn/customs/302249 /zfxxgk/2799825/302274/302277/302276/4127968/ index. html.
[2]中國一帶一路網(wǎng).“一帶一路”成醫(yī)藥外貿(mào)新增長點[EB/OL].(2020-03-18)[2023-01 -05.https//baijiahao.baidu.com/s?id=1661493954688470206.
[3]霍繼革.劉 穎.藥食同源類進(jìn)口藥材不合格處置探討及建議[J].中國食品藥品監(jiān)管�,2022(6):62-67.
[4]國家藥品監(jiān)督管理局.藥品監(jiān)督管理統(tǒng)計年度數(shù)據(jù)(2021年)[EB / OL].(2022 - 12-28][2023-01-05].https://www.nmpa.gov.cn/zwgk/tjxx/tjnb/20221228165838115. html.
[5]中國食品藥品檢定研究院 . 國家藥品抽檢年報(2021)[EB / OL].(2022-03-18)[2023-01-05].https://www.nifdc.org.cn//nifdc/bshff/gjchj/gjchjtzgg/2022031815002228792. html.
[6]王英姿 . 發(fā)展集團(tuán)型醫(yī)藥企業(yè)進(jìn)口藥品供應(yīng)鏈的機(jī)遇與挑戰(zhàn)[J]. 上海醫(yī)藥,2020,41(3):45-48.
[7]梁 謀,江志杰,李強(qiáng)等 . 2015年至2019年進(jìn)口藥品抽樣回顧性研究[J]. . 中國藥業(yè),2021,30(15):30-33.