隨著粵港澳大灣區(qū)的大力發(fā)展��,基于香港的國際貿(mào)易環(huán)境和政府寄予的優(yōu)惠政策��,越來越多的內(nèi)地企業(yè)看到了香港巨大的市場潛力�����。今天給大家聊一聊香港西藥注冊法規(guī)要求��。
1��、香港西藥監(jiān)管機構(gòu)
香港衛(wèi)生署藥物辦公室是屬于香港政府的部門單位���,在西藥監(jiān)管中主要負責注冊的行政事務(wù),藥品上市后的稽查�����,不負責藥品注冊的技術(shù)評審�����。香港藥劑業(yè)及毒藥管理局負責處理藥劑制品的注冊和分類事宜���。衛(wèi)生署藥物辦公室是執(zhí)行與藥物有關(guān)法例�����,并為藥劑業(yè)及毒藥管理局提供專業(yè)和行政支援的機構(gòu)���。
香港衛(wèi)生署藥物辦公室 (Drug Office of DH )
2���、注冊申請人要求
根據(jù)《藥劑業(yè)及毒藥規(guī)例》,藥劑制品在香港上市銷售之前���,必須向藥劑業(yè)及毒藥管理局注冊��。
根據(jù)《藥劑制品/物質(zhì)注冊申請指南》
藥劑制品在香港制造�����,注冊申請人是該藥劑制品的持牌制造商�����,或與有關(guān)持牌制造商訂立和約的持牌批發(fā)商��;
藥劑制品在香港以外生產(chǎn)制造��,注冊申請人是入口該藥劑制品的持牌批發(fā)商或者該藥劑制品的海外制造商在香港的分行���、附屬公司��、代表�����、代理商或分銷商。
3�����、西藥注冊分類
西藥可按治療疾病的程度不同及在使用過程中的副作用程度分為三大類, 不同類別的藥物會根據(jù)法規(guī)要求進行銷售��,三類藥品:
1)這類藥物必須按醫(yī)生處方配售�����,要求在有注冊藥劑師的監(jiān)督才能夠購買使用��。藥品外包裝上需要標明「Prescription Drug處方藥物」��。
2)這類藥物不需要經(jīng)過注冊醫(yī)生的處方就可以購買得到�����,但必須在注冊藥劑師的指導及監(jiān)督下才能夠銷售��。藥品的外包裝上需要標明「Drug under Supervised Sales 監(jiān)督售賣藥物」。
3) 這類藥物用于治療輕微病癥�����,不需要注冊藥劑師就可以購買得到���,
4��、藥品注冊條件
依據(jù)《藥劑制品/物質(zhì)注冊申請指南》《新藥劑或生物元素藥劑制品注冊申請指南》
1)新藥在香港申請注冊需要先提供香港衛(wèi)生署認可的32 個國家當中兩個或以上的國家的當局所發(fā)出之注冊證明�����。
2)仿制藥在香港申請注冊必須先提供原產(chǎn)國藥監(jiān)當局的藥品注冊證明書�����,文獻副本�����,以及/或者以下32 個國家中的一個所發(fā)出的能夠證明該仿制藥說明書已經(jīng)被批準的文件��。
3)制造商的藥品生產(chǎn)質(zhì)量規(guī)范GMP證明書的電子副本���,附上資料證明有關(guān)制造商符合PIC/S GMP標準��。
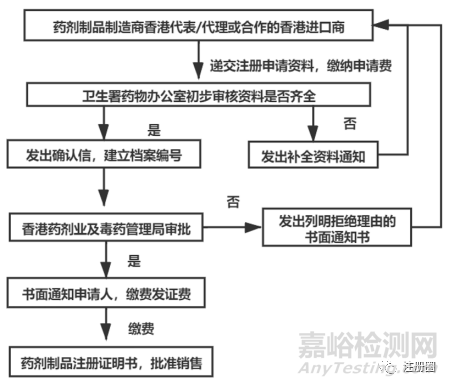
5���、西藥一般注冊流程
6、注冊資料要求
依據(jù)《藥劑制品/物質(zhì)注冊申請指南》��,西藥新申報需要提供以下資料:
1.申請人的商業(yè)登記證電子BRC副本�����;
2.制造商或行銷授權(quán)持有者發(fā)出的授權(quán)信�����,授權(quán)申請人進行藥劑制品注冊���;
3.由申請人簽署及印有申請人公司印章的附信,授權(quán)一人作為處理申請的代表���;
4.制造商牌照的電子副本��;(原產(chǎn)地國家藥監(jiān)局出具)
5.制造商的藥品生產(chǎn)質(zhì)量規(guī)范GMP證明書的電子副本��,附上資料證明有關(guān)制造商符合PIC/S GMP標準�����;(原產(chǎn)地國家藥監(jiān)局出具)
6.香港以為地方制造的藥劑制品的注冊申請時�����,申請人提供有關(guān)制造商的詳細資料��,包括制藥設(shè)備��、品質(zhì)控制及制藥技術(shù)人員的水平等(如現(xiàn)場主文件)���;
7.藥品制劑自由出售證明書或藥品制劑證明書的電子副本���,(由原產(chǎn)地國家藥監(jiān)局出具);
8.制造商提供有關(guān)藥品制劑的描述或成分資料(配方及規(guī)格)��;
9.制造商提供的藥品制劑釋放品質(zhì)量標準說明及保質(zhì)期品質(zhì)量標準壽命���,其內(nèi)容必須符合其中一個或多個藥典:CP�����、BP��、EP��、JP��、USP或國際藥典��;(成品的質(zhì)量標準)
10.在藥劑制品/物質(zhì)品質(zhì)量標準說明中列出的測試的詳細化驗分析方法��;(檢驗方法)
11.由制造商或提供測試的公司對相關(guān)制品的代表批次發(fā)出的化驗分析證明書��;(COA)
12.穩(wěn)定性測試資料:至少6個月加速穩(wěn)定性測試數(shù)據(jù)及承諾提供完整穩(wěn)定性測試數(shù)據(jù)以支持制品的保質(zhì)期���;
13.所有包裝容量各一套的標簽及銷售包裝樣本和說明書;
14.藥品制劑的彩色相片和掃描圖片�����;
15.有關(guān)制品的臨床及科學研究文獻用作證明其安全和療效���;
16.以下文件用作證明產(chǎn)品的建議用途�����、劑量�����、用法及說明書上其他資料:文獻副本�����,或一個國家藥監(jiān)局發(fā)出的已經(jīng)批準的證明說明書已被批準��;
17.提供BE證據(jù)�����,BE是按照WHO或其他國際生物等效性指導原則文件進行��;
18.生產(chǎn)過程使用動物源物料�����,生產(chǎn)商說明動物的來源地��、動物物料的性質(zhì)和制藥過程以證明符合歐洲���、美國或澳洲當局頒布的降低可傳染給人類的傳染病風險的安全措施�����;
19.有關(guān)藥劑制品由2個及以上國家當局發(fā)出的注冊證明��;
20.有關(guān)藥品制劑的安全��、療效和質(zhì)量方面的專家研究報告���,各報告內(nèi)必須包含該專家的履歷和簽署���;
21.建議在港實施的風險管理計劃和風險評估及緩解策略;
22.制品的建議說明書�����,須同時提交給相關(guān)醫(yī)護專業(yè)人員使用的藥物處方資料說明書���;
23.ICH Q3D的元素雜質(zhì)風險評估報告;
24.比較表對比本申請與其他國家/地區(qū)相同產(chǎn)品所授權(quán)的治療用途�����、劑量��,警告/注意事項,禁忌癥或副作用��;
25.產(chǎn)品的全球注冊狀態(tài)��;
26.任何其他國家/地區(qū)的藥品監(jiān)管部門曾拒絕/暫停/撤銷該產(chǎn)品的授權(quán)��。
以上內(nèi)容作為參考���,根據(jù)產(chǎn)品實際情況進行注冊資料的整理和編寫�����。
7���、注冊收費
1)藥劑制品/物質(zhì)注冊系統(tǒng)申請費:1100元港幣
2)申請獲得批準后,每款藥品/制品注冊費:1370元港幣
3)再注冊費用:HK$575
8�����、注冊遞交形式
通過衛(wèi)生署藥物辦公室的藥劑制品/物質(zhì)注冊系統(tǒng)電子遞交��,申報資料PDF格式
網(wǎng)址:https://www.drugoffice.gov.hk/prs2-ext/client_authentication.jsp
9�����、注冊有效期
有效期5年,到期再注冊���。
10�����、參考指南文件
1) 香港衛(wèi)生署藥物辦公室 (Drug Office of DH)
https://www.drugoffice.gov.hk/gb/unigb/www.drugoffice.gov.hk/eps/do/tc/pharmaceutical_trade/home.html
2) 香港藥劑業(yè)及毒藥管理局 (Pharmacy and Poisons Board)
網(wǎng)址:https://www.ppbhk.org.hk/sc_chi/functions/functions.html
3) 藥劑業(yè)及毒藥條例(香港法例第138 章)
https://www.ppbhk.org.hk/sc_chi/ordinance/138.html
4) 藥劑業(yè)及毒藥規(guī)例(香港法例第138A 章)
https://www.ppbhk.org.hk/sc_chi/ordinance/138a.html
5) 藥劑制品/物質(zhì)注冊申請指南
https://www.drugoffice.gov.hk/eps/do/tc/doc/guidelines_forms/guid_tc.pdf?v=j9d0sv
6)《新藥劑或生物元素藥劑制品注冊申請指南》
https://www.drugoffice.gov.hk/eps/do/tc/doc/guidelines_forms/Guidance_on_Reg_of_Pharm_Prod_Containing_New_Chem_or_Bio_Entity_tc.pdf