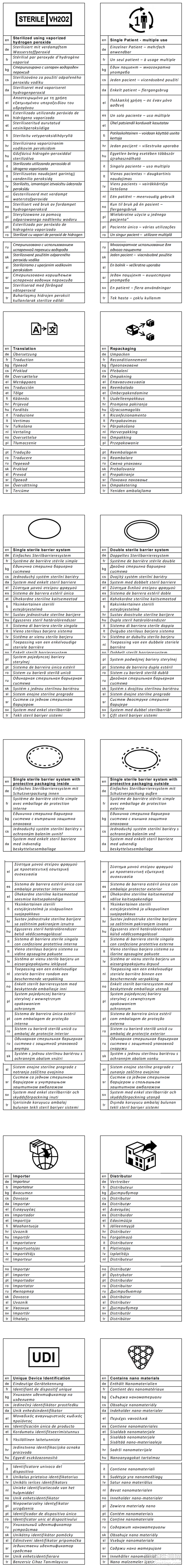
MDR法規(guī)要求在醫(yī)療器械的標簽上注明各種信息��。
歐洲有24種官方語言,這就需要根據(jù)器械提供的地方將標簽上提供的信息翻譯成多種語言�����。這個要求可以通過使用標識來處理。MDR 法規(guī)允許在標簽上使用標識作為書面語言的替代品��,具體法規(guī)信息在MDR Annex 1, chapter III中做了具體說明���,標識是高效���、節(jié)約成本和國際理解的概念,可向醫(yī)療器械用戶傳達所需信息��。
2�����、歐盟法規(guī)下的要求明細
在MDR Annex 1, chapter III有關器械隨附信息的要求, paragraph 23.2 標簽上的信息中���,概述了標簽上必須包括的內(nèi)容�����,并作為下列標識的立法參考:
以下標識可在ISO 15223-1:2021中找到���。如果一個符號是在ISO 7000中注冊的,那么它的數(shù)字引用將包括在符號標題旁邊�����。否則,沒有在ISO 7000中注冊的符號只能在ISO 15223-1:2021中找到���。
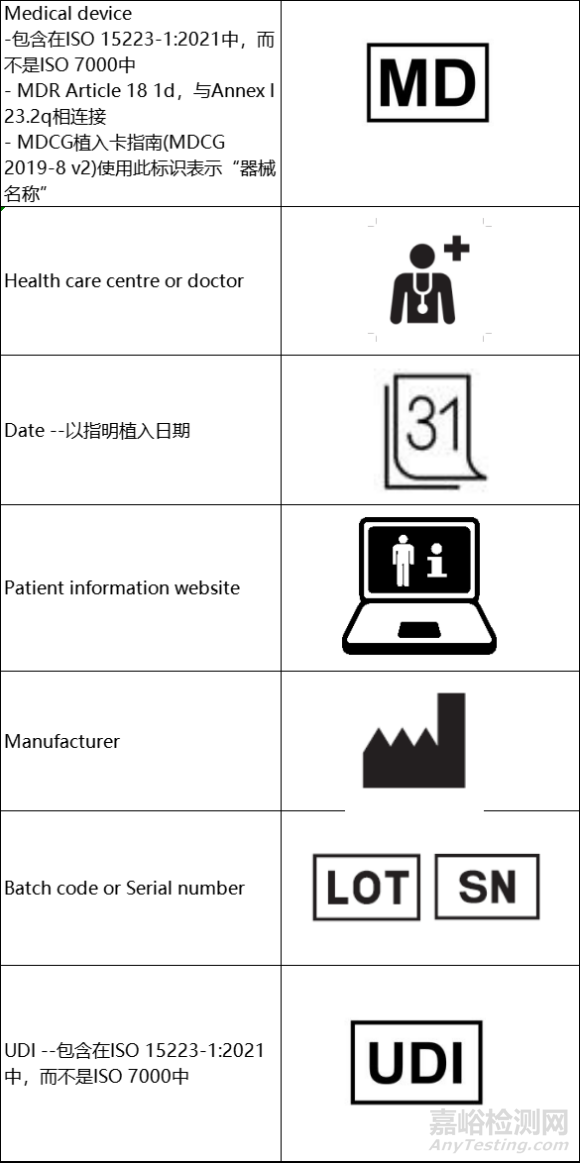
1. 醫(yī)療器械 MDR, Annex 1, 23.2, q.
2. 含有人類血液或血漿衍生物(3701) MDR, Annex 1, 23.2, e.
3.含有藥用物質(zhì)(3702) MDR, Annex 1, 23.2, e
4. 含有有害物質(zhì)(3723) MDR Annex 1, 23.2.(f)
5.含有人源的生物材料(3700) MDR, Annex 1, 23.2, e.
-此標識表示其所貼的醫(yī)療器械包含源自人類的組織或細胞���,或其衍生物
6. 含有動物源的生物材料(3699) MDR, Annex 1, 23.2, e.
-此標識表示其所貼的醫(yī)療器械含有動物源的組織或細胞或其衍生物。
7.使用蒸汽過氧化氫消毒 MDR ,AnnexI, 23.2, 1 .(滅菌方法)
8. 翻譯(3728)& 9.再包裝(3727)
•MDR Article 16 Point 3要求在器械/其包裝或隨附文件上提及這些活動:“進行第2段(A -包括翻譯)和(b -包括再包裝)所述活動的經(jīng)銷商或進口商應在器械上��,或者在不可行的情況下��,在其包裝上或在器械隨附的文件中注明所進行的活動及其名稱��,注冊商號或注冊商標���,注冊營業(yè)地點和可以聯(lián)系它的地址��,以便確定其位置��。”
這些標識已被開發(fā)用于這些實體��,以促進其遵守
10.單患者多次使用(3706)
建議使用當前的符號來表示“單患者多次使用的意思�����。
此符號是ISO 15223標準的一部分���,也是ISO 7000數(shù)據(jù)庫的一部分。它的使用得到了ISO和IMDRF文件中引用的支持���。
•參考ISO 20417: 2021 Medical devices — Information to be supplied by the manufacturer and IMDRF 2019‘’Principles of Labelling for Medical Devices and IVD Medical Devices’’, Art. 5.2.18: ‘
11. 單一無菌屏障系統(tǒng)(3707)
12. 雙重無菌屏障系統(tǒng)(3704)
13. 內(nèi)置保護性包裝的單一無菌屏障系統(tǒng)(3708)
14. 外部有保護性包裝的單一無菌屏障系統(tǒng)(3709)
MDR AnnexI GSPR 23.3�����,保持器械無菌狀態(tài)的包裝上的信息(“無菌包裝”)���,具體而言,該部分a)點:“允許無菌包裝被識別的指示”形成了這四個標識被開發(fā)的要求�����。
15. 進口商(3725)& 16.經(jīng)銷商(3724)
進口商和經(jīng)銷商在MDR 下有新的義務���,其中包括在標簽上標明他們的活動與再包裝和翻譯有關(MDR Article 16)���。開發(fā)這些標識是為了方便遵守MDR 。
17. UDI
MDR AnnexVI, Part C UDI系統(tǒng),The UDI System, 4. UDI Carrier, 4.5”如非UDI載體的AIDC載體是產(chǎn)品標簽的一部分�����,UDI載體必須易于識別。”
18. 含有納米材料(3703)
MDR 越來越重視納米材料(例如 AnnexI GSPR��,chapter II, Article 10.6)�����,雖然沒有正式要求在標簽上注明有關納米材料的具體信息��,但該符號的創(chuàng)建被認為是有用的���。
3���、標識驗證和處理
根據(jù)ISO 15223-2流程(ISO 15223-2:2010-01 Medical Devices – Symbols to be used with medical device labels, labelling, and information to be supplied – Part 2: Symbol development, selection and validation)對上述標識1,2,4,6,8 -10進行了驗證。驗證在多個地區(qū)以五種語言運行��,包括患者和醫(yī)療保健提供者��。根據(jù)上述ISO 15223-2流程對剩余的新符號進行了驗證���。
所有符號在5毫米高度(與CE MARK要求的最低高度相同)可伸縮和識別��。他們將確保醫(yī)療器械以有效的方式符合MDR ��,并將向醫(yī)療保健專業(yè)人員和患者等最終用戶清楚地傳達相關信息���。
4、標識注釋:關于標識使用的注釋
在歐盟��,這些標識必須在符合MDR 23.1. h)直到它們以統(tǒng)一的歐洲標準出版��。請注意��,歐盟以外的司法管轄區(qū)可能對“制造商提供的信息”有不同的要求��。
使用以下標簽介紹中提供的模板時:
•如果制造商的特定需求不需要某些符號���,可以從列表中刪除全部或部分符號���,但建議您始終保持所附列表中所示的相同順序。制造商總是使用相同的訂單將加快用戶識別和接受符號及其含義�����。
•請確保始終使用與ISO 7000或ISO 15223-1:2021相同的標題(以避免用戶之間的混淆)��。
5���、標識模板-標識設計�����、標題和翻譯
以下內(nèi)容包含的所有符號均可在ISO 15223-1(2021) 2021醫(yī)療器械-與制造商提供的信息一起使用的符號-第1部分:一般要求中找到���。
6�����、患者植入卡使用的推薦標識
-作為文本的替代
-根據(jù)MDR Article 18的要求��,推薦使用以下符號
-以下符號可以在ISO 15223-1:2021中找到��。如果一個符號是在ISO 7000中注冊的���,那么它的數(shù)字引用將包括在符號標題旁邊。否則�����,沒有在ISO 7000中注冊的符號只能在ISO 15223-1:2021中找到