今日頭條
邁威Nectin-4靶向ADC上III期臨床����。邁威生物Nectin-4 ADC創(chuàng)新藥9MW2821登記啟動一項III期臨床,擬評估9MW2821對比研究者選擇的化療治療既往接受過含鉑化療和PD -(L)1抑制劑治療的無法手術(shù)切除的局部晚期或轉(zhuǎn)移性尿路上皮癌的效果��。該項試驗主要研究者由復(fù)旦大學(xué)附屬腫瘤醫(yī)院醫(yī)學(xué)博士葉定偉擔(dān)任�。在II期臨床中,9MW2821單藥治療的客觀緩解率和疾病控制率分別為62.2%和91.9%��。
國內(nèi)藥訊
1.科越C5/FH1-5補體抑制劑Ⅱ期臨床積極��。科越醫(yī)藥在ASH2023年會上公布其C5/FH1-5雙靶點補體抑制劑KP104一線治療陣發(fā)性睡眠性血紅蛋白尿癥(PNH)的II期試驗積極結(jié)果�。中期數(shù)據(jù)顯示,所有接受KP104治療患者(100%)的血紅蛋白水增加≥2g/dL,其中有56%患者達到血紅蛋白正?���;?≥12g/dL);83%患者的LDH水平持續(xù)低于1.5x ULN�,72%患者的LDH水平維持在1x ULN以下。臨床中未發(fā)生3級或以上的治療相關(guān)不良事件(TEAEs)�。
2.亙喜FasTCAR-T療法最新臨床數(shù)據(jù)積極。亙喜生物在ASH2023年會上公布其靶向BCMA/CD19雙靶點自體FasTCAR-T產(chǎn)品GC012F一線治療多發(fā)性骨髓瘤(NDMM)的臨床試驗(IIT)最新結(jié)果��。中位隨訪為18.8個月時�,GC012F治療達到100%的總體應(yīng)答率(ORR)和95%的微小殘留病灶陰性(MRD-)嚴格完全緩解(sCR)率;中位緩解持續(xù)時間(DOR)和中位無進展生存期(PFS)均未達到����。臨床中未出現(xiàn)新的安全性信號。
3.神曦AAV基因療法獲膠質(zhì)瘤孤兒藥資格�。神曦生物自研AAV基因治療產(chǎn)品NXL-004獲FDA授予孤兒藥資格,用于治療惡性膠質(zhì)瘤��。NXL-004是神曦生物利用其原位神經(jīng)再生技術(shù)平臺開發(fā)的創(chuàng)新型基因治療藥物�。原位神經(jīng)再生技術(shù)是通過病毒或非病毒載體將神經(jīng)轉(zhuǎn)錄因子遞送到病變部位��,使得受損神經(jīng)元周圍的星形膠質(zhì)細胞向神經(jīng)元進行轉(zhuǎn)分化����。該產(chǎn)品擬開發(fā)用于治療膠質(zhì)瘤����。
4.通化東寶GLP-1/GIP激動劑獲批臨床����。通化東寶1類化藥注射用THDBH120獲國家藥監(jiān)局臨床試驗?zāi)驹S可,擬開發(fā)用于治療2型糖尿病����。THDBH120是一款GLP-1/GIP雙靶點激動劑,其將GLP-1和GIP這兩種促胰島素的作用整合至一個多肽單分子中�,且通過進一步分子設(shè)計提高代謝穩(wěn)定性,改善血糖控制�。目前,禮來開發(fā)的同靶點藥物Tirzepatide已獲得FDA批準(zhǔn)上市�,用于治療2型糖尿病,以及治療肥胖或超重患者�。
5.百利天恒HER3/EGFR雙抗ADC授權(quán)BMS。百利天恒藥業(yè)子公司SystImmune宣布與百時美施貴寶就其臨床后期HER3/EGFR雙抗ADC新藥BL-B01D1達成合作許可協(xié)議����,兩家公司將在美國共同開發(fā)和商業(yè)化BL-B01D1,用于治療一系列實體瘤(包括NSCLC和乳腺癌)�。根據(jù)協(xié)議,SystImmune將獲得8億美元的預(yù)付款,開發(fā)�、監(jiān)管和銷售里程碑后期付款,總潛在交易金額高達84億美元�。百時美施貴寶將負責(zé)BL-B01D1的全球(中國以外)開發(fā)和商業(yè)化。
國際藥訊
1.MAGE-A4抗原靶向TCR-T療法報滾動BLA��。Adaptimmune公司已完成向FDA滾動提交其靶向MAGE-A4抗原的TCR-T產(chǎn)品afami-cel的生物制品許可申請(BLA)�,用于治療晚期滑膜肉瘤。Ⅱ期試驗SPEARHEAD-1(NCT04044768)隊列1數(shù)據(jù)顯示��,中位隨訪為27.8個月時����,滑膜肉瘤患者的總體緩解率(ORR)約為39%;中位反應(yīng)持續(xù)時間約為12個月��。12個月OS概率為90%��,24個月OS概率為70%�。該產(chǎn)品有望成為滑膜肉瘤的首創(chuàng)療法。
2.諾華C3腎小球病III期臨床成功�。諾華口服補體B因子抑制劑iptacopan治療C3腎小球病的III期APPEAR-C3G研究達到主要終點。與安慰劑相比��,iptacopan(200mg)治療6個月時顯著改善患者的蛋白尿情形��,Iptacopan的安全性與之前報告的數(shù)據(jù)一致����。就在上周,該新藥獲FDA批準(zhǔn)上市����,成為首個口服單藥療法,用于治療成人陣發(fā)性夜間血紅蛋白尿癥(PNH)��。
3.羅氏/Poseida現(xiàn)貨型CAR-T早期臨床積極����。Poseida公司與羅氏開發(fā)的同種異體CAR-T療法P-BCMA-ALLO1在治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤(RRMM)的Ⅰ期臨床結(jié)果積極。在接受充分淋巴細胞耗竭的強化預(yù)治療患者中�,P-BCMA-ALLO1治療的客觀緩解率(ORR)為82%(n=9/11);在既往未接受過BCMA靶向雙特異性T細胞銜接抗體治療患者的ORR則為100%����。此外,藥物總體耐受性良好����。
4.“現(xiàn)貨型”NK細胞組合早期臨床積極。Affimed公司在ASH2023年會上公布其靶向CD16/CD30免疫細胞銜接蛋白(ICE)AFM13與同種異體自然殺傷(NK)細胞聯(lián)用治療復(fù)發(fā)/難治性霍奇金淋巴瘤(HL)的Ⅰ/Ⅱ期臨床積極結(jié)果�。數(shù)據(jù)顯示��,AFM13聯(lián)合用藥的總體ORR為93%�,CR率為67%��;在接受RP2D治療的32例HL患者中�,治療方案的ORR為97%,CR率為78%��。此外��,AFM13組合總體安全性良好�。
5.Editas公司CRISPR基因編輯療法最新數(shù)據(jù)積極。Editas公司在ASH2023年會上公布其CRISPR基因編輯療法EDIT-301(reni-cel)治療嚴重鐮刀型細胞貧血病(SCD)和輸血依賴性β地中海貧血(TDT)的兩項臨床(RUBY和EdiTHAL)最新結(jié)果��。在5-18個月隨訪期間����,所有SCD患者自接受reni-cel輸注后均未出現(xiàn)血管閉塞性事件(VOEs);在EdiTHAL試驗中�,患者的總血紅蛋白和胎兒血紅蛋白增加,總血紅蛋白升高超過輸血非依賴性閾值9g/dL����。兩項試驗中,reni-cel均耐受良好��。
6.Spyre公司融資推進開發(fā)IBD創(chuàng)新抗體。Spyre公司宣布完成1.8億美元融資�,以用于支持其炎癥性腸?。↖BD)治療性抗體(SPY001、SPY002和SPY003等)進入臨床開發(fā)����。SPY001是一款工程化改造延長半衰期的α4β7單抗,預(yù)期2024年上半年進入首個人體研究�;SPY002是一種高效選擇性TL1A單抗,將于2024年下半年開展Ⅰ期臨床研究;SPY003是一款靶向IL-23的p19亞基的單克隆抗體�。
醫(yī)藥熱點
1.同濟大學(xué)醫(yī)學(xué)院皮膚病研究所成立。為更好地開展高水平皮膚病臨床診療��、基礎(chǔ)及臨床研究工作��,同濟大學(xué)醫(yī)學(xué)院學(xué)術(shù)委員會批準(zhǔn)成立同濟大學(xué)醫(yī)學(xué)院皮膚病研究所����,上海市皮膚病醫(yī)院李斌院長擔(dān)任研究所所長。同濟大學(xué)醫(yī)學(xué)院皮膚病研究所將以“臨床-研究-轉(zhuǎn)化-臨床”模式為導(dǎo)向�,實現(xiàn)“開放、流通����、聯(lián)合��、競爭”的運行機制�,深化醫(yī)教協(xié)同��、科教融合�,建立基礎(chǔ)研究、臨床研究�、轉(zhuǎn)化應(yīng)用于一體的醫(yī)、工��、研交叉創(chuàng)新機制����,建立國內(nèi)一流、國際領(lǐng)先的皮膚病臨床診治研究中心��。
2.北京大學(xué)第六醫(yī)院臨床試驗研究中心揭牌����。近日,北京大學(xué)第六醫(yī)院臨床試驗研究中心正式揭牌成立��。此次醫(yī)院成立臨床試驗研究中心�,旨在通過整合藥物臨床試驗機構(gòu)和研究型病房,集中醫(yī)院優(yōu)勢的臨床試驗�、科學(xué)研究�、臨床診療等資源��,更有效地開展藥物和醫(yī)療器械臨床試驗�、生物醫(yī)學(xué)新技術(shù)臨床應(yīng)用觀察等臨床研究,探索新的診療技術(shù)和方法�,更好地解決疑難危重癥��,提高精神疾病的診療水平��。
3.北京積水潭醫(yī)院小湯山康復(fù)中心啟用��。北京積水潭醫(yī)院和北京小湯山醫(yī)院合作共建的北京積水潭醫(yī)院小湯山康復(fù)中心8日正式啟用��?���?祻?fù)中心將為北京及全國患者提供臨床和康復(fù)連續(xù)性、高質(zhì)量醫(yī)療服務(wù)��,共同打造北京市及國家級骨科康復(fù)中心和教學(xué)科研平臺����。病區(qū)目前開放床位80張,計劃二期開放床位200張�、三期開放床位超300張��。設(shè)有骨與關(guān)節(jié)康復(fù)病區(qū)��、脊柱脊髓損傷康復(fù)病區(qū)及心肺重癥康復(fù)病區(qū)等三個病區(qū)�,主要收治骨與關(guān)節(jié)疾病或術(shù)后��、中樞及周圍神經(jīng)損傷����、脊柱脊髓損傷、心肺疾病及重癥康復(fù)等患者����。
評審動態(tài)
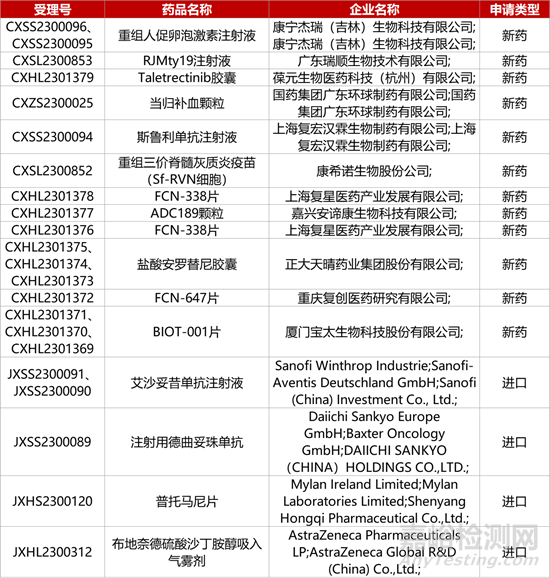
1. CDE新藥受理情況(12月12日)
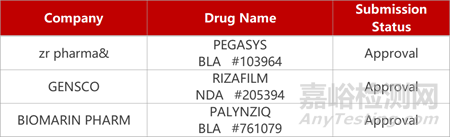
2. FDA新藥獲批情況(北美12月09日)