多肽類藥物安全性評價(jià)是缺少特定指導(dǎo)原則的。ICH M3(R2)更多是針對小分子����,ICH S6(R1)則適用于大分子�����。多肽藥物分子量介于兩者之間����,制備方式既有化學(xué)合成��,也有發(fā)酵所得��。選擇1998-2019年間FDA批準(zhǔn)的46個(gè)多肽藥物進(jìn)行分析��,其中21個(gè)是化學(xué)合成的�����、6個(gè)半合成����、18個(gè)重組表達(dá)����、1個(gè)是天然產(chǎn)品����。其中�����,5個(gè)BLA上市����,41個(gè)NDA上市。本文就多肽類藥物一般毒理研究��、遺傳毒性研究��、免疫原性測定��、生殖和發(fā)育毒性��、雜質(zhì)、安全藥理測定����、非蛋白原性氨基酸等相關(guān)內(nèi)容進(jìn)行簡單總結(jié)分享。
多肽藥物從20世紀(jì)初就開始用于臨床����,早期主要是從天然產(chǎn)物中提取��,包括激素替代物胰島素����、促腎上腺皮質(zhì)激素�����、抗菌藥桿菌肽、多粘菌素B等�����。20世紀(jì)70年代開始,合成的激素類藥物開始出現(xiàn)����,包括去氨加壓素�����、性腺激素等����。隨著技術(shù)的發(fā)展����,目前重組表達(dá)技術(shù)逐漸成為主流,包括甲狀旁腺激素和胰高血糖素��、杜拉魯肽、胰島素類似物等����。已經(jīng)有超過100種肽類藥物上市��。
多肽類藥物是如何定義的呢����?關(guān)于這點(diǎn),其實(shí)是有一定爭議的����。通常����,多肽藥物氨基酸數(shù)量在3-100之間。一些非核糖體肽來源的分子����,比如棘白菌素抗真菌藥卡泊芬凈����、米卡芬凈����,脂糖肽類抗菌藥萬古霉素��、達(dá)巴萬星��、特拉萬星��,以及其它天然產(chǎn)物衍生的非核糖體肽藥物環(huán)保菌素�����、博來霉素等��,F(xiàn)DA認(rèn)為屬于小分子類別��。而用重組DNA技術(shù)表達(dá)的分子量更大的線性肽��,如胰島素類似物、甲狀旁腺激素����、人胰島素生長因子��、重組水蛭素等,雖然很多情況是由FDA CDER部門審評(生物藥通常由CBER審評)�����,但通常被視為生物藥��。2020年3月����,F(xiàn)DA對肽類藥物進(jìn)行了分類�����,對于重組表達(dá)的超過40個(gè)氨基酸的分子被視為生物藥物����,按照BLA管理����。對于小于40個(gè)氨基酸的分子(無論通過何種途徑制備),或者通過化學(xué)合成制備的小于100個(gè)氨基酸多肽����,被視為新分子實(shí)體,按照NDA途徑申請����。比如已經(jīng)上市的GLP-1受體激動(dòng)劑��, Fc融合的度拉糖肽和白蛋白融合的阿必魯肽氨基酸數(shù)量遠(yuǎn)超40個(gè)�����,按照BLA路徑申報(bào)��。艾塞那肽39個(gè)氨基酸組成,化合學(xué)成所得�����,按照NDA路徑申報(bào)��。
多肽藥物在小分子和大分子之間的游走��、不確定性��,為這類藥物的非臨床評價(jià)帶來很多挑戰(zhàn)����,是遵循化藥的指南還是生物藥的法規(guī)呢��?所屬類別不同��,種屬選擇邏輯��、免疫原性評估等方面均會有區(qū)別��。
一般毒理
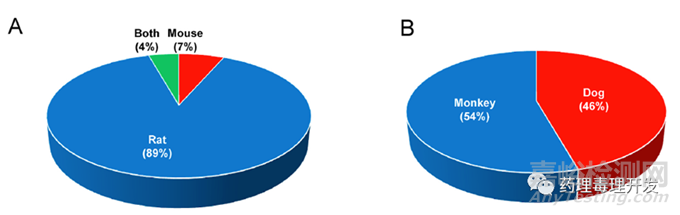
雖然ICH M3(R2)提及多肽藥物不在該指南范圍內(nèi),ICH S6(R1)則將化學(xué)合成或重組表達(dá)的多肽納入指導(dǎo)范圍����,但實(shí)際情況是�����,幾乎所有多肽類藥物均參照了ICH M3(R2)開展嚙齒類和非嚙齒類毒理研究����。不過�����,F(xiàn)DA綜述資料里面并未提及如何選擇的種屬,從結(jié)果看����,89%(41/46)嚙齒類種屬選擇的大鼠,非嚙齒類則比較均衡��,46%(21/46)采用的犬��,54%(25/46)選擇的食蟹猴��。多肽類藥物的種屬選擇應(yīng)該參照生物藥思路更多一些。
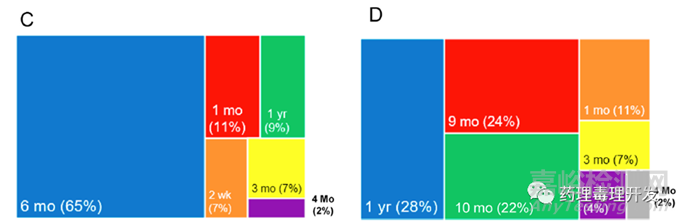
74%嚙齒類研究最長給藥周期持續(xù)超過6個(gè)月(C圖),74%非嚙齒類研究最長給藥周期持續(xù)超過9個(gè)月(D圖)�����。當(dāng)然��,這是最長給藥周期��,通常用于支持產(chǎn)品NDA/BLA�����,支持IND一般不需要開展如此長周期的研究����,可根據(jù)臨床試驗(yàn)方案和推進(jìn)進(jìn)度��,分階段開展����。另外��,大部分肽類藥物適用于慢性病如糖尿病等治療�����,用藥周期長�����,超過3個(gè)月��,所以最長給藥周期基本是指導(dǎo)原則要求的上限��。
生殖和發(fā)育毒性
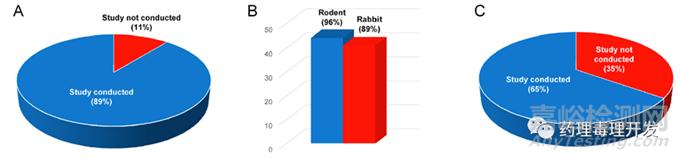
幾乎所有多肽藥物均開展了Ⅰ段嚙齒類生育力研究、Ⅱ段嚙齒類或家兔胚胎-胎仔發(fā)育毒性研究和Ⅲ段嚙齒類出生前��、出生后發(fā)育毒性研究����。具體比例參見下圖。
含非蛋白質(zhì)氨基酸的多肽
非蛋白質(zhì)氨基酸(Non-Proteogenic Amino Acids, NPAA)是相對于組成蛋白質(zhì)的20種常見氨基酸而言����,指除組成蛋白質(zhì)的20種常見氨基酸以外的含有氨基和羧基的化合物�����。有時(shí)為改善靶點(diǎn)親和力或穩(wěn)定性��,會考慮引入非蛋白質(zhì)氨基酸��。NPAA既可以是天然氨基酸也可以是非天然氨基酸��。21/47(45%)多肽類藥物含有至少1個(gè)NPAAs,平均3.5個(gè)NPAAs����。那么含有NPAAs的肽類藥物需要額外開展毒理研究嗎?大多數(shù)藥物未被要求開展額外研究�����,哪怕使用的NPAA非常新��,從未在多肽類藥物中使用過��。40多個(gè)多肽藥物中����,只有2例藥物被FDA要求開展額外毒理研究��,bivaluridine和icatibant��。原因是這兩個(gè)藥物原液的雜質(zhì)中均含有2個(gè)NPAAs��,額外開展了重復(fù)給藥毒性或細(xì)菌回復(fù)突變試驗(yàn)�����。
免疫原性測定
67%(21/46)的肽類藥物進(jìn)行了ADA檢測,其中19/21開展了臨床前和臨床的ADA檢測����。比較有意思的是凡是臨床前ADA陽性的藥物,臨床的ADA檢測結(jié)果也是陽性的����。反之則不成立�����,臨床前陰性的�����,臨床既有陽性也有陰性��。ADA的產(chǎn)生與分子大小相關(guān)�����,產(chǎn)生ADA的肽類藥物氨基酸數(shù)量為8-84個(gè)。不過��,90%的肽類藥物產(chǎn)生的ADA對藥物的PK和藥效沒有影響����。還有一個(gè)現(xiàn)象,76% ADA陽性的藥物并未進(jìn)行中和抗體檢測����。以上描述性統(tǒng)計(jì)結(jié)果可以看出,通常小分子不做ADA檢測��,生物藥基本都會做����,肽類藥物介于二者之間����,三分之二的藥物開展了ADA檢測����。其實(shí)很多小肽免疫原性很低,即使添加佐劑��,想獲得抗藥抗體都不太容易��,所以肽類藥物因免疫原性影響成藥的風(fēng)險(xiǎn)較傳統(tǒng)生物藥低很多����。但如果多肽分子量比較大,比如有幾十個(gè)氨基酸����,或者很多多肽藥物做了長效化修飾,比如融合了人Fc����、PEG等��,或者不同靶點(diǎn)的多肽進(jìn)行了融合��,ADA的風(fēng)險(xiǎn)提高��,評估起來就需要更加謹(jǐn)慎。
雜質(zhì)研究
關(guān)于雜質(zhì)問題�����,更多還是來自化藥評價(jià)的思路��。57%(16/28)的經(jīng)化學(xué)合成����、半合成的多肽藥物被FDA要求開展單獨(dú)的雜質(zhì)毒理研究����,包括體外遺傳毒性或一般毒理研究。但關(guān)于多肽藥物雜質(zhì)問題����,其實(shí)沒有很明確的說法,能參考的指南還是ICH Q3A和ICH Q3B��。
生物轉(zhuǎn)化和PK研究
對于合成�����、半合成多肽,基本都開展了詳細(xì)的生物轉(zhuǎn)化研究�����,包括體外代謝����、代謝物結(jié)構(gòu)表征�����、代謝物體內(nèi)表征等,類似化藥的思路����。
遺傳毒性研究
通常生物藥是不需要開展遺傳毒性研究的�����。對于化藥,細(xì)菌回復(fù)突變��、染色體畸變及體內(nèi)微核的遺傳毒性組合試驗(yàn)是需要開展的��。肽類藥物雖然介于二者之間�����,但85%(39/46)的藥物開展了遺傳毒性相關(guān)試驗(yàn)����。39個(gè)肽類藥物的組成是:100%化學(xué)合成多肽(21/21)����、61%(11/18)重組肽����、100%(6/6)半合成肽�����、1個(gè)天然肽�����。不難看出�����,對于全合成����、半合成肽����、天然肽����,通常需要開展遺傳毒性研究,重組表達(dá)肽則要視情況而定�����,不是必須的��。而且����,全合成��、半合成肽����、天然肽開展的是完整的遺傳毒性標(biāo)準(zhǔn)組合試驗(yàn)����,11個(gè)開展遺傳毒研究的重組肽中�����,僅7個(gè)開展了完整標(biāo)準(zhǔn)組合試驗(yàn),剩余4個(gè)僅選擇性開展了其中部分試驗(yàn)�����。39個(gè)多肽中僅2個(gè)出現(xiàn)陽性��,而且是細(xì)菌回復(fù)突變陽性��,染色體畸變陰性����。這2個(gè)細(xì)菌回復(fù)突變陽性的多肽��,glucagon和etelcalcetide����,前者之后被證明是假陽性��,后者經(jīng)進(jìn)一步體內(nèi)外遺傳學(xué)研究后��,也判定為遺傳毒性陰性����。所以����,39個(gè)開展遺傳毒性研究的多肽,結(jié)果都是陰性的��。
安全藥理學(xué)
按照ICH S7B����,49%(20/41)多肽藥物開展了體外鉀離子通道安全藥理研究—hERG試驗(yàn)�����。大多數(shù)多肽藥物開展了單獨(dú)的大鼠和/或犬的心血管和呼吸系統(tǒng)安全藥理學(xué)研究��,個(gè)別采用非人靈長類進(jìn)行的研究。
致癌試驗(yàn)
50%(23/46)的多肽藥物開展了致癌性研究����。其中��,16/23開展了兩個(gè)嚙齒類種屬的致癌試驗(yàn)�����,7/23僅開展了1個(gè)嚙齒類種屬的研究�����。不開展致癌試驗(yàn)的原因包括:1)臨床給藥周期短��;2)腫瘤適應(yīng)癥��;3)ADA的影響�����;4)有些作用機(jī)制產(chǎn)品已明確致癌風(fēng)險(xiǎn)��,企業(yè)在說明書中直接注明致癌陽性�����,如GLP-1激動(dòng)劑引發(fā)的甲狀腺C細(xì)胞腫瘤。
13/23個(gè)開展致癌試驗(yàn)的肽類藥物的結(jié)果是陽性的����,其中7個(gè)作用于GLP-1靶點(diǎn)����。前文已經(jīng)提及����,所有多肽藥物的遺傳毒性結(jié)果都是陰性的��,故致癌陽性基本都是藥物藥理作用引起的����。比如胰島素具有促有絲分裂的作用����,賴谷胰島素和甘精胰島素對嚙齒類動(dòng)物具有致癌作用。
總結(jié)
對于化藥��、生物藥沒有太大區(qū)別的試驗(yàn)�����,比如生殖毒性、安全藥理、致癌�����,無論大分子還是小分子����,需不需要開展����,考量的因素是類似的�����。但對于ADA評價(jià)����、遺傳毒性��、體外代謝��、雜質(zhì)研究��、相關(guān)動(dòng)物種屬選擇��,就需要明確多肽藥物的歸屬����,到底是按照M3還是S6。由于缺少特定的針對多肽藥物的指南�����,多數(shù)多肽類藥物還是按照化藥的思路開展非臨床安評�����。沒有統(tǒng)一的指南����,就很難有統(tǒng)一的行業(yè)操作標(biāo)準(zhǔn)�����,大家也是根據(jù)自己的理解����、過往產(chǎn)品的研究經(jīng)驗(yàn)����,化藥和生物藥交叉結(jié)合的思路設(shè)計(jì)非臨床試驗(yàn)����。已經(jīng)上市的多肽類藥物很多,可以根據(jù)自己產(chǎn)品的特點(diǎn)比如靶點(diǎn)�����、作用機(jī)制����、適應(yīng)癥等�����,結(jié)合已上市藥物的經(jīng)驗(yàn)�����,必要時(shí)跟監(jiān)管機(jī)構(gòu)溝通����,合理設(shè)計(jì)非臨床研究策略。