摘 要
男性生殖系統(tǒng)用藥的生殖毒性評價具有特殊性,需要關(guān)注雄性生殖毒性風(fēng)險,還需關(guān)注雄性介導(dǎo)的發(fā)育毒性風(fēng)險����。對于男性生殖系統(tǒng)用藥,需基于其特殊性����,具體問題具體分析����,綜合受試物的藥理/毒理作用機制、同類藥物信息、組織分布(精液分布)����、適應(yīng)證特點等因素來開展合適的生殖毒性試驗����。不同適應(yīng)證對于生殖毒性風(fēng)險的接受程度不同,需根據(jù)相關(guān)試驗結(jié)果進行獲益-風(fēng)險綜合評價����,制定相應(yīng)的風(fēng)險管控措施����,以降低臨床試驗中受試者和臨床應(yīng)用中患者的生殖毒性風(fēng)險����。本文闡述了國際人用藥品注冊技術(shù)要求協(xié)調(diào)會和監(jiān)管機構(gòu)相關(guān)指導(dǎo)原則的相關(guān)要求����,梳理分析已批準(zhǔn)上市男性生殖系統(tǒng)用藥的生殖毒性研究情況,并在此基礎(chǔ)上提出了男性生殖系統(tǒng)用藥生殖毒性評價需要關(guān)注的要點����。
生殖毒性是指外源性物質(zhì)產(chǎn)生的對生殖細(xì)胞、受孕����、妊娠����、分娩、哺乳等親代生殖機能的不良影響����,以及對子代胚胎-胎仔發(fā)育����、出生后發(fā)育的不良影響����。雄性生殖系統(tǒng)可能受到外界化學(xué)物質(zhì)的干擾而造成損傷,包括睪丸、附睪����、精子生成和質(zhì)量以及激素分泌系統(tǒng)等損傷。藥物雄性生殖毒性主要是指藥物對雄性生殖系統(tǒng)(睪丸����、附睪等)及生殖功能造成損傷����,一般包括生殖器官器質(zhì)性改變����、精子數(shù)量和/或質(zhì)量下降、性行為改變����、生育力降低、性激素分泌異常等,以及通過精子遺傳物質(zhì)傳遞����,和/或精液-陰道攝入而產(chǎn)生的胚胎-胎仔發(fā)育毒性����。男性生殖系統(tǒng)用藥作為一類特殊治療領(lǐng)域的藥物,直接作用于男性生殖系統(tǒng)����,部分品種參與內(nèi)分泌系統(tǒng)的調(diào)節(jié)和反饋����,而且該類藥物一般用藥周期較長或可能反復(fù)用藥����,具有較高的生殖毒性風(fēng)險����,尤其是雄性生殖毒性風(fēng)險����,因此需重點關(guān)注生殖毒性。本文闡述了國際人用藥品注冊技術(shù)要求協(xié)調(diào)會( ICH)和藥品監(jiān)管機構(gòu)相關(guān)指導(dǎo)原則的要求����,并梳理分析了國內(nèi)外批準(zhǔn)上市男性生殖系統(tǒng)用藥的生殖毒性試驗研究情況,探討男性生殖系統(tǒng)用藥生殖毒性風(fēng)險評價的關(guān)注要點����,以期為該類藥物研究與評價提供參考����。
1����、男性生殖系統(tǒng)用藥生殖毒性研究的監(jiān)管要求
1.1ICH指導(dǎo)原則
ICH M3(R2)《支持藥物進行臨床試驗和上市的非臨床安全性研究指導(dǎo)原則》中在第11節(jié)中提出了藥物生殖毒性試驗階段性研究的一般性要求����。針對男性用藥人群����,ICH M3(R2)中指出“因在重復(fù)給藥毒性試驗中評價了藥物對生殖器官的影響����,所以在雄性生育力試驗完成前,男性受試者可以入選Ⅰ和Ⅱ期臨床試驗����。應(yīng)在大規(guī)模或長期的臨床試驗(如Ⅲ期)開始前完成雄性生育力試驗”����,注釋2提出了重復(fù)給藥毒性試驗的雄性動物生殖器官評價的要求為:在期限至少2周的重復(fù)給藥毒性試驗(通常為嚙齒類動物)中進行睪丸全面標(biāo)準(zhǔn)組織病理學(xué)檢查����。《ICH M3問與答》指出“ICH M3(R2)指導(dǎo)原則并未就男性專用藥進行胚胎-胎仔發(fā)育試驗給予建議����。男性專用藥的胚胎-胎仔發(fā)育試驗應(yīng)遵循具體情況具體分析原則”,指出“在潛在生殖和發(fā)育風(fēng)險明確之前,在男性中采取避孕措施是常規(guī)做法”����。
ICH S5(R3)《人用藥物生殖與發(fā)育毒性檢測指導(dǎo)原則》為支持藥物進行臨床試驗和上市申請所需的非臨床生殖與發(fā)育毒性試驗(國內(nèi)稱為“生殖毒性試驗”)提出了國際協(xié)調(diào)要求。其中����,針對生育力與早期胚胎發(fā)育試驗(FEED)的策略����,指出“當(dāng)為支持目標(biāo)人群的暴露需要進行一項FEED試驗時,大多數(shù)情況下預(yù)期包含交配階段����。這種試驗通常采用嚙齒類動物����。如果預(yù)期對生育力無不良影響����,可以在同一試驗中對2種性別進行給藥和合籠。如果該試驗確定了對生育力有影響����,則應(yīng)確定受影響的性別����。相反,如果根據(jù)作用機制或重復(fù)給藥毒性試驗的結(jié)果預(yù)期會有不良影響����,則每一給藥的單性別可與未給藥的對應(yīng)性別進行合籠����。這可以在單個試驗中使用單獨的給藥臂來實現(xiàn),也可以通過進行2個單獨的FEED試驗來實現(xiàn)����。對生育力和早期胚胎發(fā)育不良影響的可逆性評估����,對風(fēng)險評估具有重要影響”����。
ICH S5(R3)中針對雄性動物FEED試驗設(shè)計,指出“對雄性嚙齒類動物的FEED試驗設(shè)計包括合籠前給藥2~4周����,以使得能檢測對精子生成和附睪運輸?shù)挠绊?���。?dāng)重復(fù)給藥毒性試驗資料表明藥物對睪丸有毒性時����,延長合籠前給藥時間至10周是合適的,這使得能評估對完整生精周期和附睪運輸?shù)挠绊?���。FEED試驗還可檢測功能性影響(例如性欲����、附睪精子成熟����、射精)����,而這些功能性影響不能通過雄性生殖器官的組織學(xué)檢查來檢測”����。另外����,ICH S5(R3)還指出“當(dāng)基于藥物的作用機制或以往的試驗資料對生育力有擔(dān)憂的理由時,可以在重復(fù)給藥毒性試驗和/或生育力試驗中納入額外的檢查(例如,采集精子進行精子計數(shù)和形態(tài)/活力評估����、測量激素水平或監(jiān)測動情/月經(jīng)周期),以進一步描述藥物對生育力的潛在影響”。
ICH S5(R3)針對生物制品提出特殊考慮����。對于生物制品����,若在嚙齒類動物或兔中有藥理學(xué)活性,推薦在一種種屬中進行FEED試驗����。在非人靈長類動物(NHP)是唯一的藥理學(xué)相關(guān)種屬(如對于許多單抗)情況下,在給藥期限至少3個月以上的重復(fù)給藥毒性試驗中對生殖組織進行組織病理學(xué)檢查可作為生育力評估的一種替代方法����。這種方法應(yīng)包括對雌性和雄性動物的生殖器官進行詳細(xì)全面的組織病理學(xué)檢查����,且在試驗開始時動物應(yīng)達(dá)到性成熟(除非該生物制品擬用于治療晚期癌癥)。ICH S5(R3)在其注釋1中提出了重復(fù)給藥毒性試驗中雌雄動物組織病理學(xué)檢查的要求,其中,對于雄性動物的要求為睪丸和附睪應(yīng)采用能保存生精上皮組織結(jié)構(gòu)的方法進行取材和處理����;對生精周期進行詳細(xì)的顯微鏡定性評價是檢測對精子發(fā)生影響的靈敏方法;盡管一般沒有必要����,但在試驗設(shè)計中納入附加的試驗終點(例如免疫組織化學(xué)、抗均質(zhì)化的精子計數(shù)����、流式細(xì)胞術(shù)、分期定量分析),可用于進一步表征任何已確證的影響����。
1.2美國指導(dǎo)原則
美國食品藥品監(jiān)督管理局(FDA)于2018年10月正式發(fā)布了《藥物研發(fā)過程中睪丸毒性評價指導(dǎo)原則》����。該指導(dǎo)原則討論了關(guān)于可能對睪丸產(chǎn)生不良影響(睪丸毒性)的藥物的下列主題:①提示藥物臨床睪丸毒性風(fēng)險的非臨床發(fā)現(xiàn),以及對評估這種風(fēng)險的程度而可能需要的非臨床試驗;②當(dāng)對男性受試者首次給予這些藥物時����,可采用的臨床監(jiān)測����;③主要目的為評估藥物相關(guān)睪丸毒性的臨床試驗的設(shè)計����。
關(guān)于非臨床評價方面,F(xiàn)DA認(rèn)為:雄性生殖系統(tǒng)的非臨床評價是藥物開發(fā)過程中非臨床安全性評價的一個標(biāo)準(zhǔn)組成部分。動物中對雄性生殖系統(tǒng)的藥物相關(guān)毒性結(jié)果����,特別是合適動物種屬的雄性生殖器官中藥物蓄積證據(jù),確定是否有必要評價藥物對男性的睪丸毒性����。評估睪丸毒性常規(guī)采用以下方法:①2種動物種屬給藥2~4周的重復(fù)給藥毒性試驗,除非只有一種藥理學(xué)相關(guān)動物種屬����;②嚙齒類動物雄性生育力評估(如適用)。其他信息可來源于胚胎-胎仔生殖發(fā)育毒性試驗以及出生前����、新生仔或幼齡動物暴露后的生育力評估,另外����,還應(yīng)考慮已知的藥物類別效應(yīng)和/或潛在的靶點相關(guān)效應(yīng)。該指導(dǎo)原則還提出的非臨床試驗設(shè)計時的一些考慮點����,詳見指導(dǎo)原則Ⅲ.B節(jié)����。
一般來說����,引起對生育力損傷擔(dān)憂的雄性動物的生殖毒性結(jié)果包括(但不限于):睪丸萎縮、變性����、壞死或細(xì)胞數(shù)量過少;生精小管變性或壞死增加����;生殖細(xì)胞耗竭;或者其他可能提示生殖功能受損的病理學(xué)變化����。此外����,在其他相關(guān)雄性生殖器官(如前列腺����、精囊����、附睪)的發(fā)現(xiàn)可能提示睪丸毒性。對與生殖功能下降和/或不良組織病理學(xué)相關(guān)的直接作用的睪丸毒性物質(zhì)����,申請人應(yīng)考慮睪丸功能的臨床評估。
該指導(dǎo)原則中列出了增加雄性生育力擔(dān)憂的非臨床研究的10種結(jié)果:①發(fā)生于臨床相關(guān)暴露量或臨床暴露量低倍數(shù)時的發(fā)現(xiàn)����;②發(fā)生于多個動物種屬中的發(fā)現(xiàn)。③隨著暴露時間延長發(fā)生率和嚴(yán)重程度升高的發(fā)現(xiàn)����;④在末次給藥后1至2個生精周期或5個半衰期后����,發(fā)現(xiàn)未恢復(fù)或僅顯示部分恢復(fù)����;⑤在成對器官中雙側(cè)均出現(xiàn)的發(fā)現(xiàn);⑥在健康未給藥動物中罕見的發(fā)現(xiàn)����;⑦與不良病理學(xué)相關(guān)的生殖器官重量改變(升高或降低);⑧雄性生育力降低和交配行為受損����;⑨精子質(zhì)量的不良影響(數(shù)量、活力或形態(tài))����;⑩激素紊亂的表現(xiàn)為抗雄激素表現(xiàn)-雄性性器官重量和成熟降低,包括精囊和前列腺(當(dāng)其與其分泌物稱重)����,提示攻擊性降低的臨床癥狀(例如����,嗜睡或交配行為減少����,雄性動物雌性化)����,雄激素體征-雌性動物雄性化(生育力降低,雌性性器官病理����,或動情周期),睪丸大小減小����,精子發(fā)生受損。
該指導(dǎo)原則指出多種因素可混淆明顯的雄性生殖毒性����,包括體質(zhì)量下降或損傷神經(jīng)肌肉/神經(jīng)功能的藥物可能導(dǎo)致與生殖功能受損相符的信號;當(dāng)在睪丸組織病理學(xué)檢查中檢測到精子發(fā)生減少時����,記錄動物的生殖年齡并確定藥物對睪丸發(fā)育和精子發(fā)生是否具有暫時或永久的影響是很重要的;對大鼠精子質(zhì)量造成不良影響而不影響交配結(jié)果的藥物����,對人類男性仍然可能是一種風(fēng)險���,因為這些發(fā)現(xiàn)可能表明對睪丸功能的不良影響,獨立于交配結(jié)果����。對于其作用機制是基于激素水平變化的睪丸毒性藥物,申請人應(yīng)臨床監(jiān)測激素���。
基于對非臨床毒理學(xué)試驗結(jié)果和任何其他結(jié)果的評估���,申請人應(yīng)基于具體問題具體分析原則,考慮追加非臨床研究以表征所觀察到的雄性生殖毒性�����。追加試驗可包括以下評估:證明停藥后毒性發(fā)現(xiàn)可恢復(fù)的潛力�,若不能從最初的毒理學(xué)研究中所獲得;生殖激素分析�,需認(rèn)識到激素水平在不同動物間和1天內(nèi)以及試驗過程中可能變異大;靶細(xì)胞類型的確定(例如精子細(xì)胞���、睪丸間質(zhì)細(xì)胞���、支持細(xì)胞)。在某些情況下����,在重復(fù)給藥毒性試驗或生育力試驗中納入生育力和/或精子質(zhì)量分析可能是合適的。在雄性生育力試驗中�����,可以增加交配前的給藥時間���,以覆蓋整個生精周期和附睪運輸(例如�,大鼠約為63 d)�����,以確定既往試驗中預(yù)期或觀察到的毒性的程度��。在毒性結(jié)果被懷疑是種屬依賴性時���,在第2種種屬中的確證性試驗是有用的��,例如�,當(dāng)毒性結(jié)果由種屬特異性代謝所致時。
該指導(dǎo)原則提出了對臨床試驗期間的睪丸監(jiān)測�、評價藥物對睪丸影響的臨床試驗設(shè)計的要求,其中包括:根據(jù)藥物非臨床試驗結(jié)果���,預(yù)測其在臨床相關(guān)暴露可能引起人睪丸毒性���,應(yīng)在臨床開發(fā)早期即制定人睪丸損傷風(fēng)險最小化和監(jiān)測計劃。對這些要求本文不進行闡述�,具體可參見指導(dǎo)原則。
總體上��,F(xiàn)DA認(rèn)為當(dāng)非臨床試驗顯示對雄性生殖器官���、精液分析和/或生育力有藥物相關(guān)的不良影響時���,申請人應(yīng)考慮其對人類的潛在風(fēng)險;如果需要對男性睪丸毒性進行評估��,應(yīng)在男性受試者的臨床試驗的早期��,或在藥物開發(fā)的適當(dāng)階段���,制定闡述和監(jiān)測睪丸損傷風(fēng)險的計劃���。
FDA于2015年6月發(fā)布了《雄性介導(dǎo)的藥物發(fā)育毒性風(fēng)險評估指導(dǎo)原則(草案)》�����。雖然FDA后續(xù)未發(fā)布該指導(dǎo)原則的正式稿�����,但其中對于男性生殖系統(tǒng)用藥的發(fā)育毒性風(fēng)險評估的科學(xué)性和監(jiān)管理念仍具有借鑒和參考價值。該指導(dǎo)原則(草案)總結(jié)了FDA對男性人群使用藥物后潛在相關(guān)發(fā)育毒性風(fēng)險評估的策略與方法��,拓展了對傳統(tǒng)雄性生殖與發(fā)育毒性的認(rèn)識與評價�����。該指導(dǎo)原則(草案)為申請人提供了男性給予活性藥物成分(API)后對胚胎/胎仔發(fā)育的風(fēng)險(無論是通過對男性生殖細(xì)胞的影響�����,還是妊娠動物或人類給予顯示具有遺傳毒性或強發(fā)育毒性的藥物后經(jīng)精液轉(zhuǎn)移)評估的建議��,該指導(dǎo)原則的詳細(xì)內(nèi)容見《FDA〈藥物雄性介導(dǎo)發(fā)育毒性風(fēng)險評估指導(dǎo)原則〉介紹》一文�。
該指導(dǎo)原則指出:男性在其性伴侶妊娠前/后暴露于API可能會導(dǎo)致其女性伴侶的孕體(胚胎-胎仔)遭受發(fā)育毒性風(fēng)險�,男性介導(dǎo)的發(fā)育毒性來自妊娠(受精)前藥物對精子細(xì)胞的損傷或妊娠期間藥物通過精液轉(zhuǎn)移至妊娠女性體內(nèi)(陰道攝入)使孕體獲得的直接藥物暴露2個方面。當(dāng)一項臨床試驗涉及到潛在生殖或發(fā)育毒性藥物暴露時�,風(fēng)險特征、知情同意���、避孕措施是重要的考慮點���。研究者在設(shè)計包含男性研究對象的臨床試驗時需要考慮男性受試者給藥后對其性伴侶(妊娠或可能妊娠的女性)可能帶來潛在的孕體不良影響�����。鑒于缺乏臨床信息���,非臨床數(shù)據(jù)將被用于評估風(fēng)險和為確定關(guān)于臨床試驗期間開展適當(dāng)預(yù)防措施的必要性提供信息。該指導(dǎo)原則提出了雄性介導(dǎo)發(fā)育毒性風(fēng)險評估的考慮要點與建議�、與評估藥物引起的雄性介導(dǎo)發(fā)育毒性相關(guān)的非臨床研究,也提出臨床風(fēng)險減控的建議(如當(dāng)預(yù)期有風(fēng)險時���,避免妊娠或避免通過精液轉(zhuǎn)移給妊娠的性伴侶)。
該指導(dǎo)原則指出:評價雄性介導(dǎo)的發(fā)育毒性風(fēng)險以制定風(fēng)險減控策略����,依賴于相關(guān)的非臨床和臨床信息的可獲得性。評估藥物雄性介導(dǎo)的潛在發(fā)育毒性時應(yīng)考慮的重要因素包括①藥物或其相關(guān)化合物的生殖和發(fā)育毒性���;②藥物的細(xì)胞毒性或遺傳毒性�����;③提示毒性風(fēng)險的藥理學(xué)作用特征(例如����,該藥是否直接靶向或間接影響發(fā)育信號通路�、快速分裂細(xì)胞或內(nèi)分泌功能);④藥物的吸收���、分布����、代謝和排泄特征(例如��,在雄性生殖器官中的分布和/或蓄積���,或在精液中分布)�����?�;谏鲜隹紤]�����,F(xiàn)DA會綜合考慮申請人所提供的全面資料�����,以支持在臨床試驗設(shè)計時給出是否需要男性避孕的建議��,或支持藥品上市時的說明書建議���。
該指導(dǎo)原則提供了一些與評估藥物引起的雄性介導(dǎo)發(fā)育毒性相關(guān)的非臨床研究的內(nèi)容��,體外研究包括遺傳毒性標(biāo)準(zhǔn)組合試驗�、藥物對精子(如殺精試驗����、多種精子遺傳學(xué)完整性試驗)或?qū)ε咛ィㄈ缗咛ト囵B(yǎng))影響的各種體外試驗����,體內(nèi)研究包括成熟雄性動物適當(dāng)?shù)纳称鞴俳M織病理學(xué)檢查和/或精子分析的一般毒理學(xué)試驗����、生殖和發(fā)育毒性試驗標(biāo)準(zhǔn)組合��。對于大部分藥物而言�,評價父代介導(dǎo)的發(fā)育毒性僅有的標(biāo)準(zhǔn)體內(nèi)試驗為生育力與早期胚胎發(fā)育毒性試驗,當(dāng)僅雄性動物給藥時可以進行直接的毒性評價�����。一旦發(fā)現(xiàn)明顯的發(fā)育毒性影響(如著床前后死亡�、早期胚胎畸形),則應(yīng)開展交配前單性別給藥試驗��,以分析雄性和/或雌性動物單獨給藥對毒性影響的貢獻(xiàn)作用��。因標(biāo)準(zhǔn)的生育力與早期胚胎發(fā)育毒性試驗不能充分發(fā)現(xiàn)全部的潛在發(fā)育毒性作用,故若雄性單性別給藥與未給藥雌性交配試驗中出現(xiàn)發(fā)育毒性信號時,應(yīng)該考慮開展追加試驗���,使妊娠動物延長至臨產(chǎn)前再行解剖檢查�。此外�,對于動物或人類潛在發(fā)育毒性物質(zhì),應(yīng)考慮測定精液中API含量��,以努力定量推測可能到達(dá)孕體(胚胎-胎仔)中的暴露水平���。如果雄性介導(dǎo)發(fā)育毒性風(fēng)險不確定或經(jīng)檢測確定存在��,應(yīng)該對男性研究對象或患者應(yīng)采取的預(yù)防措施類型(如使用避孕套和/或可靠的女性用避孕方法)和時限給予建議�����,以保證避免女性伴侶妊娠或孕體暴露�����。
1.3中國指導(dǎo)原則
國內(nèi)于2006年11月發(fā)布的《藥物生殖毒性研究技術(shù)指導(dǎo)原則》主要參考了起草當(dāng)時執(zhí)行的ICH S5(R2)指導(dǎo)原則進行制訂���,該指導(dǎo)原則對規(guī)范和促進我國藥物生殖毒性研究起到了重要作用�����。我國于2017年加入ICH后����,ICH指導(dǎo)原則開始在中國實施,因此藥物生殖毒性試驗研究要求需參考ICH指導(dǎo)原則�,如ICH M3(R2)和2020年新發(fā)布的ICH S5(R3)等��,原2006年版《藥物生殖毒性研究技術(shù)指導(dǎo)原則》不再適用��。
2��、男性生殖系統(tǒng)用藥生殖毒性研究情況
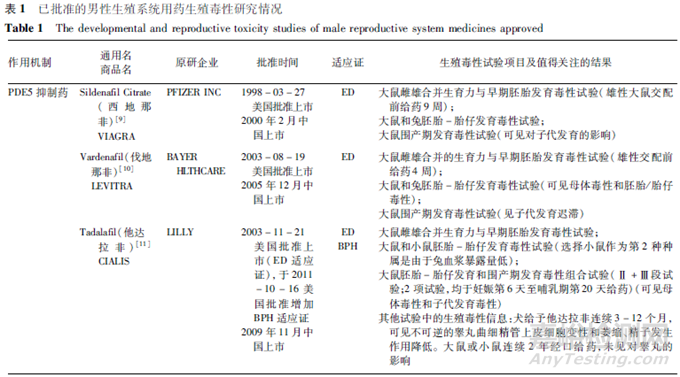
目前獲批上市的男性生殖系統(tǒng)用藥主要集中于治療勃起功能障礙(ED)和良性前列腺增生(BPH)�����。按作用機制分類�,主要包括磷酸二酯酶5抑制藥(PDE5I)、腎上腺素α1受體拮抗藥���、5α還原酶抑制藥���。美國批準(zhǔn)上市的男性生殖系統(tǒng)新藥中,治療ED的藥物包括西地那非(1998年)�、伐地那非(2003年)、阿伐那非(2012年)等�,治療BPH的藥物包括特拉唑嗪(1987年)、多沙唑嗪(1990年)����、坦索羅辛(1997年)����、阿夫唑嗪(2003年)�、多沙唑嗪(1990年)、賽洛多辛(2008年)��、非那雄胺(1992年)�����、度他雄胺(2001年)等����,獲批治療ED和BPH 2個適應(yīng)證的藥物有他達(dá)拉非(2003年)。目前�,國內(nèi)批準(zhǔn)開展臨床試驗的男性生殖系統(tǒng)藥物也主要集中于該2類適應(yīng)證。也有其他適應(yīng)證品種����,例如,用于治療男性早泄的鹽酸達(dá)泊西汀片�,其作用機制為抑制5-羥色胺再攝取。另外�,用于前列腺癌的藥物����,主要包括去勢治療藥物���、雄激素拮抗藥、化療藥物�����、個體化治療藥物等�,由于其屬于抗腫瘤藥物,其非臨床安全性評價有其特殊性��,本文不對該類藥物進行討論����。
根據(jù)FDA公開的審評意見,對已批準(zhǔn)上市的主要男性生殖系統(tǒng)用藥的生殖毒性研究情況進行了梳理�����,匯總見表1�。限于篇幅,該表僅列出生殖毒性試驗及相關(guān)試驗中的主要陽性結(jié)果�����,詳細(xì)結(jié)果參見相應(yīng)品種的FDA藥理毒理審評報告和批準(zhǔn)的說明書。
分析表1中的品種��,上市時間跨度時間較長(1987年至2012年)��,總體來說上市時間較早�,因生殖毒性試驗進行時間均早于上市時間,一部分品種的生殖毒性試驗在ICH S5首次發(fā)布之前(首次的《S5A:藥物生殖毒檢測指導(dǎo)原則》和《S5B:指導(dǎo)原則附錄:雄性生育力毒性》分別發(fā)布于1993年6月和1995年11月)�����,也在ICH M3首次發(fā)布之前(首次的M3發(fā)布于1997年7月)���,因此��,這些品種的生殖毒性研究伴隨了國際上對生殖毒性試驗的不斷認(rèn)識和完善過程���。分析這些品種所進行的生殖毒性試驗對男性生殖系統(tǒng)用藥研發(fā)的參考性,應(yīng)結(jié)合其藥物研發(fā)具體背景���、品種特點�����,并結(jié)合當(dāng)前國際上對藥物生殖毒性和生殖毒性試驗的認(rèn)識進行綜合考慮���。
分析這些品種所進行的生殖毒性試驗�,上市前均完成了大鼠生育力與早期胚胎發(fā)育毒性試驗���、2種種屬的胚胎-胎仔發(fā)育毒性試驗和大鼠圍產(chǎn)期發(fā)育毒性試驗�����,部分品種基于其試驗結(jié)果或者基于藥物所預(yù)測的潛在擔(dān)憂,進行了追加試驗����。男性生殖系統(tǒng)用藥為單性別用藥,這些品種采用了大多數(shù)藥物生殖毒性評價所采用的三段式試驗設(shè)計���,推測其主要原因是�,評價藥物潛在的生殖和發(fā)育風(fēng)險需要能夠評價對生殖過程的所有階段���,若僅進行生育力與早期胚胎發(fā)育毒性試驗�,僅能評價對生育力和早期胚胎發(fā)育的影響,無法評價對雄性生殖系統(tǒng)及生殖功能的影響所致的對子代發(fā)育的長期影響����,因而無法闡述由于雄性/男性用藥的全面影響;另外�,考慮到男性用藥可能存在雄性介導(dǎo)的胚胎-胎仔發(fā)育毒性的風(fēng)險,即精液轉(zhuǎn)移將生殖/發(fā)育毒性藥物轉(zhuǎn)移至妊娠性伴侶體內(nèi)��,從而導(dǎo)致胚胎-胎仔發(fā)育毒性風(fēng)險��,進行胚胎-胎仔發(fā)育毒性試驗和圍產(chǎn)期發(fā)育毒性試驗�,可以考察藥物在系統(tǒng)暴露情況下對胚胎-胎仔以及子代生長發(fā)育的潛在影響,更好地暴露生殖和發(fā)育毒性風(fēng)險��。對于某些類別的藥物可能用于多種適應(yīng)證且包括女性患者��,如PDE5抑制藥用于肺動脈高壓�,α1受體拮抗藥用于高血壓,從藥物開發(fā)的角度獲得全面的生殖毒性試驗信息具有必要性��。而且���,藥物上市后��,存在妊娠婦女意外暴露的可能�����,由于藥物的生殖毒性的嚴(yán)重性(如致畸性不可逆)��,從科學(xué)性和安全性的角度���,識別藥物生殖毒性風(fēng)險并將相關(guān)風(fēng)險寫入藥品說明書��,有助于指導(dǎo)安全用藥�����。但是�����,對于男性生殖系統(tǒng)用藥,尤其是男性專用藥�,目前,ICH相關(guān)指導(dǎo)原則尚未給出具體要求���,應(yīng)遵循具體情況具體分析原則����。
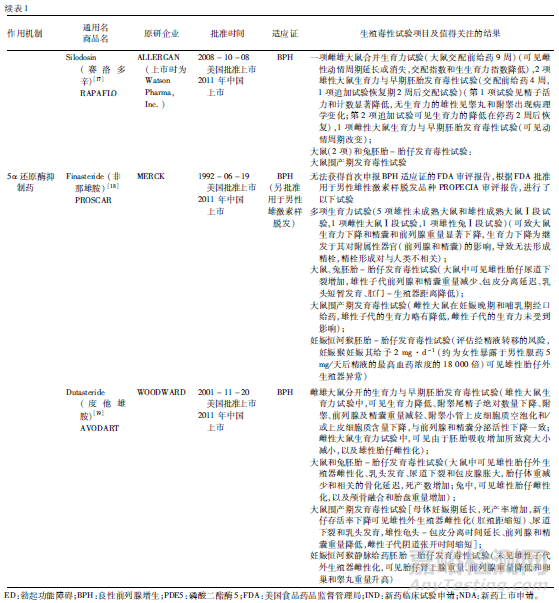
從生育力與早期胚胎發(fā)育毒性試驗看,均進行了雌雄動物生育力試驗�,大多進行了雌雄合并生育力與早期胚胎發(fā)育毒性試驗,可能與試驗進行時間較早而當(dāng)時對試驗設(shè)計的認(rèn)識有關(guān)��,但是�,在發(fā)現(xiàn)問題時追加進行了單性別生育力(尤其是雄性生育力)試驗,有些還進行了恢復(fù)期觀察�,以考察生育力影響在停藥后是否可恢復(fù)。雄性動物交配前給藥時間方面�,這些品種雄性動物為交配前給藥4周或覆蓋整個生精周期(大于9周),其中PDE5抑制藥除西地那非交配前給藥9周給藥外�����,其余均為交配前給藥4周�����,α1受體拮抗藥和5α還原酶抑制藥雄性給藥則均覆蓋了整個生精周期�。推測原因可能與藥物靶點相關(guān)風(fēng)險有關(guān),α1受體拮抗藥和5α還原酶抑制藥可能對雄性生殖功能或生育力有損傷作用��,因此雄性給藥覆蓋了整個生精周期�,而且大部分品種進行了恢復(fù)期考察。對于5α還原酶抑制藥�,根據(jù)其靶點和作用機制�����,預(yù)期會對雄性生殖系統(tǒng)和生育力產(chǎn)生不良影響���,由于該類藥物抑制睪酮向雙氫睪酮(DHT)的轉(zhuǎn)化,而DHT是一種雄性外生殖器正常發(fā)育必須的性激素�,DHT缺乏會導(dǎo)致男性嬰兒生殖器的畸形。
對于此類藥物���,還需重點關(guān)注雄性介導(dǎo)的胚胎-胎仔發(fā)育毒性�����。例如度他雄胺�,在胚胎-胎仔發(fā)育毒性試驗中�,妊娠大鼠于器官發(fā)生期給藥,在0.05 mg/次/天(比MRHD低10倍)劑量下可見雄性胎仔外生殖器雌性化(肛殖距減少)�、乳頭發(fā)育�、尿道下裂和包皮腺脹大,妊娠兔于器官發(fā)生期給藥�����,也可見雄性胎仔雌性化(外生殖器乳頭組織學(xué)評估),以及顱骨融合和胎盤重量增加���。此外�,為研究通過精液轉(zhuǎn)移至妊娠性伴侶體內(nèi)導(dǎo)致胚胎-胎仔發(fā)育毒性風(fēng)險���,還開展了妊娠恒河猴靜脈給藥相當(dāng)于人類精液中度他雄胺濃度的胚胎-胎仔發(fā)育毒性試驗�����,在試驗劑量下未見雄性胎仔外生殖器發(fā)育的明顯異常�,但在最高劑量下可見胎仔腎上腺重量�����、前列腺重量���、卵巢和睪丸重量升高���。度他雄胺軟膠囊說明書提示:妊娠或可能妊娠的婦女不應(yīng)使用度他雄胺。度他雄胺可經(jīng)皮膚吸收����,可能導(dǎo)致胎兒意外暴露���,對男性胎兒有潛在風(fēng)險。如果妊娠婦女接觸到泄漏的膠囊��,應(yīng)立即用肥皂和清水洗滌接觸部位��。接受度他雄胺治療的男性在服用最后1劑后至少6個月后才可獻(xiàn)血����,這一延遲期的目的是防止接受輸血的孕婦暴露于度他雄胺。
3�����、男性生殖系統(tǒng)用藥生殖毒性評價的關(guān)注要點
基于上述ICH和各監(jiān)管機構(gòu)相關(guān)指導(dǎo)原則的相關(guān)要求�����,對已批準(zhǔn)上市男性生殖系統(tǒng)用藥的生殖毒性研究情況進行分析��,在此基礎(chǔ)上提出了男性生殖系統(tǒng)用藥生殖毒性評價需要關(guān)注的要點�。男性生殖系統(tǒng)用藥的作用靶器官為男性生殖系統(tǒng),需要關(guān)注通過雄性生殖系統(tǒng)的影響(如對精子生產(chǎn)的影響)而產(chǎn)生的生殖和發(fā)育毒性���,影響通過精液轉(zhuǎn)移和陰道攝入轉(zhuǎn)移至妊娠性伴侶而產(chǎn)生的胚胎-胎仔發(fā)育毒性�,此外�����,部分品種的適應(yīng)證可能涉及生育(如ED)���,更需關(guān)注生殖和發(fā)育毒性�����。下面從生殖毒性評價考慮要點��,風(fēng)險識別和控制方面探討男性生殖系統(tǒng)用藥生殖毒性風(fēng)險評價的考慮�����。
3.1男性生殖系統(tǒng)用藥生殖毒性評價的考慮要點
藥物生殖毒性研究最常用的試驗方案是三段式試驗方案��,包括生育力與早期胚胎發(fā)育毒性試驗(Ⅰ段)�����、胚胎-胎仔發(fā)育毒性試驗(Ⅱ段)�����、圍產(chǎn)期毒性試驗(Ⅲ段)����,其中僅Ⅰ段試驗涉及到了雄性生殖毒性評價。另外���,重復(fù)給藥毒性試驗中對于雄性生殖器官組織病理學(xué)檢查也是雄性生殖毒性評價的重要內(nèi)容�����。然而�����,正如前文所述���,Ⅰ段生殖毒性試驗僅能評價對生育力和早期胚胎發(fā)育的影響,而無法評價因?qū)π坌陨诚到y(tǒng)及生殖功能影響所致的對子代發(fā)育的長期影響�����,從而無法闡述雄性/男性用藥所致的全面影響����。ICH M3(R2)和ICH S5(R3)等指導(dǎo)原則并未就男性專用藥(包括男性生殖系統(tǒng)用藥)進行Ⅱ段和Ⅲ段生殖毒性試驗給予建議���,應(yīng)遵循具體情況具體分析原則�。基于男性生殖系統(tǒng)用藥的特殊性�,應(yīng)根據(jù)藥物的藥理/毒理作用機制、同類藥物信息�����、組織分布(精液分布)��、適應(yīng)證特點等綜合考慮階段性開展生殖毒性試驗并進行風(fēng)險評估�。
在重復(fù)給藥毒性試驗生殖器官組織病理學(xué)檢查方面,需要予以高度關(guān)注�,ICH M3(R2)要求的是標(biāo)準(zhǔn)組織病理學(xué)檢查,ICH M3(R2)和ICH S5(R3)對組織病理學(xué)檢查提出的具體要求見上文“1.1”���。
在Ⅰ段生殖毒性試驗分為2種性別同時給藥和單性別單獨給藥兩類設(shè)計�。對于2種性別同時給藥的Ⅰ段試驗����,雌雄2種雙性別動物均給藥后交配,可伴隨精子分析和組織學(xué)檢查,評價雄性����、雌性生殖性能、生育力和早期胚胎發(fā)育毒性��。此方法的優(yōu)點在于減少實驗動物使用量����、省時省力,對于雄性生殖器官毒性可以給予一定的評價��,但是其缺點是如果出現(xiàn)生育力或早期胚胎毒性陽性結(jié)果時��,無法明確毒性作用是由于雄性給藥還是雌性給藥造成的�����,或是兩者的聯(lián)合作用�����。對于單性別單獨給藥的Ⅰ段試驗�,雄性動物給藥后與不給藥的雌性動物交配,雌性動物給藥后與不給藥的雄性動物交配����,可伴隨精子分析和組織學(xué)檢查�����,分別評價雄性�、雌性的生殖功能��、生育力及其胚胎毒性影響�����。此方法的優(yōu)點在于可以明確生殖發(fā)育毒性中雄性或雌性給藥的作用��,直接評價藥物雄性給藥可能產(chǎn)生的生殖和發(fā)育毒性�。目前國外創(chuàng)新藥大多進行單性別單獨給藥Ⅰ段試驗���,以獲得更多����、更直接的雄性或雌性生育力與早期胚胎發(fā)育毒性信息�����;而國內(nèi)申報資料中的Ⅰ段試驗?zāi)壳叭源蠖嗖捎?種性別同時給藥。
2020年發(fā)布的ICH S5(R3)反映了最新的國際協(xié)調(diào)要求���,S5(R3)指出����,在預(yù)期對生育力無影響的情況下可采用2種性別同時給藥的試驗���,但是若預(yù)期有不良影響��,則進行單性別單獨給藥的試驗��。而對于男性生殖系統(tǒng)用藥�,因直接作用于男性生殖系統(tǒng)���,可能具有較高的生育力風(fēng)險�����,因此建議進行單性別單獨給藥的試驗�,尤其是雄性單獨給藥后與未給藥雌性進行交配的試驗���,更直接地評價雄性給藥所帶來的生殖毒性風(fēng)險���。但是��,若綜合靶點及同類藥物信息而預(yù)期無生育力風(fēng)險���,也可考慮進行2種性別同時給藥的試驗。另外�,因標(biāo)準(zhǔn)的Ⅰ段試驗不能充分發(fā)現(xiàn)全部的潛在發(fā)育毒性作用,故若雄性單性別給藥與未給藥雌性交配試驗中出現(xiàn)明顯的胚胎發(fā)育毒性信號時�����,應(yīng)該考慮開展追加試驗�����,如使妊娠動物延長至接近分娩時再行解剖檢查。對生育力和早期胚胎發(fā)育不良影響的可逆性評估��,對風(fēng)險評估具有重要影響����。對于男性生殖系統(tǒng)用藥,若常規(guī)的Ⅰ段試驗發(fā)現(xiàn)對雄性生育力和/或生殖系統(tǒng)有不良影響時�,應(yīng)進行追加試驗���,進行停藥后可逆性觀察;若在既往的重復(fù)給藥毒性試驗中發(fā)現(xiàn)對雄性生殖系統(tǒng)指標(biāo)有不良影響時��,也應(yīng)研究其可逆性����。
ICH S5(R3)指出“如果重復(fù)給藥毒性試驗中發(fā)現(xiàn)對睪丸的損傷,在FEED試驗中����,雄性交配前給藥10周覆蓋整個生精周期是合適的,這使得能評估對完整生精周期和附睪運輸?shù)挠绊?rdquo;���。“當(dāng)基于藥物的作用機制或以往的試驗資料對生育力有擔(dān)憂的理由時�,可以在重復(fù)給藥毒性試驗和/或生育力試驗中納入額外的檢查(例如�����,采集精子進行精子計數(shù)和形態(tài)/活力評估�����、測量激素水平或監(jiān)測動情/月經(jīng)周期)���,以進一步描述藥物對生育力的潛在影響”�����。這是對一般藥物的要求����,對于雄性生殖系統(tǒng)用藥,由于其具有較高的生殖毒性風(fēng)險擔(dān)憂��,建議雄性動物交配前的給藥時間足以覆蓋整個生精周期���,并建議在重復(fù)給藥毒性試驗和/或生育力試驗中納入額外的檢測指標(biāo)�����。
另外�,F(xiàn)DA的《藥物研發(fā)過程中睪丸毒性評價指導(dǎo)原則》對睪丸毒性的研究提出了較為全面的建議����,F(xiàn)DA的《雄性介導(dǎo)的藥物發(fā)育毒性風(fēng)險評估指導(dǎo)原則(草案)》提供了一些與評估藥物引起的雄性介導(dǎo)發(fā)育毒性相關(guān)的非臨床研究的內(nèi)容(見上文“1.2”)�,關(guān)于雄性生殖毒性評價指標(biāo)有文獻(xiàn)進行了探討����,可作為男性生殖系統(tǒng)用藥非臨床研究的參考。
由于男性生殖系統(tǒng)用藥具有通過精液轉(zhuǎn)移陰道攝入至妊娠伴侶體內(nèi)從而具有潛在的胚胎-胎仔發(fā)育毒性風(fēng)險�����,所以男性生殖系統(tǒng)用藥雖然是單性別用藥�,但開展胚胎-胎仔發(fā)育毒性和圍產(chǎn)期發(fā)育毒性試驗可有助于識別和評估風(fēng)險。
3.2風(fēng)險識別和控制
風(fēng)險識別在藥物非臨床評價中起到至關(guān)重要的作用��,只有識別了相關(guān)風(fēng)險才能進行后續(xù)的風(fēng)險評估和采取必要的風(fēng)險管控措施��,以保障受試者/患者的安全�。對于男性生殖系統(tǒng)用藥生殖毒性風(fēng)險識別主要基于重復(fù)給藥毒性試驗和生殖毒性試驗。在新藥早期開發(fā)階段����,根據(jù)非臨床研究的階段性,可能尚未完成生殖毒性試驗����,重復(fù)給藥毒性試驗中對生殖器官(包括睪丸和附睪)的組織病理學(xué)檢查是初步識別雄性生殖毒性風(fēng)險的重要內(nèi)容。
在臨床試驗風(fēng)險管控措施方面����,正如《ICH M3問與答》建議��,“在潛在生殖和發(fā)育風(fēng)險明確之前,在男性中采取避孕措施是常規(guī)做法”�����。對于男性生殖系統(tǒng)用藥的生殖毒性風(fēng)險識別和評估后��,需要對臨床試驗采取必要的風(fēng)險管控措施���,以確保受試者或其伴侶胚胎/胎仔安全���。如果雄性介導(dǎo)發(fā)育毒性風(fēng)險未經(jīng)識別或確定存在,應(yīng)該對受試者或患者應(yīng)采取的預(yù)防措施類型(如使用避孕套和/或可靠的女性用避孕方法)和時限給予建議��,以避免女性伴侶妊娠或孕體暴露。
男性生殖系統(tǒng)用藥生殖毒性風(fēng)險評價的最終目的是為藥物及其擬用的適應(yīng)證整體獲益-風(fēng)險評估提供依據(jù)��。對于雄性介導(dǎo)的發(fā)育毒性風(fēng)險����,需要通過風(fēng)險管控措施以最大可能避免造成不良妊娠結(jié)果�。對于男性生殖毒性的可接受性����,需要考慮的因素為該適應(yīng)證人群的生育需求和雄性生殖毒性的可逆性。
對于男性生殖系統(tǒng)用藥生殖毒性風(fēng)險評價的落腳點為藥物及其擬用適應(yīng)證的獲益風(fēng)險比��,考慮不同適應(yīng)證對于風(fēng)險的接受程度不同,需在臨床開發(fā)階段進行綜合評價��,降低在后續(xù)臨床開發(fā)階段的風(fēng)險�����。
4、討 論
目前國內(nèi)已有一些企業(yè)開發(fā)的男性生殖系統(tǒng)新藥正處于臨床開發(fā)階段���。對于此類藥物�,根據(jù)具體問題具體分析原則,應(yīng)根據(jù)藥物的藥理/毒理作用機制���、同類藥物信息����、組織分布(精液分布)�、適應(yīng)證特點等綜合考慮階段性開展生殖毒性試驗并進行風(fēng)險評估����。建議重視重復(fù)給藥毒性試驗中對雄性生殖器官的全面組織病理學(xué)檢查(必要時納入額外檢測指標(biāo))��,并重視其他試驗中所獲得的雄性生殖系統(tǒng)信息�。若在重復(fù)給藥毒性試驗和其他試驗中觀察到受試物對雄性生殖系統(tǒng)的不良影響�����,或作用機制或同類品種信息提示可能對雄性生育力有影響時����,建議開展單性別給藥的生育力試驗��,且雄性動物給藥覆蓋整個生精周期�;當(dāng)發(fā)現(xiàn)對生育力具有不良影響時��,建議追加試驗�,如設(shè)置合適的恢復(fù)期以考察毒性的可逆性����,進行試驗以考察雄性介導(dǎo)的子代發(fā)育毒性試驗等。根據(jù)受試物非臨床研究結(jié)果�����,評估其臨床相關(guān)暴露可能引起生殖毒性風(fēng)險,在臨床試驗中應(yīng)對受試者加強生殖毒性指標(biāo)監(jiān)測�����,并采取嚴(yán)格避孕措施最大可能避免胚胎-胎仔的藥物暴露�,保護受試者安全��。此外����,在藥物上市時,還需基于非臨床和臨床試驗的所提示的生殖毒性風(fēng)險信息和相關(guān)數(shù)據(jù)�����,在說明書中進行提示�����,包括所需采取的風(fēng)險控制措施,以降低臨床使用中的生殖毒性相關(guān)風(fēng)險�。
本文選自:中國臨床藥理學(xué)雜志 第39卷 第20期
作者簡介:周植星�,副研究員����,主要從事新藥藥理毒理技術(shù)審評工作
通信作者:黃芳華,主任藥師
作者單位:國家藥品監(jiān)督管理局 藥品審評中心