近年來��,隨著科技的發(fā)展��,生物制藥技術(shù)日新月異����,技術(shù)的研究水平也上升到更高層次,并在整個行業(yè)中扮演著至關(guān)重要的角色����,逐漸成為制藥工藝中的中流砥柱����,生物藥工藝發(fā)展的強(qiáng)心劑��。
為此����,在2023年末之際��,PharmaTEC制藥業(yè)聯(lián)合PHARMAC琺成浩鑫共同推出特別策劃——《技術(shù)引領(lǐng)生物藥商業(yè)化生產(chǎn)》專題��,旨在為整個產(chǎn)業(yè)的高質(zhì)量發(fā)展添磚加瓦����。
此次專題內(nèi)容匯集了很多來自生物制藥行業(yè)的專家,分享對技術(shù)如何賦能生物藥商業(yè)化生產(chǎn)的思考與見識�,他們在不同領(lǐng)域的見地會給行業(yè)帶來“鑫”突破。專題內(nèi)容豐富�,涵蓋廣泛,我們將陸續(xù)刊登專業(yè)文章與君共賞�。
通常,技術(shù)轉(zhuǎn)移是一項帶有商業(yè)��、監(jiān)管��、產(chǎn)品質(zhì)量和技術(shù)風(fēng)險的商業(yè)運(yùn)作�,其基本原則很簡單,發(fā)起者將他們所有的專有技術(shù)轉(zhuǎn)移給接收者�,以實現(xiàn)產(chǎn)品生產(chǎn)��、注冊和商業(yè)化——由于種種原因����,生物技術(shù)公司經(jīng)常需要進(jìn)行技術(shù)轉(zhuǎn)移��。對于一些公司來說�,技術(shù)轉(zhuǎn)移是生物制藥產(chǎn)能風(fēng)險管理的備份戰(zhàn)略,可以為患者提供足夠的藥品供應(yīng)�;而對于另一些公司而言,由于其本身缺乏工藝優(yōu)化����、優(yōu)化產(chǎn)品生命周期管理的能力和資源,因此需要進(jìn)行技術(shù)轉(zhuǎn)移�,將技術(shù)轉(zhuǎn)移到一個具有商業(yè)化生產(chǎn)能力的公司,以實現(xiàn)該生物藥的商業(yè)化生產(chǎn)����;還有一種情況是由于有了更大的批量生產(chǎn)及管理需求,公司想要擴(kuò)大規(guī)模時也需要進(jìn)行技術(shù)轉(zhuǎn)移����。目前生物制藥技術(shù)轉(zhuǎn)移也存在各種各樣的問題和困難����,本文將從生物制藥技術(shù)轉(zhuǎn)移的流程出發(fā)��,簡述目前生物制藥存在的一些問題����。
生物制藥的原理是以基因工程為基礎(chǔ)的現(xiàn)代生物工程��,即利用現(xiàn)代生物技術(shù)對DNA進(jìn)行切割����、連接、改造�,生產(chǎn)出傳統(tǒng)制藥技術(shù)難以獲得的生物藥品。通常生物藥是通過活細(xì)胞或微生物培養(yǎng)產(chǎn)生����,通過對細(xì)胞進(jìn)行修飾,使其產(chǎn)生生物藥中的活性物質(zhì)�。具體來說,生物藥是指從生物體��、生物組織����、細(xì)胞����、器官��、體液等��,綜合利用微生物學(xué)����、化學(xué)、生物化學(xué)�、生物技術(shù)、藥學(xué)等科學(xué)的原理和方法制造的一類用于預(yù)防��、治療和診斷的制品����。
在生物制藥行業(yè),技術(shù)轉(zhuǎn)移是指在開發(fā)和生產(chǎn)之間或生產(chǎn)站點之間的任何工藝及其文件和專業(yè)知識的轉(zhuǎn)移�,技術(shù)轉(zhuǎn)移是產(chǎn)品生命周期中的重要組成部分,從藥物開發(fā)����、技術(shù)轉(zhuǎn)移、商業(yè)化生產(chǎn)再到產(chǎn)品退市,技術(shù)轉(zhuǎn)移相當(dāng)于從藥物研發(fā)到商業(yè)化生產(chǎn)的橋梁��,保證研發(fā)的成果得到一個很好的實施�,當(dāng)然這期間有很多工作要做����,包括工藝性能確認(rèn)、工藝優(yōu)化和提升等等��,通常需要專業(yè)的技術(shù)團(tuán)隊來運(yùn)作�,成功的技術(shù)轉(zhuǎn)移取決于整個項目轉(zhuǎn)移一定要有一個強(qiáng)健的項目管理流程,同時團(tuán)隊對產(chǎn)品工藝有很好的理解�,而且轉(zhuǎn)出方需要與接收方保持緊密的合作。
技術(shù)轉(zhuǎn)移的定義在PDA TR 65����、ICH Q10、WHO技術(shù)指南中都有所描述��,在藥品技術(shù)轉(zhuǎn)移方面的法規(guī)指南中��,最早由WHO在第961號技術(shù)報告附件7《制藥產(chǎn)品生產(chǎn)的技術(shù)轉(zhuǎn)移指南》對技術(shù)轉(zhuǎn)移進(jìn)行了定義����,并對技術(shù)轉(zhuǎn)移的組織和管理,工藝、包裝����、清潔轉(zhuǎn)移,分析方法轉(zhuǎn)移�,廠房設(shè)施和設(shè)備,文件�,以及確認(rèn)與驗證等方面做了規(guī)定,對適用范圍進(jìn)行了強(qiáng)調(diào)�,技術(shù)轉(zhuǎn)移可出現(xiàn)在產(chǎn)品生命周期的各個階段。2014年��,美國PDA發(fā)布第65號技術(shù)報告《Technology Transfer》��,從范圍�、過程、風(fēng)險管理等角度對技術(shù)轉(zhuǎn)移進(jìn)行了解析����,強(qiáng)調(diào)并舉例說明了質(zhì)量風(fēng)險管理工具在技術(shù)轉(zhuǎn)移過程中的應(yīng)用。
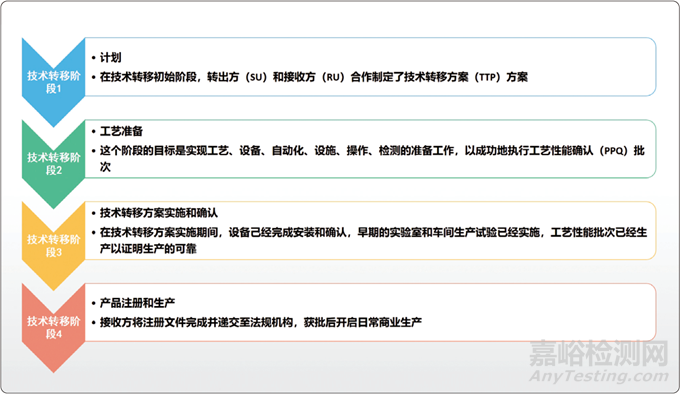
技術(shù)轉(zhuǎn)移是一項復(fù)雜而耗時的工作�,因為它涉及多個參與方和場地,一般生物制藥的技術(shù)轉(zhuǎn)移主要包括4個步驟����,如圖所示�。
生物制藥技術(shù)轉(zhuǎn)移的4個步驟
因此��,在技術(shù)轉(zhuǎn)移開始之前�,任何有關(guān)轉(zhuǎn)移方的現(xiàn)有工藝和被轉(zhuǎn)移方的設(shè)想工藝信息都必須先得到確認(rèn),通常生物制品技術(shù)轉(zhuǎn)移會包括如圖所示的4個階段����,在每個階段中����,每個部門都會遇到多種多樣的問題,下文將分階段對這些問題進(jìn)行詳細(xì)的論述�。
一、技術(shù)轉(zhuǎn)移階段1:計劃
在技術(shù)轉(zhuǎn)移初始階段��,轉(zhuǎn)出方(SU)和接收方(RU)合作制定了技術(shù)轉(zhuǎn)移方案(TTP)��,這個方案會管理整個項目��。技術(shù)轉(zhuǎn)移方案的關(guān)鍵輸入內(nèi)容包括法規(guī)策略和差距分析(SU和RU的工藝����、設(shè)備和廠房的比較;變更的風(fēng)險評估����;計劃的風(fēng)險降低措施)����。
在計劃階段��,技術(shù)轉(zhuǎn)移的要求和限制�、目的和目標(biāo)、關(guān)鍵工藝指標(biāo)(包括成功標(biāo)準(zhǔn))必須被確定并同意����。技術(shù)轉(zhuǎn)移團(tuán)隊?wèi)?yīng)該設(shè)計一個方案考慮到成本(包括材料和人員)、日程(包括被轉(zhuǎn)移產(chǎn)品的供應(yīng))�、范圍、技術(shù)和質(zhì)量�。
在這個階段,技術(shù)轉(zhuǎn)移容易出現(xiàn)的問題和難點包括以下幾點:
(1)接收方和轉(zhuǎn)出方對于技術(shù)轉(zhuǎn)移的組織架構(gòu)不明確��,雙方責(zé)任不清晰��,技術(shù)轉(zhuǎn)移的流程沒有完全達(dá)成一致或者沒有討論清楚��,雙方對于技術(shù)轉(zhuǎn)移的理解有很多的不同��,導(dǎo)致在技術(shù)轉(zhuǎn)移的第一階段就很難達(dá)成一致意見��。例如,接收方和轉(zhuǎn)出方的原輔料是否要完全保持一致��,生物反應(yīng)器的廠家和品牌是否可以不同����,轉(zhuǎn)出方的原始記錄是否可以給接收方等等。
(2)接收方對于技術(shù)轉(zhuǎn)移的范圍定義不清晰��,例如����,不能明確本次技術(shù)轉(zhuǎn)移的范圍是否包括生物制品的包材�,特別是直接接觸產(chǎn)品的包材。很多接收方對于被轉(zhuǎn)移產(chǎn)品的工藝��、流程����、分析方法、物料不夠了解����,導(dǎo)致沒有對產(chǎn)品進(jìn)行很好的理解和吸收;對于需要轉(zhuǎn)移的范圍沒有完全確定��,導(dǎo)致產(chǎn)品技術(shù)轉(zhuǎn)移不完全。這些都對后期的技術(shù)轉(zhuǎn)移帶來了很大的困擾��。例如��,被轉(zhuǎn)移的生物制品在無菌灌裝時需要充氮保護(hù)�,但是接收場地的灌裝機(jī)卻沒有充氮保護(hù)的設(shè)備,這就會導(dǎo)致后面的生產(chǎn)出現(xiàn)問題�。
(3)接收方對于技術(shù)轉(zhuǎn)移方案的起草缺乏實際操作的經(jīng)驗。很多技術(shù)轉(zhuǎn)移的方案是由接收方進(jìn)行起草��,在方案起草過程中接收方往往更關(guān)注需要把什么東西轉(zhuǎn)入過來�,但是卻忽略了這個產(chǎn)品本身具有的特性要求,因此沒有進(jìn)行技術(shù)轉(zhuǎn)移的要求����。例如,有一些生物制品的無菌灌裝由于容易出現(xiàn)蛋白的結(jié)晶顆粒����,而不能使用柱塞泵進(jìn)行灌裝,而接收方在技術(shù)轉(zhuǎn)移方案起草時并沒有關(guān)注這個問題��,使用了柱塞泵進(jìn)行無菌灌裝�,結(jié)果導(dǎo)致生產(chǎn)出現(xiàn)偏差或失敗。
(4)在技術(shù)轉(zhuǎn)移方案中��,有些轉(zhuǎn)出方傾向于相信雙方所有的設(shè)備儀器都能完全保持一致,但是在實際技術(shù)轉(zhuǎn)移過程中很難做到雙方完全保持一致�,由于在技術(shù)轉(zhuǎn)移方案中對于轉(zhuǎn)出方和接收方的設(shè)備儀器的差距分析不完全,在接下來的生產(chǎn)過程中便會出現(xiàn)各種各樣的問題�。
二、技術(shù)轉(zhuǎn)移階段2:工藝準(zhǔn)備
這個階段的目標(biāo)是實現(xiàn)工藝�、設(shè)備、自動化��、設(shè)施����、操作、檢測的準(zhǔn)備工作��,以成功地執(zhí)行工藝性能確認(rèn)(PPQ)批次��。工程批生產(chǎn)積累的臨時活動給所有系統(tǒng)提供了確認(rèn)�,都已經(jīng)充分準(zhǔn)備好執(zhí)行工藝性能確認(rèn)批次了�,在接收方的培訓(xùn)是這個階段的關(guān)鍵任務(wù)。
在這個階段�,技術(shù)轉(zhuǎn)移容易出現(xiàn)的問題和難點包括以下幾點:
(1)接收方在進(jìn)行工藝性能確認(rèn)前準(zhǔn)備的過程中,對于接收的技術(shù)轉(zhuǎn)移資料的理解不夠充分和準(zhǔn)確��。例如����,在細(xì)胞培養(yǎng)工藝中�,有的接收方使用了現(xiàn)有的不銹鋼生物反應(yīng)器����,但是轉(zhuǎn)出方使用的是一次性生物反應(yīng)器,雙方攪拌方式不同��,但是接收方還是按照轉(zhuǎn)出方的攪拌速度進(jìn)行了生產(chǎn)����,結(jié)果發(fā)現(xiàn)細(xì)胞出現(xiàn)大面積的破碎,導(dǎo)致生產(chǎn)失敗����。
(2)接收方由于對自己工廠的設(shè)備和儀器非常熟悉,所以會先入為主地為接收的產(chǎn)品設(shè)計生產(chǎn)工藝流程和控制參數(shù)��,這個時候往往忽略了對轉(zhuǎn)出方生產(chǎn)設(shè)備和儀器的了解和分析����,從而導(dǎo)致生產(chǎn)出現(xiàn)問題。例如����,接收方使用的是可高溫滅菌的��、直接接觸的pH計和電導(dǎo)率儀��,但是轉(zhuǎn)出方使用的是光電的pH計和電導(dǎo)率儀�,由于兩種儀表的工作原理不一樣��,測試結(jié)果有可能存在不同��,結(jié)果導(dǎo)致了在接收方生產(chǎn)場地的細(xì)胞培養(yǎng)的失敗����。
(3)很多接收方在準(zhǔn)備進(jìn)行生產(chǎn)的過程中由于考慮到生物制品的生產(chǎn)成本比較高,很難進(jìn)行多批次的試生產(chǎn)活動�,往往對于是否進(jìn)行工程批的生產(chǎn)都持有不同的意見,很多時候存在技術(shù)轉(zhuǎn)移的時候不做工程批�,直接進(jìn)行GMP批次的生產(chǎn),如果生產(chǎn)失敗就把GMP批次改為工程批批次�。這種方法存在偶然性,有時候第一次運(yùn)氣好����,技術(shù)轉(zhuǎn)移第一批次成功�,就認(rèn)定為GMP批次成功,但是在后面的GMP批次中卻會出現(xiàn)不斷的失敗����,造成這種現(xiàn)象的原因往往就在于對技術(shù)轉(zhuǎn)移批次的研究不夠充分�,剛開始生產(chǎn)批次經(jīng)驗不足�,就開始了GMP批次生產(chǎn)。
三�、技術(shù)轉(zhuǎn)移階段3:技術(shù)轉(zhuǎn)移方案實施和確認(rèn)
在技術(shù)轉(zhuǎn)移方案實施期間,設(shè)備已經(jīng)完成安裝和確認(rèn)����,早期的實驗室和車間生產(chǎn)試驗也已經(jīng)實施,工藝性能批次已經(jīng)生產(chǎn)��,證明了生產(chǎn)的可靠性�。
在這個階段,技術(shù)轉(zhuǎn)移容易出現(xiàn)的問題和難點包括以下幾點:
(1)接收方按照技術(shù)轉(zhuǎn)移方案進(jìn)行工藝性能確認(rèn)��,但是發(fā)現(xiàn)工藝性能確認(rèn)的結(jié)果與轉(zhuǎn)出方提供的數(shù)據(jù)存在很大的差距��。例如����,生物制品的收率不同,可能轉(zhuǎn)出方的細(xì)胞抗體表達(dá)量在7g/L左右�,而接收方的細(xì)胞抗體表達(dá)量卻在4g/L左右,這可能是由于接收方對于細(xì)胞培養(yǎng)的經(jīng)驗沒有轉(zhuǎn)出方充分,對于細(xì)胞的培養(yǎng)條件和控制參數(shù)不完全了解��,甚至按照以前其他產(chǎn)品的思路來管理生產(chǎn)��。
(2)接收方對于工藝性能確認(rèn)的輸入?yún)?shù)沒能夠仔細(xì)進(jìn)行評估�,很多參數(shù)是照搬技術(shù)轉(zhuǎn)移方案。例如��,層析過程中對于載量�、流速完全按照技術(shù)轉(zhuǎn)移方案進(jìn)行實施,而忽略了層析的層高和直徑的不同����,導(dǎo)致抗體的雜質(zhì)去除效果出現(xiàn)明顯的不同。
四����、技術(shù)轉(zhuǎn)移階段4:產(chǎn)品注冊和生產(chǎn)
接收方將注冊文件完成并遞交至法規(guī)機(jī)構(gòu),獲批后開啟日常商業(yè)生產(chǎn)��,這個階段的事后評估是一個重要活動�,是驅(qū)動技術(shù)轉(zhuǎn)移業(yè)務(wù)過程的持續(xù)改進(jìn)的方法,在前期階段的風(fēng)險順序可根據(jù)風(fēng)險控制的實施結(jié)果來修改�。
在這個階段,技術(shù)轉(zhuǎn)移容易出現(xiàn)的問題和難點包括以下幾點:
(1)接收方在遞交申報資料的時候往往忽略了監(jiān)管部門關(guān)心的“技術(shù)轉(zhuǎn)移是否完全”��,往往認(rèn)為只要做出來��,三批工藝性能確認(rèn)時均合格�,產(chǎn)品的檢驗結(jié)果是合格的就可以,忽略了技術(shù)轉(zhuǎn)移后的生物制品的安全性和有效性是否能夠得到有限保證�。例如,有企業(yè)出現(xiàn)了技術(shù)轉(zhuǎn)移后抗體的糖型分布比轉(zhuǎn)出方要寬很多的問題��,雖然都能夠滿足質(zhì)量標(biāo)準(zhǔn)��,但是臨床效果有可能存在一定的區(qū)別�。
(2)接收方的商業(yè)化生產(chǎn)的準(zhǔn)備不足,很多接收方是研發(fā)公司�,對于商業(yè)化生產(chǎn)的管理經(jīng)驗不足。例如��,很多接收方在技術(shù)轉(zhuǎn)移階段做了很多的變更��,這些變更會在注冊階段被監(jiān)管機(jī)構(gòu)進(jìn)行審評和發(fā)補(bǔ)��,由于接收方對這些變更的前期準(zhǔn)備不足��,會面臨很多審評的問題��,無法回答這些變化的原理以及有可能給產(chǎn)品的安全性����、有效性帶來的影響��,導(dǎo)致產(chǎn)品遲遲不能批準(zhǔn)��。
五����、 結(jié) 語
以上是生物制藥技術(shù)轉(zhuǎn)移存在的一些問題��,可以看到在每個階段都會出現(xiàn)不同的問題�,因此建議企業(yè)需要在技術(shù)轉(zhuǎn)移計劃設(shè)計的時候就提前進(jìn)行考慮,同時在技術(shù)轉(zhuǎn)移和工藝驗證時還應(yīng)注意以下幾點:
(1)設(shè)備的確認(rèn)應(yīng)當(dāng)在工藝驗證之前完成��。清潔驗證可以與工藝驗證同時進(jìn)行����。無論轉(zhuǎn)出方是否驗證了該方法,接收方在工藝驗證之前都需要驗證分析方法����。
(2)在接收方的驗證活動開始之前,應(yīng)當(dāng)制定驗證主計劃以便于識別是否所有的工藝都需要被驗證�。
(3)在工藝驗證開始之前應(yīng)當(dāng)完成工藝驗證方案的批準(zhǔn)。工藝驗證方案應(yīng)當(dāng)包括特定的參數(shù)和測試�,以便于監(jiān)控和與可接受標(biāo)準(zhǔn)相比對����。
(4)在接收方處成功完成商業(yè)化批量的驗證并按要求完成了注冊申報后��,則可視為商業(yè)化生產(chǎn)工藝的成功轉(zhuǎn)移�。