當(dāng)?shù)貢r(shí)間12月14日,歐盟發(fā)布MDCG指南文件<MDCG 2023-5 Annex XVI產(chǎn)品認(rèn)證和分類指南><MDCG 2023-6 Annex產(chǎn)品等同性論證指南>�,本次兩份指南一方面是針對(duì)非醫(yī)療用途兩份CS:2022/2346和2022/2347的補(bǔ)充����,同時(shí)從等同性角度���,也在MDCG 2020-5指南基礎(chǔ)上做了詳細(xì)的介紹��。
MDCG 2023-5非醫(yī)療用途產(chǎn)品認(rèn)證和分類指南
指南導(dǎo)言和范圍
無預(yù)期醫(yī)療用途的產(chǎn)品,如已列入 MDR Annex XVI��,并已列入 CS 附件的范圍部分�����,也在 MDR 的覆蓋范圍內(nèi)����。
無預(yù)期醫(yī)療用途的產(chǎn)品在分類之前先要進(jìn)行資格鑒定。只有符合器械資格 并被 CS 和 MDR 涵蓋的產(chǎn)品����,才應(yīng)根據(jù) MDR 附件 VIII 和關(guān)于重新分類的委員會(huì)實(shí)施條例 (EU) 2022/2347中規(guī)定的規(guī)則進(jìn)行分類。
MDR Annex VIII中所列的分類規(guī)則適用于這些產(chǎn)品。歐盟委員會(huì)實(shí)施條例(EU) 2022/2347也適用于某些無預(yù)期醫(yī)療目的��。MDCG 2021-24<醫(yī)療器械分類指南>應(yīng)與本指導(dǎo)文件一起閱讀��,但用于醫(yī)療目的的器械特定元素除外����。
本指南提供了一些有用的要素,可用于將產(chǎn)品認(rèn)定為MDR Annex XVI所列的無預(yù)期醫(yī)療用途的產(chǎn)品。它還為某些分類規(guī)則在沒有預(yù)期醫(yī)療目的的產(chǎn)品(以下也稱為器械)中的應(yīng)用提供了解釋和示例。
資格/Qualification
一般要求
MDR Article (1)僅涵蓋醫(yī)療器械和醫(yī)療器械配件,而MDR Article(2)規(guī)定MDR 也適用于Annex XVI中列出的產(chǎn)品。雖然對(duì)于“醫(yī)療器械”和“醫(yī)療器械附件”有定義來確定這兩個(gè)術(shù)語的含義,但對(duì)于Annex XVI產(chǎn)品���,該規(guī)例沒有提供任何定義。因此���,要確定一個(gè)產(chǎn)品是否被MDR 覆蓋�,必須使用Annex XVI中列出的產(chǎn)品組的描述����。不得使用“醫(yī)療器械”和“醫(yī)療器械附件”的定義��。
MDR 適用于從CS申請(qǐng)之日起涵蓋一個(gè)或一組產(chǎn)品的 AnnexXVI產(chǎn)品����。如果一個(gè)產(chǎn)品或一組產(chǎn)品沒有CS,則MDR 不適用于這些產(chǎn)品。其他歐盟立法也可以適用�����。有關(guān)產(chǎn)品規(guī)則實(shí)施的有用信息可在the Blue Guide中找到。
產(chǎn)品作為器械的資格認(rèn)定應(yīng)依賴于 Annex XVI清單和CS范圍部分提供的信息����。更確切地說,這些規(guī)定中提到的特征,如產(chǎn)品的類型���、技術(shù)�����、功能方式����、目標(biāo)身體部位�����、器官或組織以及產(chǎn)品的預(yù)期用途����,都應(yīng)該得到滿足。Annex XVI清單和CS范圍部分中提供的產(chǎn)品示例應(yīng)被視為鑒定的額外信息來源�,即使它們沒有詳盡描述��。
MDR recital (12)11指出, Annex XVI產(chǎn)品在功能和風(fēng)險(xiǎn)方面應(yīng)與醫(yī)療器械相似����。這一指導(dǎo)原則反映在MDR Article 2中��,考慮到最新技術(shù)水平�,特別是基于類似技術(shù)的具有醫(yī)療目的的類似器械的現(xiàn)有協(xié)調(diào)標(biāo)準(zhǔn)����。因此,與類似醫(yī)療器械的相似性也可以被視為產(chǎn)品作為器械資格的指導(dǎo)原則����。
附件
MDR Article 2未對(duì)Annex XVI產(chǎn)品的附件進(jìn)行定義。盡管如此�����,如果Annex XVI 產(chǎn)品的配件符合 MDR Annex XVI 所列的說明�����,并屬于 CS 的適用范圍�����,則屬于 MDR 的覆蓋范圍�。
如果該物品只能與Annex XVI 產(chǎn)品結(jié)合使用�,則可與該產(chǎn)品一起投放市場(chǎng)��,并被視為該產(chǎn)品的一部分�����。
如果該產(chǎn)品可單獨(dú)使用或與其他Annex XVI 產(chǎn)品結(jié)合使用���,則可作為Annex XVI 產(chǎn)品單獨(dú)投放市場(chǎng),或與其他可兼容的Annex XVI 產(chǎn)品一起投放市場(chǎng)����。在后一種情況下,可將其視為這些產(chǎn)品的一部分�。
兩用設(shè)備
如果制造商同時(shí)聲明醫(yī)療和非醫(yī)療預(yù)期用途,這些器械(稱為雙重用途器械)必須累計(jì)滿足適用于具有預(yù)期醫(yī)療目的的器械和適用于無預(yù)期醫(yī)療目的的器械的要求��。
CS 和 MDR 中的某些要求�,如對(duì)風(fēng)險(xiǎn)可接受性的要求,可能并不相同�����。在這種情況下 應(yīng)適用最嚴(yán)格的要求�����。
如果一個(gè)病人從未同時(shí)達(dá)到雙重目的(例如:(設(shè)備可用于醫(yī)療目的,也可用于非醫(yī)療目的�,但絕不能同時(shí)用于兩者),MDR 和CS要求可參照兩種預(yù)期目的分別適用����。然而,某些要求�����,如關(guān)于 風(fēng)險(xiǎn)控制措施的要求�,也應(yīng)綜合考慮,因?yàn)闉橐粋€(gè)預(yù)期用途采取的措施可能會(huì)對(duì)根據(jù)另一個(gè)預(yù)期用途的使用產(chǎn)生影響�����。與醫(yī)療目的風(fēng)險(xiǎn)相關(guān)的控制措施可能會(huì)產(chǎn)生與非醫(yī)療目的相關(guān)的新風(fēng)險(xiǎn)��,反之亦然����。
多種預(yù)期用途
MDR Annex XVI 中列出的6類產(chǎn)品中,每一類所描述的產(chǎn)品在預(yù)期用途和特性方面有所不同��。即使一個(gè)產(chǎn)品可以在多個(gè)組中描述某些特性�����,它也不太可能達(dá)到多個(gè)組的預(yù)期目的。因此��,原則上�����,每種產(chǎn)品應(yīng)只屬于MDR Annex XVI中列出的6類之一。然而�����,如果一種產(chǎn)品達(dá)到了兩組或兩組以上產(chǎn)品的預(yù)期目的�����,并具有這些組中描述的所有特性�����,則CS中針對(duì)這些組所規(guī)定的要求應(yīng)累加應(yīng)用����。
舉例:
• 溶脂激光設(shè)備:它發(fā)射高強(qiáng)度的電磁輻射����,去除脂肪組織�。如果激光有助于去除脂肪組織,而不提供任何皮膚治療��,產(chǎn)品將只屬于第4組��。
相反��,如果激光有助于去除脂肪組織,并提供皮膚治療����,如皮膚收緊,產(chǎn)品將屬于第4和第5組���。
• 射頻輻射輔助吸脂設(shè)備:發(fā)射高強(qiáng)度電磁輻射�����,去除脂肪組織�����。如果射頻輻射有助于去除脂肪組織��,而不提供任何皮膚治療���,產(chǎn)品將只屬于第4組�����。相反,如果射頻輻射也能起到皮膚治療作用,比如收緊皮膚���,那么該產(chǎn)品就屬于第4和第5組�。
資格認(rèn)證的實(shí)際問題
MDR Annex XVI所列產(chǎn)品類別的描述��,包括規(guī)例本身沒有定義或詳細(xì)解釋的術(shù)語或概念���。下表為如何考慮這些術(shù)語或概念提供了指導(dǎo)。
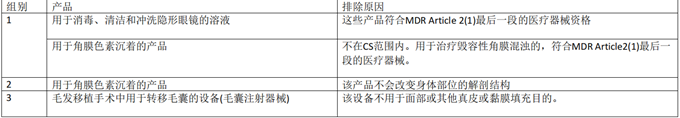
不符合Annex XVI的產(chǎn)品示例
下表提供了一份不應(yīng)符合 Annex十六產(chǎn)品資格的產(chǎn)品示例的非詳盡清單���,這些產(chǎn)品不包括在CS中����。該清單不包括MDR 和CS直接排除的產(chǎn)品���。
分類
一般原則
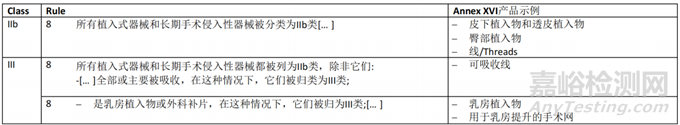
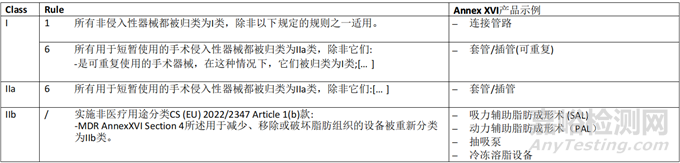
MDR 所涵蓋的無預(yù)期醫(yī)療目的的產(chǎn)品分類應(yīng)按照MDR Annex VIII中規(guī)定的規(guī)則進(jìn)行。此外�����,如果相關(guān)�����,將考慮委員會(huì)實(shí)施條例(EU) 2022/234718,該條例規(guī)定了通過豁免MDR Annex VIII的適用��,對(duì)某些無預(yù)期醫(yī)療目的的有源產(chǎn)品進(jìn)行重新分類的規(guī)則����。
雙用途器械的分類應(yīng)兼顧醫(yī)療和非醫(yī)療目的。如果根據(jù)器械的預(yù)期用途��,多個(gè)規(guī)則或同一規(guī)則中的多個(gè)子規(guī)則適用于同一器械��,則應(yīng)適用最嚴(yán)格規(guī)則和導(dǎo)致較高分類的子規(guī)則����。
關(guān)于分類規(guī)則的一般考慮,應(yīng)參考關(guān)于分類的 MDCG 2021-24 指南����。本指南提供了可能與附件 XVI 產(chǎn)品相關(guān)的其他要素和示例本章介紹了CS 所涵蓋的MDR Annex XVI 中列出和描述的每組無預(yù)期醫(yī)療用途的產(chǎn)品應(yīng)考慮的分類要素?�?紤]到每組產(chǎn)品的描述都包含可能對(duì)其分類有用的產(chǎn)品特性的相關(guān)信息(參見第3.1點(diǎn)的評(píng)論)�,從CS中提供產(chǎn)品描述�。
GROUP1
CS適用于MDR Annex XVI Section 1中列出的隱形眼鏡。CS不適用于含有工具的隱形眼鏡����,如天線或微芯片,有源器械的隱形眼鏡和其他擬引入或進(jìn)入眼睛的物品�����。
GROUP2
CS適用于MDR AnnexXVI Section 2中列出的旨在通過手術(shù)侵入性手段全部或部分引入人體以改變解剖結(jié)構(gòu)的產(chǎn)品���。CS不適用于紋身產(chǎn)品����、穿孔產(chǎn)品和旨在通過外科侵入性手段全部或部分進(jìn)入人體以固定身體部位的產(chǎn)品��。CS也不適用于有源植入器械�����。
GROUP3
CS適用于擬用于皮下��、粘膜下或皮內(nèi)注射或其他引入的面部或其他真皮或粘膜填充的物質(zhì)����、物質(zhì)組合或物品�����,不包括紋身����,列于MDR AnnexXVI Section 3�。CS適用于引入體內(nèi)的手段�����,例如注射器和藥瓶��,其中預(yù)先填充MDR Annex XVI Section 3中列出的物質(zhì)�、物質(zhì)組合或其他物品����。CS不適用于有源器械。
GROUP4
CS的光療產(chǎn)品適用于用于減少、去除或破壞脂肪組織的設(shè)備����,例如MDR Annex XVI Section 4中列出的吸脂、脂肪溶解或脂肪成形術(shù)設(shè)備��。CS不適用于有源植入器械��。
GROUP5
CS適用于用于人體的高強(qiáng)度電磁輻射(例如紅外線,可見光和紫外線)發(fā)射設(shè)備�����,包括相干和非相干源����,單色和廣譜�,例如激光和強(qiáng)脈沖光設(shè)備,用于皮膚換膚��,紋身或脫毛或其他皮膚治療�����,列于MDR AnnexXVI Section 5。CS也適用于高強(qiáng)度電磁輻射發(fā)射設(shè)備�����,用于皮膚年輕化、去除永久性彩妝和非醫(yī)療治療紅痣��、血管瘤�����、毛細(xì)血管擴(kuò)張、色素皮膚區(qū)域和疤痕��,這些設(shè)備不屬于MDR法規(guī)Article第(1)點(diǎn)第二凹痕范圍內(nèi)的傷害����。例如,CS適用于治療痤瘡疤痕的產(chǎn)品����,但不適用于其他痤瘡治療的器械。CS不適用于使用紅外光輻射來加熱身體或身體部分的設(shè)備����,也不適用于日光浴床。
GROUP6
CS適用于用于腦刺激的設(shè)備,這些設(shè)備施加穿透顱骨的電流或磁場(chǎng)或電磁場(chǎng)來改變大腦中的神經(jīng)元活動(dòng)�����,如MDR法規(guī) Annex XVI Section 6 所列�。該設(shè)備包括經(jīng)顱交流刺激、經(jīng)顱直流刺激����、經(jīng)顱磁刺激和經(jīng)顱隨機(jī)噪聲刺激的器械�。CS不適用于侵入性器械�����。
MDCG 2023-6非醫(yī)療用途產(chǎn)品等同性論證指南
指南導(dǎo)言和范圍
MDR法規(guī)提供了在符合性評(píng)估中器械所需的臨床評(píng)價(jià)中使用與等同器械相關(guān)的臨床數(shù)據(jù)的可能性,雖然進(jìn)行臨床調(diào)查是為 CE 認(rèn)證目的生成有關(guān)器械安全性和性能的臨床數(shù)據(jù)的最直接方法��,但臨床數(shù)據(jù)也可來自可證明與相關(guān)器械等效的器械數(shù)據(jù)����。在這種情況下����,應(yīng)根據(jù) MDR 要求證明等同性�����。
根據(jù)歐盟委員會(huì)實(shí)施條例(EU) 2022/2346制定了醫(yī)療器械MDR法規(guī) AnnexXVI中列出的無預(yù)期醫(yī)療目的產(chǎn)品組的通用規(guī)范����,以下簡(jiǎn)稱CS����,一般而言�,在所有可用的臨床調(diào)查結(jié)果僅與醫(yī)療器械相關(guān)的情況下,不可能證明醫(yī)療器械和無預(yù)期醫(yī)療目的產(chǎn)品之間的等同性�����。因此�����,對(duì)無預(yù)期醫(yī)療目的的產(chǎn)品應(yīng)進(jìn)行臨床研究����。
在CS發(fā)布之前�,2020年4月發(fā)布的MDCG 2020-5指南也涵蓋了MDR AnnexXVI中列出的無預(yù)期醫(yī)療目的的產(chǎn)品。目的是突出MDR 與MEDDEV 2.7/1 rev.49之間的差異����。
本MDCG指南涵蓋了等同性論證�,基于與現(xiàn)有器械相關(guān)的數(shù)據(jù),用于MDR下的CE認(rèn)證�����,適用于CS涵蓋的MDR Annex XVI中列出的無預(yù)期醫(yī)療目的的產(chǎn)品�。對(duì)于雙重用途器械����,即具有醫(yī)療和非醫(yī)療預(yù)期用途的器械,本指南僅適用于非醫(yī)療預(yù)期用途����。該指南應(yīng)與MDCG 2020-5關(guān)于等同性的指導(dǎo)文件一起使用。
等同證明
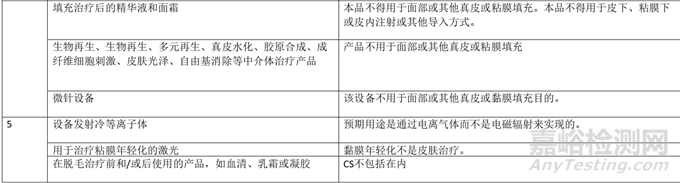
下表提供了一份不應(yīng)符合 Annex XVI產(chǎn)品資格的產(chǎn)品示例的非詳盡清單�����,這些產(chǎn)品不包括在CS中。該清單不包括MDR 和CS直接排除的產(chǎn)品�����。
無預(yù)期醫(yī)療用途的產(chǎn)品vs無預(yù)期醫(yī)療用途的產(chǎn)品
在參考等同器械的臨床數(shù)據(jù)時(shí)�����,制造商應(yīng)考慮到�����,應(yīng)根據(jù)MDR中規(guī)定的標(biāo)準(zhǔn)����,證明兩種無預(yù)期醫(yī)療用途的器械之間的等同性。
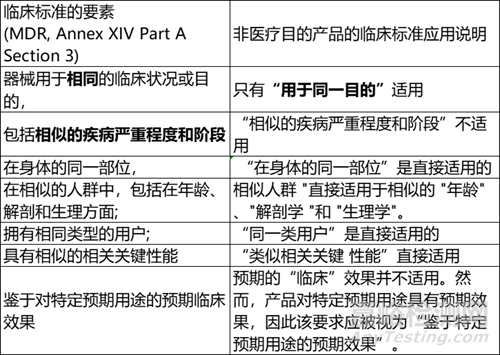
MDR 中列出的技術(shù)和生物標(biāo)準(zhǔn)可直接用于比較無預(yù)期醫(yī)療目的產(chǎn)品的特性�。在考慮臨床特性標(biāo)準(zhǔn)時(shí),應(yīng)考慮到其中一些標(biāo)準(zhǔn)是專門針對(duì)醫(yī)療目的的����。下表說明了如何考慮無預(yù)期醫(yī)療用途產(chǎn)品的特征。
無預(yù)期醫(yī)療用途的產(chǎn)品vs類似醫(yī)療器械
一般來說���,醫(yī)療器械和無預(yù)期醫(yī)療用途的產(chǎn)品間不可能進(jìn)行比較�,因?yàn)椴皇撬械呐R床特征都可以比較。特別是��,特征“類似的嚴(yán)重程度和疾病階段”將被定義并可用于醫(yī)療器械����,而它將不被定義并可用于沒有預(yù)期醫(yī)療目的的產(chǎn)品。因此���,在沒有預(yù)期醫(yī)療目的的器械和具有醫(yī)療目的的類似器械之間無法完成和建立等同性證明�����。
無預(yù)期醫(yī)療用途的產(chǎn)品vs雙重用途器械
沒有預(yù)期醫(yī)療目的的產(chǎn)品與具有醫(yī)療和非醫(yī)療目的的器械(雙重用途器械)之間的等效性可以通過比較兩種器械與非醫(yī)療目的相關(guān)的特性來證明��。對(duì)于雙重用途器械����,只應(yīng)考慮與非醫(yī)療用途相關(guān)的特性����。
如果證明了等效性����,則只有與適用于非醫(yī)療目的的一般安全和 性能要求相關(guān)的雙重用途器械的臨床數(shù)據(jù)才能用于無預(yù)期醫(yī)療目的的產(chǎn)品的臨床評(píng)價(jià)����。