歐盟發(fā)布兩份附錄XVI產(chǎn)品指南文件
2023年12月14日���,歐盟連續(xù)發(fā)布了兩份有關(guān)附錄XVI產(chǎn)品的指南,分別是MDCG 2023-5及MDCG 2023-6。這兩份指南文件旨在幫助制造商更好地了解附錄XVI無醫(yī)療預期用途產(chǎn)品分類及等同性證明相關(guān)內(nèi)容�����。
MDCG 2023-5
無預期醫(yī)療用途產(chǎn)品的認定及分類
本指南文件提供了有助于將產(chǎn)品鑒定為MDR附錄XVI中所列的無預期醫(yī)療用途產(chǎn)品的要素�����。它還提供了將某些分類規(guī)則應(yīng)用于無預期醫(yī)療目的產(chǎn)品的解釋和示例�����。
本指導文件應(yīng)與MDCG 2021-24關(guān)于醫(yī)療器械分類的文件一起閱讀。
無預期醫(yī)療用途產(chǎn)品的分類規(guī)則及示例具體如下:
第一組:隱形眼鏡
此類別不包括包含工具(如天線或微芯片)的隱形眼鏡、作為有源器械的隱形眼鏡以及植入眼睛或進入眼睛的其他物品��。
短期使用的彩色非矯正隱形眼鏡或帶有印記的非矯正隱形眼鏡,它們是IIa類��。如果長期使用�����,將被歸類為IIb類�����。
第二組:通過侵入性手段植入體內(nèi)以改變解剖結(jié)構(gòu)的產(chǎn)品
CS適用于旨在通過外科侵入的方式全部或部分引入人體以改變解剖結(jié)構(gòu)的產(chǎn)品���。不包括紋身產(chǎn)品、穿孔和通過外科侵入進入人體以固定身體部位的產(chǎn)品���。同樣��,該組的通用規(guī)范(CS)不適用于有源植入式器械�����。
所有植入式器械和長期使用的外科侵入性器械將被歸類為IIb類���,如皮下植入物���、臀部植入物。
如果它們被全部或者大部分吸收��,將被歸類于III類���,如用于隆胸的可吸收縫合線。
如果是乳房植入物或是外科疝補片���,則被歸類于III類���,如乳房植入物,用于隆胸的疝補片�����。
第三組:用于面部或其他真皮或粘膜填充的產(chǎn)品
該類別包括通過皮下���、粘膜下或皮內(nèi)注射或其他引入進行面部或其他真皮或粘膜填充的物質(zhì)��、物質(zhì)組合或物品���,不包括紋身相關(guān)產(chǎn)品��。
所有植入式器械和長期使用的外科侵入性器械歸類為IIb類��,如永久性真皮填充物��。其中�����,可分解的真皮填充物被歸類為III類���。
第四組:旨在減少、去除或破壞脂肪組織的器械
該類別包括旨在減少�����、去除或破壞脂肪組織的器械��,其中所有非侵入性器械及可重復使用的瞬時使用的外科侵入性器械都被歸類為I類���,一次性使用的外科侵入式器械被歸類為IIa類��。
此外���,旨在減少���、去除或破壞脂肪組織的器械被歸類為IIb類,如吸脂器械��。
第五組:治療用高強度電磁輻射發(fā)射器械
該類別包括用于人體的高強度電磁輻射(例如紅外���、可見光和紫外線)發(fā)射器械���。
其中,僅用于人體脫毛的高強度電磁輻射發(fā)射器械重新歸類為IIa類�����,如向人體提供能量�����、與人體交換能量或提供將被人體吸收的能量的激光和 IPL 器械���。
擬用于人體皮膚治療的高強度電磁輻射發(fā)射器械歸類為IIb類,包括用于皮膚表面重修�����、疤痕去除、紋身去除或用于治療痣��、血管瘤���、毛細血管擴張和色素沉著的皮膚區(qū)域的激光或 IPL 器械��。這些器械向人體提供能量���、人體交換能量或以潛在危險的方式向人體提供被吸收的能量。
第六組:用于腦刺激的器械
該類別包括應(yīng)用電流或磁場或電磁場以改變大腦中神經(jīng)元活動的腦刺激器械���,該類器械被歸類為III類��,如經(jīng)顱磁刺激或經(jīng)顱電刺激器械���。
原文鏈接:https://health.ec.europa.eu/system/files/2023-12/mdcg_2023-5_en.pdf
MDCG 2023-6
無預期醫(yī)療用途器械等同性證明指南
在指南中,無預期醫(yī)療用途器械等同性證明存在三種情況��,具體如下:
1���、兩種無預期醫(yī)療用途的器械
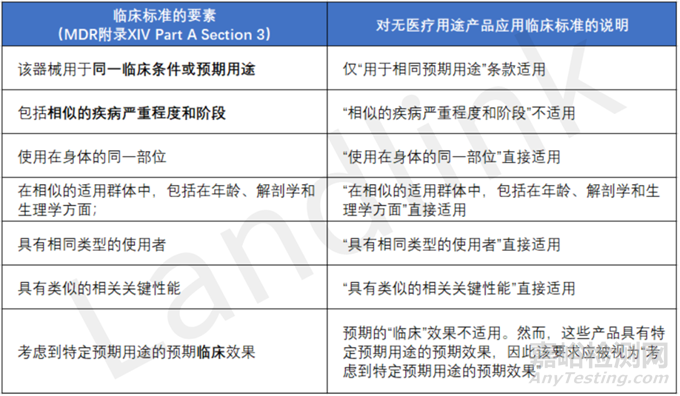
在參考等同器械的臨床數(shù)據(jù)時���,制造商應(yīng)根據(jù)MDR中制定的標準證明兩種無預期醫(yī)療用途的器械之間的等同性���,其中重點考慮技術(shù)、生物學和臨床特征等方面��。
MDR中列出的技術(shù)和生物標準可以直接用于比較無預期醫(yī)療用途產(chǎn)品的特性���,部分臨床特征的標準是專門針對醫(yī)療用途的��。下表闡明了無預期醫(yī)療用途產(chǎn)品應(yīng)如何考慮其特性���。
2、無預期醫(yī)療用途器械vs類似醫(yī)療器械
一般來說�����,醫(yī)療器械和無預期醫(yī)療用途的產(chǎn)品之間不可能進行比較��,因為并非所有臨床特征都能進行比較��。特別是"疾病的嚴重程度和階段相似 "這一特征對于醫(yī)療器械來說是可以定義和獲得的��,而對于無預期醫(yī)療用途的產(chǎn)品來說是無法定義和獲得的��。因此�����,無預期醫(yī)療用途的器械與有醫(yī)療用途的類似器械之間無法完成和建立等同性證明��。
3��、無預期醫(yī)療用途器械vs雙用途醫(yī)療器械
對于同時具有醫(yī)療和無醫(yī)療用途的器械(雙用途器械)�����,只有無醫(yī)療用途相關(guān)的一般安全和性能要求的臨床數(shù)據(jù)才能用于無預期醫(yī)療用途產(chǎn)品的臨床評價���。
原文鏈接:https://health.ec.europa.eu/system/files/2023-12/mdcg_2023-6_en.pdf