目前國家藥品監(jiān)督管理總局對國內(nèi)藥企國際化有諸多鼓勵(lì)政策��,如優(yōu)先審評、視同通過一致性評價(jià)等��,因此��,越來越多的國內(nèi)企業(yè)謀求“走出去”��。與歐洲多國家組成不同��,美國統(tǒng)一的藥品注冊管理更有利于國內(nèi)企業(yè)了解和熟悉��,因此絕大多數(shù)考慮境外申報(bào)的中國企業(yè)都把第一步定在了美國��。
此外��,隨著中國加入國際人用藥品技術(shù)要求協(xié)調(diào)委員會(ICH),中國對藥品的相關(guān)要求將 逐步跟世界接軌��,而美國藥政體系經(jīng)過多年的發(fā)展��,各方面的指導(dǎo)、要求相對都比較詳細(xì)和完善��,因此越來越多的化學(xué)仿制藥企業(yè)在目前的立項(xiàng)中都考慮中美同步開發(fā)申報(bào)��。
遺憾的是��,目前除了少數(shù)幾個(gè)走在前沿的企業(yè)��,如華海、海正��、恒瑞外��,大多數(shù)企業(yè)對美國仿制藥相關(guān)研究并不深入。
為此��,筆者分析研究了擬在美國申報(bào)注冊的化學(xué)仿制藥的立項(xiàng)考慮要點(diǎn),以及調(diào)研評估途徑��,以期為國內(nèi)的仿制藥企業(yè)提供一些幫助��。
目標(biāo)產(chǎn)品獲得和調(diào)研評估
1.目標(biāo)產(chǎn)品獲得
目前仿制藥企業(yè)立項(xiàng)基本基于國際上(大多數(shù)是歐美)最新上市或者即將上市的那些新藥��。此外��,如果要在美國上市獲利��,美國市場的短缺藥物也是值得考慮的��。
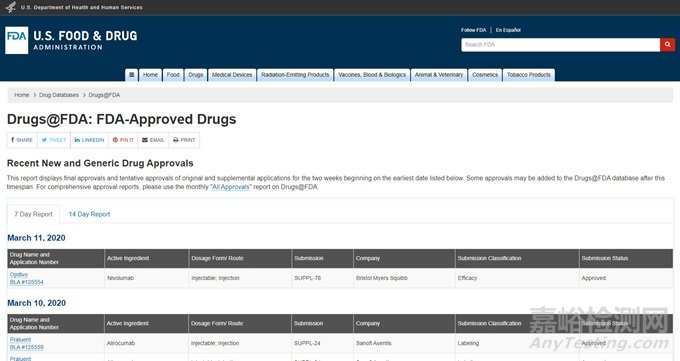
① 美國食品藥品監(jiān)督管理局(U.S. Food and Drug Administration��,F(xiàn)DA)官網(wǎng)——獲得最新批準(zhǔn)的藥品信息
FDA 網(wǎng)站會定期公布近 1 周��、2 周��、1 個(gè)月新批的藥品��、新批準(zhǔn)的補(bǔ)充申請等��,企業(yè)可 以定期關(guān)注查看��,網(wǎng)址鏈接如下:
https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=report.page
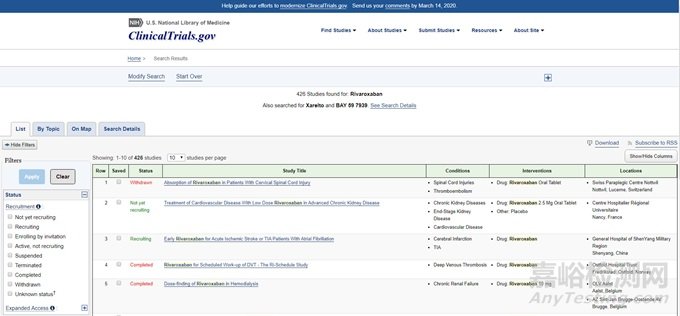
②臨床試驗(yàn)數(shù)據(jù)庫——了解處于各期臨床研究階段的產(chǎn)品
美國要求所有的臨床研究都必須登記,因此通過該網(wǎng)站可以查到正在進(jìn)行(包括入組到結(jié)束)的所有臨床試驗(yàn)��,網(wǎng)址鏈接如下:
https://clinicaltrials.gov/ct2/results?term=Rivaroxaban&Search=Search&flds=Xabcdeimp
企業(yè)可根據(jù)自己的需求查閱第幾期臨床或某些適應(yīng)證的藥物��。
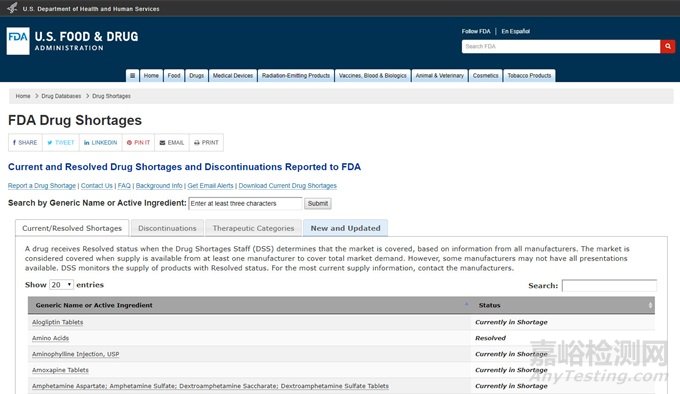
③ FDA官網(wǎng)公布——美國市場緊缺藥物
FDA 會定期公布美國市場的短缺藥物,仿制藥企業(yè)可以關(guān)注��,并結(jié)合公司的戰(zhàn)略確定是否開發(fā)��。網(wǎng)址鏈接如下:
https://www.accessdata.fda.gov/scripts/drugshortages/default.cfm
2.基礎(chǔ)信息調(diào)研
對于目標(biāo)產(chǎn)品,需要調(diào)研產(chǎn)品基本信息(規(guī)格��、 劑型��、適應(yīng)證和用法用量等)��、美國上市情況��、專利��、作用機(jī)制��、市場銷售情況、上市后不良反應(yīng)報(bào)道��,以及原研的審評報(bào)告��、說明書和處方工藝等,越具體全面越有利于項(xiàng)目的評估��,這些信息均可以在 FDA 網(wǎng)站上查到��。
具體查閱方式如下��。
① 基本信息
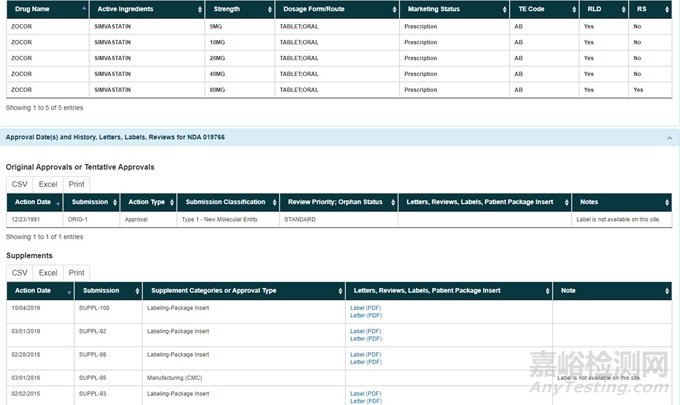
包括規(guī)格、劑型��、獲批時(shí)間��、仿制藥上市情況等��,這部分信息在 FDA 網(wǎng)站的 Search Drugs@FDA 或者 Orange Book Search(橙皮書)都可以查閱。
Search Drugs@FDA:
https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm
Orange Book Search:
https://www.accessdata.fda.gov/scripts/cder/ob/index.cfm
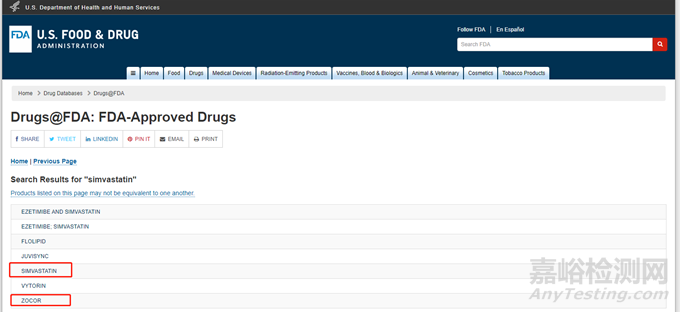
輸入要查找產(chǎn)品的活性成分��,即可出現(xiàn) FDA 批準(zhǔn)的所有含有該活性成分的制劑,包括臨時(shí)批準(zhǔn)的產(chǎn)品(可能還在等待專利到期或?qū)@V訟結(jié)果)��。一般原研藥顯示的是商標(biāo)名(brand name)��,仿制藥顯示的是通用名。以 simvastatin 為例��,原研顯示的是 ZOCOR��,仿制藥顯示的是 SIMVASTATIN。
在 Search Drugs@FDA 網(wǎng)站中點(diǎn)擊其中某個(gè)產(chǎn)品��,可以看到該產(chǎn)品的批準(zhǔn)歷史��、歷經(jīng)變更��、審評報(bào)告��、說明書等相關(guān)信息��。
需要注意的是仿制藥的說明書可能不一定有��,但是原研藥的說明書一定會有��。在 Orange Book Search 網(wǎng)站��,點(diǎn)擊你想了解的其中某個(gè)產(chǎn)品��,可以看到產(chǎn)品的專利和排他情況��。
這 2 個(gè)網(wǎng)站都可以看到產(chǎn)品的規(guī)格��、劑型��、 持證商等��。
②適應(yīng)證��、用法用量��、作用機(jī)制等
這部分信息可以在原研藥的說明書中查找��,說明書可以在 Search Drugs@FDA 中查找��。
③審評報(bào)告
Search Drugs@FDA 網(wǎng)站上有原研藥的審評報(bào)告��,查閱方式同上��。仿制藥通常沒有審評報(bào)告��。
④ 專利和排他等智慧保護(hù)查閱
在 Orange Book Search 網(wǎng)站上��,點(diǎn)擊想查閱的產(chǎn)品��,彈出的頁面中會顯示這個(gè)產(chǎn)品的專利和獨(dú)占數(shù)據(jù)鏈接 (Patent and Exclusivity Information)。
對于專利的具體權(quán)利范圍��,可以在 USPTO 網(wǎng) 站上查詢��,網(wǎng)站如下:
https://www.uspto.gov/
需要注意的是��,F(xiàn)DA 橙皮書上的專利并非該產(chǎn)品的全部專利��,僅僅是廠家在 FDA 登記的專利。查詢橙皮書相關(guān)專利并確定應(yīng)對方案對于注冊申請足夠��,但如果為確保上市后無侵權(quán)風(fēng)險(xiǎn)��, 企業(yè)還應(yīng)在專利網(wǎng)全面查詢��。
⑤市場銷售情況
這部分內(nèi)容一般由企業(yè)的市場部人員通過 IMS 等數(shù)據(jù)庫獲得��;除此之外,還可以從原研產(chǎn)品的官方網(wǎng)站上獲得��,原研企業(yè)每年年報(bào)中都會大致總結(jié)產(chǎn)品 1 年的銷售情況��。
3.臨床價(jià)值評估
根據(jù)本品的適應(yīng)證��,調(diào)研產(chǎn)品各適應(yīng)證的當(dāng)前及未來發(fā)病率��、當(dāng)前治療現(xiàn)狀——是否已有較好治療手段或藥品��,根據(jù)當(dāng)前科學(xué)發(fā)展最前沿的病理研究及治療理論——是否有其他更有臨床優(yōu)勢的品種正在研或在審評��,初步判斷本品的臨床價(jià)值��。
例如考慮到大氣污染的因素,未來肺癌的發(fā)病率會比較高��,企業(yè)立項(xiàng)時(shí)可以考慮��;如果原研是孤兒藥��,需確定在中國是否符合罕見病的條件��,可以考慮在中國同步申報(bào)等��。
此外��,應(yīng)關(guān)注本品上市后的應(yīng)用情況��,查看上市后不良反應(yīng)報(bào)道��,是否有撤市等情況。美國上市后不良反應(yīng)警戒制度相對比較完善��,F(xiàn)DA 網(wǎng)站上分別有“藥品召回”(Drug Recalls)��、“藥品監(jiān)視:安全信息和不良反應(yīng)報(bào)告”(MedWatch:The FDA Safety Information and Adverse Event Reporting Program)以及“召回、撤市及安全警告” (Recalls��、Market Withdrawals and Safety Alerts)3 個(gè) 欄目��,通過這 3 個(gè)欄目��,可以關(guān)注到產(chǎn)品上市后異常情況。
Drug Recalls:
https://www.fda.gov/drugs/drug-safety-and-availability/drug-recalls
MedWatch :
https://www.fda.gov/safety/medwatch-fda-safety-information-and-adverse-event-reporting-program
Recalls��、Market Withdrawals 和 Safety Alerts:
https://www.fda.gov/safety/recalls-market-withdrawals-safety-alerts
對于有安全性問題的產(chǎn)品��,企業(yè)立項(xiàng)時(shí)應(yīng)結(jié)合其審評報(bào)告��,再次分析其風(fēng)險(xiǎn)效益比��。如果原研藥上市前就知道該安全性問題��,通常已經(jīng)做過風(fēng)險(xiǎn)效益評估,企業(yè)可查閱審評報(bào)告了解關(guān)注��,并結(jié)合當(dāng)前的治療情況進(jìn)行再次分析��;
但如果該安全性問題是原研藥上市后才發(fā)現(xiàn)的��,仿制藥企業(yè)應(yīng)特別關(guān)注��,評估該安全性問題是否可以解決��,綜合判斷是否立項(xiàng)��,并在后續(xù)的研發(fā)中予以關(guān)注。
4. 市場價(jià)值評估
企業(yè)可購買 IMS 數(shù)據(jù)庫等了解目標(biāo)產(chǎn)品上市后的銷售額和銷售量��、相同適應(yīng)證品種市場占有情況以及上市后逐年的變化情況��,結(jié)合其臨床價(jià)值以及該適應(yīng)證其他在研或在審評品種��,綜合評估��,預(yù)測其未來的市場發(fā)展前景。根據(jù)專利情況判斷產(chǎn)品預(yù)計(jì)上市時(shí)的市場��。
此外還應(yīng)了解目標(biāo)產(chǎn)品仿制藥上市情況,預(yù)測未來的市場競爭��,確定是否值得仿制��。
5. 注冊��、專利及研發(fā)可行性的評估
根據(jù)原研的排他期確定最晚什么時(shí)候可以申報(bào)��,是否有提前的可能��,如挑戰(zhàn)專利等��。
根據(jù) FDA 規(guī)定��,美國新的化學(xué)藥物有 5 年的數(shù)據(jù)排他期��,孤兒藥有 7 年的市場排他期��,新的適應(yīng)證有 3 年的市場排他期��。在數(shù)據(jù)排他期內(nèi)不接受仿制藥企業(yè)的申報(bào)��,但是如果挑戰(zhàn)專利(避開專利或宣告專利無效)��,可以提前 1 年申報(bào)��。首仿若審評通過且挑戰(zhàn)專利成功或在 30 個(gè)月內(nèi)訴訟無果��,則該仿制藥企業(yè)可以獲得 180 d 的市場獨(dú)占��。
因此,要結(jié)合公司的研發(fā)��、法律團(tuán)隊(duì)情況,確定是否要挑戰(zhàn)專利��。如果挑戰(zhàn)專利��,要考慮研發(fā)能否做到、法律方面能否應(yīng)對��。
另外��,如果要挑戰(zhàn)專利��,需要確定挑戰(zhàn)哪些專利��,通常考慮以下方面:①挑戰(zhàn)相對比較好挑戰(zhàn)的;②挑戰(zhàn)專利到期最久的��。
國外知名的仿制藥企業(yè)大都有龐大的律師團(tuán)隊(duì)對專利進(jìn)行分析��,制定應(yīng)對策略��,國內(nèi)企業(yè)如果暫時(shí)缺乏相關(guān)人才可以考慮外聘��。
最后還要了解本品的處方工藝,看是否有特殊工藝或新型工藝��,預(yù)估是否有研發(fā)難點(diǎn)��,是否能夠解決��。
6. 公司設(shè)備配備
評估目前公司的生產(chǎn)條件能否滿足、是否需要配備新的設(shè)施設(shè)備��、生產(chǎn)線是否需要升級或新建等��。
7. 公司戰(zhàn)略吻合
綜合上述信息��,判斷本品與公司整體戰(zhàn)略是否一致��。
開發(fā)及注冊策略制定
所有信息收集評估完成,項(xiàng)目立項(xiàng)后��,基本可以確定產(chǎn)品的研發(fā)和注冊策略��。
1. 開發(fā)及注冊策略通常要考慮的問題
①是否要挑戰(zhàn)專利��;
②預(yù)計(jì)申報(bào)哪些適應(yīng)證 (如有些適應(yīng)證尚在保護(hù)期內(nèi),可以考慮暫時(shí)不收載該適應(yīng)證)��;
③預(yù)計(jì)大致研發(fā)��、申報(bào)和上市時(shí)間��;
④上市計(jì)劃(由于挑戰(zhàn)專利的首仿藥通常具有 180 d 的市場獨(dú)占期,因此企業(yè)應(yīng)好好利用��,在獲批后第一時(shí)間上市��,最大可能地獲得價(jià)值);
⑤獲批上市后變更計(jì)劃��。
通常建議企業(yè)制定 2 套注冊策略,以降低產(chǎn)品風(fēng)險(xiǎn)��。
2. 以甲苯磺酸索拉非尼為例的產(chǎn)品開發(fā)及注冊策略的制定思路
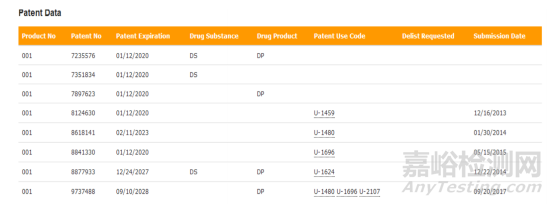
本品 2005 年 12 月獲批��,批準(zhǔn)的適應(yīng)證為晚期腎細(xì)胞癌��,作為孤兒藥��,獨(dú)占期到 2012 年 12 月��;后續(xù)又陸續(xù)增加了肝細(xì)胞癌以及局部復(fù)發(fā)或轉(zhuǎn)移性��、進(jìn)行性��、分化型甲狀腺放射性碘治療難治的腫瘤��,最后一個(gè)新增適應(yīng)證(甲狀腺癌)2017 年 11 月 22 日獲批��,因此本品最后獨(dú)占期到 2020 年 11 月 22 日��。橙皮書收載的專利信息見下圖��。
在 USPTO 網(wǎng)站上可以查到各個(gè)專利的具體權(quán)力范圍��。本品最后一個(gè)到期的專利是制劑專利��,通常挑戰(zhàn)難度不大��;再者是晶型專利��,2027 年到期��;其他專利基本可以避開��。
因此��,晶型專利對本品仿制藥的上市時(shí)間影響最大,故相關(guān)策略以是否挑戰(zhàn)晶型專利為核心來制定��。
① 方案 A
嘗試 PIV(挑戰(zhàn)專利)+PIII(等待專利到期后再上市)申請,挑戰(zhàn) 2027 年晶形專利及 3 年后尚未到期的專利��,3 年后預(yù)計(jì)到期的專利可以一并挑戰(zhàn)��,或者也可以按 PIII 聲明��,即等這些專利到期后再上市;預(yù)計(jì) 18 個(gè)月后完成研發(fā)��,審評周期預(yù)計(jì) 10 個(gè)月��,獲批后上市��。申報(bào)所有的適應(yīng)證��。
該方案難點(diǎn)及注意事項(xiàng):
①本品為 BCSⅡ類��,晶性可能會影響溶解度,因此相關(guān)研究需要提前��;
②申報(bào)后 30 d 內(nèi)將會開始專利訴訟��,需提前做好準(zhǔn)備��;
③如果專利訴訟勝訴��,則獲批后將可能獲得 180 d 市場獨(dú)占��,因此市場部需提前布局準(zhǔn)備��。
② 方案 B
如 18 個(gè)月不能完成避開晶型專利的研發(fā)��,則只挑戰(zhàn)最后一個(gè)專利即可,確保 2027 年 12 月上市本品��。
討論
立項(xiàng)評估并不能做到百分百正確無誤��,企業(yè)可以各自設(shè)立自己的立項(xiàng)標(biāo)準(zhǔn)��,只要在可接受范圍內(nèi)��,即可進(jìn)行��。此外��,所有的評估以及策略制定都不是孤立的��,要結(jié)合其他各項(xiàng)綜合進(jìn)行��,例如一個(gè)產(chǎn)品避專利或不避專利��,其研發(fā)的難易程度就會有區(qū)別��,上市時(shí)間也會有區(qū)別��,對應(yīng)上市時(shí)的市場情況也會有區(qū)別,所以要綜合判斷評估��。