今日頭條
榮昌MSLN-ADC獲批婦科腫瘤Ⅱ期臨床����。榮昌生物靶向MSLN的ADC藥物RC88獲FDA批準(zhǔn)Ⅱ期臨床,擬評估單藥治療鉑耐藥復(fù)發(fā)性上皮性卵巢癌���、輸卵管癌和原發(fā)性腹膜癌患者的有效性和安全性����。RC88通過靶向結(jié)合MSLN陽性的腫瘤細胞,介導(dǎo)抗體的內(nèi)吞并將細胞毒素定向傳遞給癌細胞以殺滅腫瘤����。今年6月,榮昌已與信達達成開展RC88與信迪利單抗聯(lián)合用藥臨床研究���。
國內(nèi)藥訊
1.華東醫(yī)藥引進自免病新藥擬納入優(yōu)先審評�。華東醫(yī)藥旗下中美華東從Kiniksa公司引進的IL-1α/IL-1β重組融合蛋白注射用利納西普(Rilonacept���,Arcalyst)獲CDE以“符合兒童生理特征的兒童用藥品新品種�、劑型和規(guī)格”擬納入優(yōu)先審評���,用于治療成人和12歲及以上青少年復(fù)發(fā)性心包炎(RP)以及降低復(fù)發(fā)風(fēng)險�。今年11月����,該產(chǎn)品用于治療冷吡啉相關(guān)的周期性綜合征(CAPS)的3.1類生物藥上市申請已獲得CDE受理。
2.輝大DNA編輯療法獲兒科罕見病藥物資格����。FDA授予輝大基因公司全新CRISPR-Cas12 DNA編輯療法HG302兒科罕見病藥物資格,用于治療杜氏肌營養(yǎng)不良(DMD)。HG302旨在通過單個病毒載體將高保真Cas12(hfCas12Max)和靶向人DMD基因第51號外顯子剪接供體(SD)位點的CRISPR RNA遞送到肌肉中���,以恢復(fù)功能性肌營養(yǎng)不良蛋白的表達。臨床前研究顯示����,HG302具有較低的脫靶率和高效的編輯效率。
3.領(lǐng)諾重組酶替代療法獲MLD孤兒藥認定����。領(lǐng)諾醫(yī)藥重組芳香基硫酸酯酶A(ARSA)LIN-2003獲FDA授予孤兒藥資格,用于治療異染性腦白質(zhì)病(MLD)�。MLD是由ARSA基因突變引起的一種罕見的溶酶體病,可導(dǎo)致神經(jīng)損傷和發(fā)育退化���。在臨床前研究中���,LIN-2003已在ARSA基因缺陷小鼠模型中顯示出血腦屏障高滲透性特點和治療潛力,有望成為MLD酶替代治療產(chǎn)品����。
4.英百瑞通用型CAR-raNK獲批臨床。英百瑞生物1類生物制品IBR733細胞注射液獲國家藥監(jiān)局臨床默示許可���,擬開發(fā)用于治療急性髓性白血病(AML)���。IBR733是同源異體外周血來源的通用現(xiàn)貨型CAR-raNK細胞產(chǎn)品���,由CD33/CLL1雙特異抗體與NK細胞復(fù)合偶聯(lián)而成。IBR733的雙靶向可以同時針對AML細胞和白血病干細胞進行殺傷�,在提升療效和安全性的同時,能夠降低腫瘤免疫逃逸����,減少腫瘤復(fù)發(fā)。
5.三生國健IL-17A單抗獲批兩項臨床�。三生國健重組抗IL-17A人源化單克隆抗體注射液SSGJ-608獲國家藥監(jiān)局批準(zhǔn)兩項臨床試驗,針對的適應(yīng)癥為“強直性脊柱炎(AS)���,以及放射學(xué)陰性中軸型脊柱關(guān)節(jié)炎(ax-SpA)”���。此前,SSGJ-608已在治療中重度斑塊狀銀屑病的注冊Ⅲ期臨床研究中達到主要終點和所有次要終點����,顯著提高達到PASI 75應(yīng)答的患者比例。
國際藥訊
1.Chiesi公司樺樹三萜凝膠獲批上市���。Chiesi集團旗下Chiesi Global Rare Diseases樺樹三萜Filsuvez凝膠(birch triterpenes)獲FDA批準(zhǔn)上市�,用于治療6個月以上交界型大皰性表皮松解癥和營養(yǎng)不良型大皰性表皮松解癥患者的部分厚度傷口。在Ⅲ期臨床中���,F(xiàn)ilsuvez與對照組相比,顯著提高患者的創(chuàng)面愈合率(41.3%vs28.9%,p=0.013)���。這是今年FDA批準(zhǔn)的第54款創(chuàng)新藥����,今年新藥獲批數(shù)目已創(chuàng)5年來新高���。
2.葛蘭素史克PD-1抗體子宮內(nèi)膜癌Ⅲ期臨床積極����。葛蘭素史克PD-1抑制劑Jemperli(dostarlimab)聯(lián)合標(biāo)準(zhǔn)化療(卡鉑和紫杉醇)����、之后使用Jemperli加PARP抑制劑Zejula的維持治療,在治療原發(fā)性晚期或復(fù)發(fā)性子宮內(nèi)膜癌的Ⅲ期RUBY臨床達到主要終點�。與安慰劑+化療方案相比,Jemperli組合顯著提高總體患者群體和MMRp/MSS腫瘤患者亞群的無進展生存期(PFS)�。完整數(shù)據(jù)將公布于醫(yī)學(xué)會議上。
3.羅氏IgE抗體獲FDA優(yōu)先審評資格。羅氏旗下基因泰克與諾華開發(fā)的IgE抗體Xolair(omalizumab)的sBLA申請獲FDA受理���,用于減少成人和1歲以上兒童因意外暴露于一種或多種食物而引發(fā)的過敏反應(yīng)(包括過敏性休克)�。FDA同時授予其優(yōu)先審評資格�,預(yù)計明年第一季度做出審批決定。在Ⅲ期臨床OUtMATCH中����,與安慰劑相比,Xolair顯著增加引起兒童和青少年發(fā)生過敏反應(yīng)所需的花生以及牛奶�、雞蛋和腰果的數(shù)量。
4.默沙東21價肺炎球菌疫苗獲優(yōu)先審評資格����。默沙東21價肺炎球菌結(jié)合疫苗V116的生物制品許可申請(BLA)獲FDA受理,用于成人預(yù)防侵襲性肺炎球菌病和肺炎球菌性肺炎����。FDA同時授予其優(yōu)先審評資格,PDUFA日期為明年6月�。在III期STRIDE-3研究中,與活性對照疫苗PCV20相比�,V116對于兩種疫苗中共有的所有10種血清型中引起的免疫應(yīng)答達到非劣效性標(biāo)準(zhǔn);V116特有的11種血清型中有10種展現(xiàn)良好的免疫應(yīng)答���。
5.膀胱癌溶瘤病毒獲突破性療法認證����。CG Oncology溶瘤病毒CG0070(cretostimogene grenadenorepvec)同時獲得FDA的突破性療法認證和快速通道資格,用于治療高危�、卡介苗治療不響應(yīng)非肌肉侵襲性膀胱癌(NMIBC)。CG0070為一款工程化5型腺病毒溶瘤病毒����,它嵌入了兩種編碼基因-腫瘤選擇性啟動子E2F-1和GM-CSF基因���。公布于SUO2023年會上的Ⅲ期試驗數(shù)據(jù)顯示����,CG0070單藥治療的BCG無應(yīng)答NMIBC患者的完全緩解率為75.7%���。
6.吉利德超8億美元購進IL-18BP抗體���。吉利德與Compugen公司就后者臨床前白細胞介素-18結(jié)合蛋白(IL-18BP)靶向抗體COM503達成協(xié)議,獲得這款潛在“first-in-class”藥物開發(fā)和商業(yè)化獨家授權(quán)����。根據(jù)協(xié)議�,Compugen將負責(zé)COM503的臨床前開發(fā)和Ⅰ期臨床研究���;Compugen將獲得6000萬美元的預(yù)付款和3000萬美元的近期里程碑付款�,可能高達7.58億美元的潛在開發(fā)���、監(jiān)管和商業(yè)里程碑款項�,總交易額可能達8.48億美元����。
醫(yī)藥熱點
1.河北中西醫(yī)結(jié)合兒童醫(yī)院全面停診。12月15日�,河北中西醫(yī)結(jié)合兒童醫(yī)院發(fā)布一則停業(yè)公告。根據(jù)醫(yī)院近年來發(fā)展現(xiàn)狀����,結(jié)合人口出生率逐年下降等社會發(fā)展因素,河北中西醫(yī)結(jié)合兒童醫(yī)院經(jīng)慎重研究,將于2023年12月19日17:00全面停診����。醫(yī)院停診后,醫(yī)院現(xiàn)場所將由新成立的河北梅奧心血管病醫(yī)院開展運營���,2023年12月20日正式開診����。
2. 非洲科學(xué)家編輯蚊子基因?qū)汞懠病?/strong>據(jù)美國有線電視新聞網(wǎng)17日報道,布基納法索的科學(xué)家研發(fā)出一種技術(shù)����,可通過編輯蚊子的基因來消滅蚊子,從而控制瘧疾等疾病傳播����。科學(xué)家計劃通過釋放被改編基因的雄蚊子�,阻礙攜帶瘧疾的雌蚊子繁衍,進而減少瘧疾傳播�。布基納法索健康科學(xué)研究所昆蟲學(xué)和寄生蟲學(xué)負責(zé)人迪亞巴特表示���,‘基因驅(qū)動’方式是可持續(xù)���、更經(jīng)濟的瘧疾防治措施,這項技術(shù)的推廣將需要幾年的時間���。
3.前諾華研發(fā)負責(zé)人James Bradner加入安進����。12月14日,安進宣布兩項高管任命�,James Bradner擔(dān)任研發(fā)執(zhí)行副總裁兼首席科學(xué)官,David M. Reese擔(dān)任執(zhí)行副總裁兼首席技術(shù)官�。Bradner和Reese均向安進董事長兼首席執(zhí)行官Robert A. Bradway匯報。Bradner是一位經(jīng)驗豐富的研發(fā)高管�,將負責(zé)推進安進所有的產(chǎn)品管線,包括創(chuàng)新藥和生物仿制藥����,以及公司的全球研發(fā)工作。加入安進前�,Bradner曾在諾華擔(dān)任生物醫(yī)學(xué)研究中心總裁。
評審動態(tài)
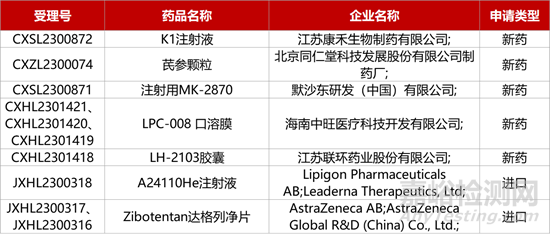
1. CDE新藥受理情況(12月20日)
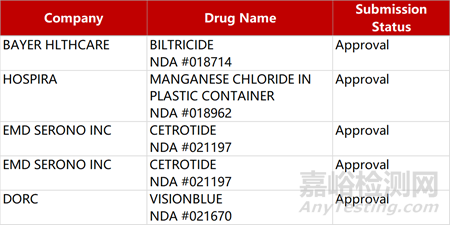
2. FDA新藥獲批情況(北美12月18日)