近年來(lái),小核酸藥物成為生物制藥企業(yè)的研發(fā)熱點(diǎn),小核酸藥物專指靶向作用于RNA或蛋白質(zhì)的一類寡核苷酸分子,包括反義寡核苷酸(ASO)��、siRNA��、aptamer等��。截至目前��,我國(guó)已上市的小核酸藥物總共有兩款��,一款為諾西那生鈉(spinraza)全球首個(gè)用于治療兒童和成人脊髓性肌萎縮癥(SMA��,致命性遺傳?�。┑男滤?�,2019年spinraza在中國(guó)獲批��;另外一款為樂(lè)可為(leqvio)��,是一款長(zhǎng)效降脂藥��,2023年08月在中國(guó)獲批��;這兩款藥均是進(jìn)口至中國(guó)。通過(guò)查詢CDE得知��,諾西那生鈉和樂(lè)可為的注冊(cè)分類屬于化學(xué)藥5.1類。
雖然小核酸藥物是按照化學(xué)藥物申報(bào)��,那么小核酸藥物的研究要點(diǎn)有哪些��?下面從序列設(shè)計(jì)思路��、單體合成��、序列合成��、質(zhì)量控制��、遞送系統(tǒng)等五個(gè)方面進(jìn)行討論��。
序列設(shè)計(jì)思路
小核酸藥物的序列是藥物的核心��,序列的設(shè)計(jì)也是重中之重的任務(wù)��,下面我們來(lái)粗略地探討下序列設(shè)計(jì)的思路。
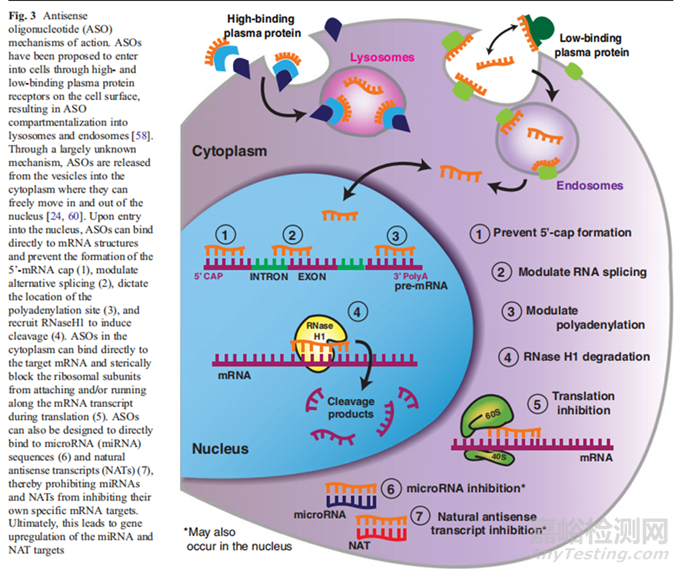
首先需要確定ASO的基本需求��,確定是屬于招募RNase-H還是不招募RNase-H��;根據(jù)文獻(xiàn)得知��,ASO的作用機(jī)制主要分為兩類��,一類為招募RNase-H,另一類是不招募RNase-H��;在ASO與目標(biāo)RNA結(jié)合后��,通過(guò)招募RNase-H的機(jī)制主要是利用RNase-H��,切割A(yù)SO-mRNA��,使mRNA被裂解��;而另一類不招募RNase-H的作用機(jī)制��,主要是通過(guò)ASO與mRNA緊密結(jié)合��,使得mRNA抑制翻譯和轉(zhuǎn)錄��,作用機(jī)制見(jiàn)下圖1��;了解了我們的目標(biāo)機(jī)制��,我們還需要了解目標(biāo)對(duì)象是什么��?目標(biāo)基因是什么-外顯子��,間隔子還是其他��?
第二步:設(shè)計(jì)8~10個(gè)ASO序列��,在設(shè)計(jì)ASO序列時(shí)��,需要考慮的因素:①確定某些序列是否會(huì)加強(qiáng)或減弱ASO的活性��;②G/C的含量:大于55%的G/C的含量會(huì)增強(qiáng)ASO的結(jié)合力��;③可以通過(guò)計(jì)算模型來(lái)設(shè)計(jì)ASO��;④確保序列能夠識(shí)別的是唯一基因��;理想的ASO是有大于3個(gè)堿基與其他基因無(wú)法匹配��;
第三步:確保是否可以購(gòu)買(mǎi)到合適的單體用于制備ASO��;比如:對(duì)于需要招募RNase-H��,可以采用PS修飾��;對(duì)于不需要招募RNase-H��,可以采用PS修飾或PMO修飾��;對(duì)于招募RNase-H機(jī)制,可以對(duì)前5個(gè)和后5個(gè)堿基進(jìn)行2'位置進(jìn)行修飾��,對(duì)于非招募RNase-H的藥物��,可以對(duì)所有堿基進(jìn)行2'位置進(jìn)行修飾��;
第四步:通過(guò)適當(dāng)?shù)捏w外細(xì)胞研究��,篩選8~10個(gè)ASO��;確?�;蚰軌蛟诩?xì)胞中被表達(dá)��;使用6~200nM濃度的ASO進(jìn)行實(shí)驗(yàn)��,收集24h的mRNA并分析它的有效性��,選擇4~5個(gè)有效的ASO進(jìn)行體內(nèi)實(shí)驗(yàn)��;
第五步:在體內(nèi)模型篩選合適的ASO��,確保目標(biāo)ASO能夠在小鼠/小鼠細(xì)胞中表達(dá)��;
第六步:選擇最佳的ASO進(jìn)行藥效研究��,確定ASO的有效劑量。
圖1 ASO的作用機(jī)制[1]
序列設(shè)計(jì)思路[1]
合成過(guò)程的研發(fā)要點(diǎn)
核苷單體合成的要點(diǎn)
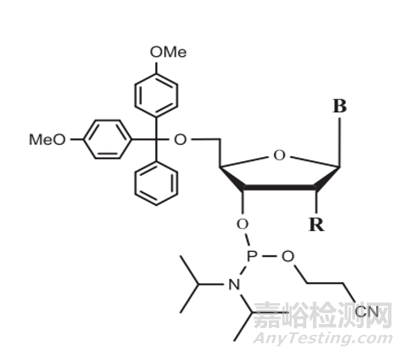
小核酸藥物的關(guān)鍵原料為核苷單體��,如圖2所示��,DNA的亞磷酰胺單體主要是由堿基��、脫氧核糖��、5'-DMT和3'端的2-氰乙基以及二異丙胺基組成��;而RNA的亞磷酰胺單體在DNA的亞磷酰胺單體的基礎(chǔ)上��,需要對(duì)2'-OH進(jìn)行保護(hù)��,該保護(hù)基團(tuán)一般為T(mén)BDMS(叔丁基二甲基硅基);此外��,由于腺嘌呤��,鳥(niǎo)嘌呤和胞嘧啶上存在伯胺基��,因此也需要一定的基團(tuán)保護(hù)��,通常用作這些氨基保護(hù)基的是?�;绫郊柞;˙z)��,乙?�;ˋc)��,異丁?�;?�;然而��,對(duì)于該步驟中��,最關(guān)鍵的
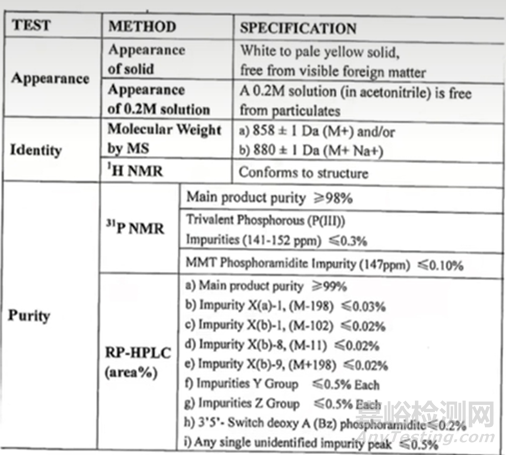
主要有三個(gè)��,第一個(gè)是進(jìn)行必要的化學(xué)修飾��,采用何種化學(xué)修飾將會(huì)影響最終的核酸藥物的成藥性��、以及藥物的酶抗性��;目前常見(jiàn)的修飾方法主要有��,磷酸骨架的修飾(比如PS)��、2'位羥基核糖的修飾(比如:2’-O-甲基修飾,2’-O-甲氧乙基修飾(2’-MOE)��,氟(F)等取代)��,核糖五元環(huán)骨架修飾(比如:LNA��,PMO等)��;第二個(gè)關(guān)鍵點(diǎn):核苷單體的質(zhì)量控制��,由于核苷單體合成技術(shù)環(huán)節(jié)眾多��,同時(shí)核苷單體經(jīng)過(guò)各種修飾��,結(jié)構(gòu)也變得更加復(fù)雜多變��,雜質(zhì)團(tuán)的種類也變得更加繁多��,因此在質(zhì)量控制上也是具有極大的挑戰(zhàn)��;通常情況下��,亞磷酰胺單體的純度要求一般≥99.0%��,下圖3是某單體質(zhì)量要求的質(zhì)量標(biāo)準(zhǔn)要求��;第三個(gè)關(guān)鍵點(diǎn):由于市場(chǎng)目前處于早期��,要使單體投入生產(chǎn)領(lǐng)域其成本較高��,特別是要想獲得比較大的生產(chǎn)量��,也是較大的挑戰(zhàn)之一��。
圖2 亞磷酰胺單體結(jié)構(gòu)式[2]
圖3 單體的檢測(cè)質(zhì)量標(biāo)準(zhǔn)[3]
序列合成的挑戰(zhàn)
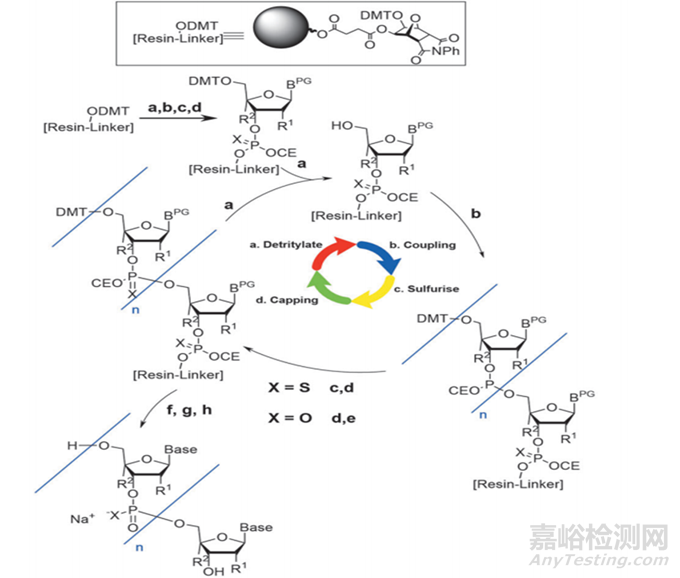
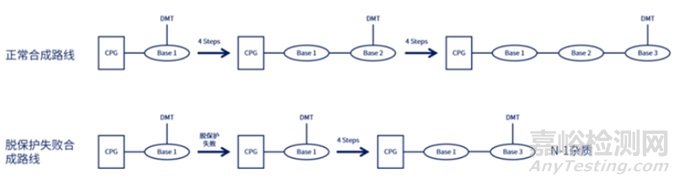
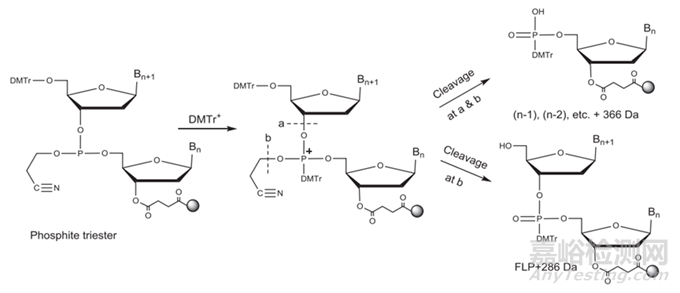
單體合成后��,需要進(jìn)行下一步��,對(duì)其序列進(jìn)行合成純化��,工業(yè)上合成純化方法主要包括:化學(xué)合成法��、RNA酶解法��、微生物發(fā)酵法及生物催化法,其中化學(xué)合成主要方法又包括反相色譜法(固相合成—反相色譜純化—脫三苯甲基化—乙醇沉淀法等—凍干)��、離子交換層析法(固相合成—離子交換層析—濃縮/深層過(guò)濾—凍干)��、疏水層析結(jié)合離子交換層析(固相合成—疏水層析—脫三苯甲基化—離子交換—UF/DF—原料藥溶液)��;目前已上市的核酸藥物大多采用化學(xué)合成法中反向色譜法和離子交換層析法��,該方法的具體步驟包括去DMT(脫三苯甲基)保護(hù)��、偶聯(lián)��、氧化��、加帽��,循環(huán)(見(jiàn)下圖4)達(dá)到所需要的序列長(zhǎng)度后��,再進(jìn)行裂解和脫保護(hù)(Cleavage and Deprotection��,C&D)��,最終得到我們所需要的序列��;然而��,在這一過(guò)程中��,若工藝參數(shù)控制不好很有可能會(huì)產(chǎn)生一系列的雜質(zhì)��,包括產(chǎn)生N-X序列如N-1��,N+X的序列(longmer sequences)如N+G��,硫代磷酸酯鍵(PS)產(chǎn)生的非對(duì)映異構(gòu)體和氧化產(chǎn)生PO雜質(zhì)��,胞嘧啶和5-甲基胞嘧啶脫氨基引起的雜質(zhì),其他雜質(zhì)如堿基脫嘌呤雜質(zhì)��,2'-5'連接異構(gòu)雜質(zhì)��,序列異構(gòu)體等��。
圖4 寡核苷酸合成路線圖[4]
N-X序列(shortmer sequences),如N-1的產(chǎn)生主要原因包括:①脫保護(hù)時(shí)間的長(zhǎng)短��,以及脫保護(hù)劑的酸堿性��,脫保護(hù)反應(yīng)時(shí)間不夠/脫保護(hù)劑酸性太弱會(huì)產(chǎn)生N-1雜質(zhì)��;而脫保護(hù)時(shí)間又取決于流速和柱子的尺寸��;②空間位阻導(dǎo)致脫保護(hù)劑脫離效率低產(chǎn)生N-1的雜質(zhì)��;
N+X的序列(longmer sequences)��,如N+G,N+A的產(chǎn)生主要原因包括:①脫保護(hù)試劑沖洗不干凈導(dǎo)致N+1雜質(zhì)的產(chǎn)生��;②亞磷酰胺單體自身形成二聚體��,然后與5'-OH反應(yīng)��;③新加入的亞磷酰胺單體被偶聯(lián)兩次��;
硫代磷酸酯鍵(PS)產(chǎn)生的非對(duì)映異構(gòu)體和氧化產(chǎn)生PO雜質(zhì)主要原因:在氧化過(guò)程中��,使用的氧化試劑可以將已形成的PS鍵氧化為PO鍵��;
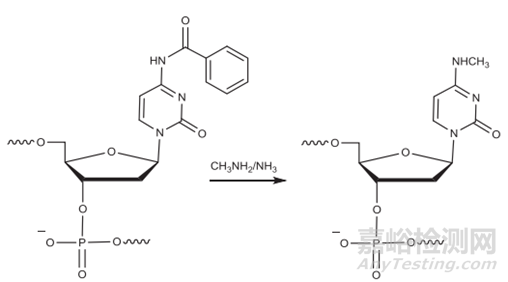
胞嘧啶和5-甲基胞嘧啶脫氨基引起的雜質(zhì):在斷裂和脫保護(hù)過(guò)程中��,甲胺與胞苷殘基(被苯甲?�;Wo(hù))反應(yīng)形成N-4-甲基胞苷雜質(zhì)。
由此可見(jiàn)��,序列合成過(guò)程中主要有以下幾個(gè)關(guān)鍵要點(diǎn)��,第一:合成工藝��,工藝參數(shù)以及試劑的質(zhì)量將會(huì)影響藥物的質(zhì)量��,比如:柱子使用尺寸、流速��、脫保劑的酸堿度等等��。第二:核酸原料藥生產(chǎn)使用固相合成技術(shù)��,其在工藝放大和質(zhì)量控制上存在較高壁壘��;第三:核酸原料藥固相合成配套設(shè)備��、潔凈環(huán)境等前期投入非常大��;
質(zhì)量控制的挑戰(zhàn)
由于小核酸藥物處于早期��,目前無(wú)明確的法規(guī)對(duì)其進(jìn)行指導(dǎo)��,2021年FDA[5]發(fā)布關(guān)于反義寡核苷酸藥物的化學(xué)��、生產(chǎn)控制指南中提出��;對(duì)于原料藥��,F(xiàn)DA推薦采用兩種方法進(jìn)行鑒別��,鑒別包括:分子量及序列,其他方法包括熔點(diǎn)(Tm)��、液相保留時(shí)間��;原料質(zhì)量研究?jī)?nèi)容包括:序列(質(zhì)譜分析)��、熔點(diǎn)(Tm)��、成鹽形式��、殘留溶劑��、水分��、微生物檢測(cè)��、細(xì)菌內(nèi)毒素��、雜質(zhì)個(gè)數(shù)��、特定雜質(zhì)含量��、總雜��、元素雜質(zhì)��、重金屬等等��;
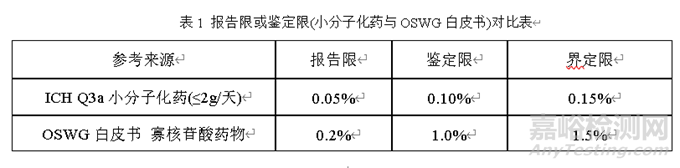
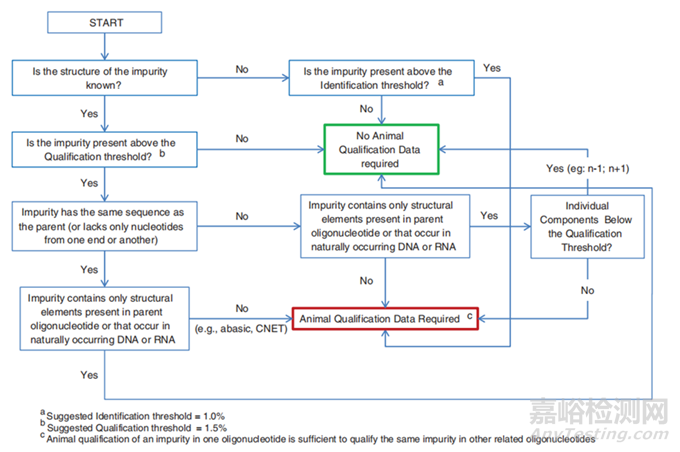
關(guān)于雜質(zhì)限度的制定��,暫無(wú)明確的法規(guī)進(jìn)行參考��,根據(jù)OSWG白皮書(shū)[6]第10章關(guān)于寡核苷酸藥物中雜質(zhì)中指出��,建議鑒定限為1.0%��,界定限為1.5%��;文章給出制定該標(biāo)準(zhǔn)的理由有三點(diǎn):第一:寡核苷酸藥物的新雜質(zhì)或未知雜質(zhì)的大部分來(lái)源于合成��,而這些雜質(zhì)的化學(xué)結(jié)構(gòu)很可能與目標(biāo)化合物相似��,它們的化學(xué)性質(zhì)也有可能與目標(biāo)化合物相似��,比如水溶性��、與蛋白結(jié)合力��、分子量等��;第二:由于寡核苷酸藥物的分子量與小分子的分子量差異很大��,比如,小分子的分子量大概為500Da��,而寡核苷酸藥物的分子量可能要達(dá)到5000Da��,它們的分子量相差10倍��,因此��,在相同的臨床劑量下��,由于分子量的差異��,寡核苷酸的雜質(zhì)水平為1.0%與小分子藥物0.1%的數(shù)量相當(dāng)��;第三:根據(jù)現(xiàn)有的毒理學(xué)數(shù)據(jù)��,無(wú)法證明寡核苷酸藥物的毒性是來(lái)源于雜質(zhì)��。同時(shí)文章中��,還給出了關(guān)于寡核苷酸藥物雜質(zhì)鑒定決策樹(shù)(詳見(jiàn)下圖5)��;具體報(bào)告限或鑒定限(小分子化藥與OSWG白皮書(shū))對(duì)比表��。
圖5寡核苷酸藥物雜質(zhì)鑒定決策樹(shù)[6]
對(duì)于小核酸藥物藥物分析中還存在一個(gè)很重要的要點(diǎn)��,那就是雜質(zhì)分析方法的開(kāi)發(fā)��,由于在化學(xué)合成過(guò)程中��,很容易產(chǎn)生n-1的雜質(zhì)��,該雜質(zhì)通常比母體少一個(gè)堿基��,因此它的的化學(xué)性質(zhì)與目標(biāo)化合物也是非常相似的��,這就容易造成分離的困難��,特別是對(duì)于較長(zhǎng)序列的藥物��,據(jù)文獻(xiàn)報(bào)道��,序列越長(zhǎng)��,雜質(zhì)越難被分離��。在早期��,人們是通過(guò)聚丙烯酰胺凝膠電泳分離��,通過(guò)UV來(lái)檢測(cè)��;1980年,主要采用CGE分離不同長(zhǎng)度的序列��,這個(gè)方法主要是在聚丙烯酰胺凝膠電泳的基礎(chǔ)上��,填加了毛細(xì)管��,從而提高理論塔板數(shù)��;陰離子交換(AEX)HPLC后來(lái)被廣泛應(yīng)用��,主要是用來(lái)定量分析硫磷二酯中的PO雜質(zhì)��;最近��,離子對(duì)(IP)HPLC技術(shù)流行開(kāi)來(lái)��,在很多情況下��,已經(jīng)替代了CGE方法��,用于分離不同長(zhǎng)度序列的雜質(zhì)��;近年來(lái)��,ESI-MS和IP-HPLC-ESI-MS技術(shù)被廣泛使用��。
表2 雙鏈寡核苷酸活性成分的檢測(cè)項(xiàng)目和分析方法[7]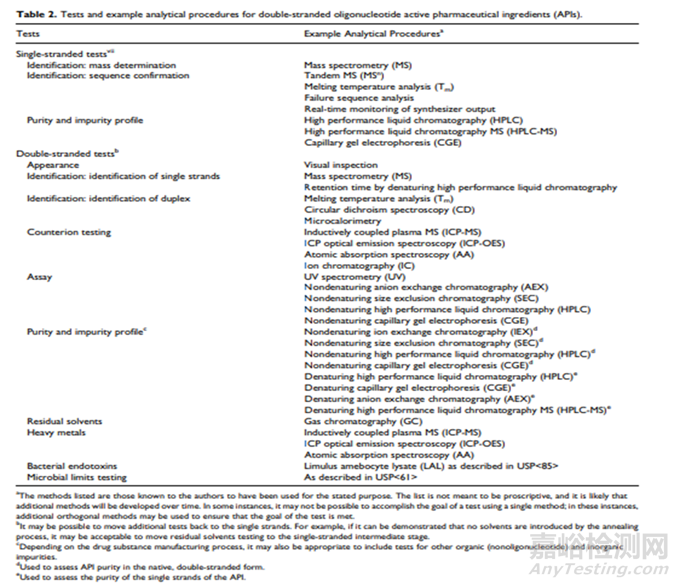
表3 單鏈寡核苷酸活性成分的檢測(cè)項(xiàng)目和分析方法[7]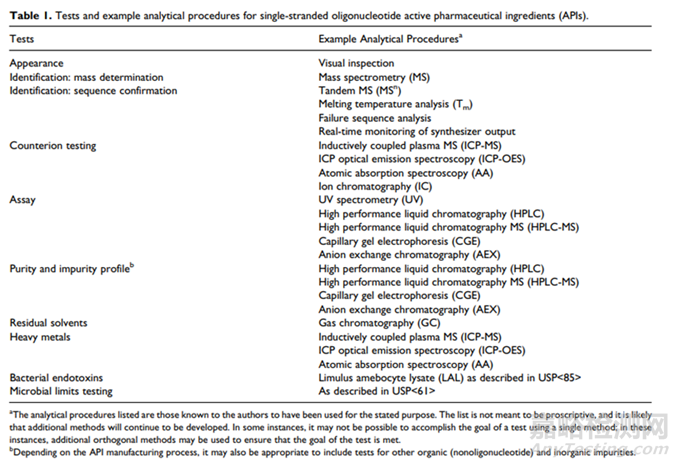
遞送系統(tǒng)的挑戰(zhàn)
遞送系統(tǒng)是小核酸藥物研究的重點(diǎn)項(xiàng)目之一,遞送系統(tǒng)關(guān)系到藥物的安全性和有效性��,對(duì)于不同疾病不同藥物類型可能千變?nèi)f化��;目前已上市siRNA的產(chǎn)品均采用遞送系統(tǒng)��,而目前已上市的ASO未采用遞送,但最終是否需采用遞送系統(tǒng)還是要考慮眾多因素��;①作用靶點(diǎn)在哪些位置��,腦部��?肝��?肺��?肌肉組織��?��;②注射途徑是什么��?③風(fēng)險(xiǎn)與收益的平衡��;
比如海昶生物對(duì)治療原發(fā)性腎癌的HC0201進(jìn)行了納米脂質(zhì)體優(yōu)化��,形成了差異化創(chuàng)新的抗原發(fā)性肝癌藥物HC0301��,兩者為同一核酸API Mychexin��;HC0201通過(guò)納米脂質(zhì)體技術(shù)��,使它的穩(wěn)定性和生物分布得到更佳的優(yōu)化��,同時(shí)對(duì)腫瘤內(nèi)皮細(xì)胞和腫瘤微環(huán)境還有一些靶向的作用,通過(guò)遞送系統(tǒng)��,使藥物精準(zhǔn)作用肝臟��,因此用于肝癌��,而未采用遞送系統(tǒng)則是用于治療原發(fā)性腎癌��。
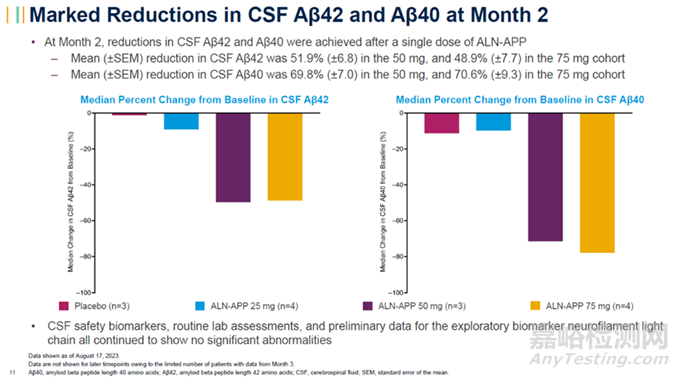
又比如針對(duì)治療阿爾茨海默?�。ˋD)和腦淀粉樣血管?�。–AA)等疾病��,這些疾病的病變部位主要是腦部��,因此目前較為成熟的遞送手段LNP和GalNAc修飾手段��,主要遞送至肝臟,無(wú)法達(dá)到腦部��;Alnylam Pharmaceuticals所開(kāi)發(fā)的C16偶聯(lián)技術(shù)經(jīng)過(guò)優(yōu)化��,使得能夠到達(dá)中樞神經(jīng)系統(tǒng)組織��,在今年10月底��,針對(duì)治療阿爾茨海默?�。ˋD)和腦淀粉樣血管?�。–AA)��,Alnylam公布了在研的ALN-APP產(chǎn)品��,目前該產(chǎn)品臨床1期試驗(yàn)的中期結(jié)果獲得了積極效果��。結(jié)果顯示��,單劑ALN-APP的持續(xù)藥代動(dòng)力學(xué)活性可以長(zhǎng)達(dá)10個(gè)月��,同時(shí)觀察到與AD和CAA相關(guān)的淀樣蛋白片段Aβ42和Aβ40的顯著降低��。
比如已上市的Golodirsen��,主要是用于治療杜氏肌營(yíng)養(yǎng)不良癥��,該產(chǎn)品主要是通過(guò)PMO修飾��,并未使用遞送系統(tǒng)��,抗肌萎縮蛋白是一種細(xì)胞骨架蛋白主要布于心肌和骨豁肌肌纖維膜的胞質(zhì)��,最主要是分布在神經(jīng)肌肉接頭處��,而被修飾后的Golodirsen��,通過(guò)靜脈注射��,藥物可以與血漿蛋白結(jié)合��,自動(dòng)進(jìn)入細(xì)胞內(nèi)��,而該蛋白是處于心肌與骨骼肌纖維膜的胞質(zhì)中��,即藥物僅進(jìn)入外周組織即可達(dá)到效果��。
圖片來(lái)源于海昶生物官網(wǎng)
ALN-APP顯著降低腦脊液中的Aβ42和Aβ40水平(圖片來(lái)源:Alnylam官網(wǎng))
總結(jié):
一個(gè)藥物被成功開(kāi)發(fā)��,最終走上市場(chǎng)需要經(jīng)歷千錘百練,需要考慮的因素也是非常眾多��;對(duì)于小核酸藥物CMC的研發(fā)要點(diǎn)遠(yuǎn)遠(yuǎn)不止于此��,在這里僅僅是粗略談?wù)摿诵蛄械脑O(shè)計(jì)思路��、合成的研發(fā)要點(diǎn)��、質(zhì)量控制的研發(fā)要點(diǎn)��、以及遞送系統(tǒng)需要考慮的要點(diǎn)��。
參考文獻(xiàn):
[1] DeVos, Sarah L.; Miller, Timothy M. (2013). Antisense Oligonucleotides: Treating Neurodegeneration at the Level of RNA. Neurotherapeutics, 10(3), 486–497. doi:10.1007/s13311-013-0194-5 ;
[2]Pourshahian, Soheil (2019). THERAPEUTIC OLIGONUCLEOTIDES, IMPURITIES, DEGRADANTS, AND THEIR CHARACTERIZATION BY MASS SPECTROMETRY. Mass Spectrometry Reviews, (), mas.21615–. doi:10.1002/mas.21615
[3] Comprehensive medicinal chemistry ,3rd.ed manufacturing of oligonucletides
[4] William F. Kiesman,Perspectives on the Designation of Oligonucleotide Starting Materials 10.1089/nat.2020.0909
[5] FDA發(fā)布指南草案:IND Submissions for Individualized Antisense Oligonucleotide Drug Products for Severely Debilitating or Life-Threatening Diseases: Chemistry, Manufacturing, and Controls Recommendations Guidance for Sponsor-Investigators
[6] Capaldi, Daniel; Teasdale, Andy; Henry, Scott; Akhtar, Nadim; den Besten, Cathaline; Gao-Sheridan, Samantha; Kretschmer, Matthias; Sharpe, Neal; Andrews, Ben; Burm, Brigitte; Foy, Jeffrey (2017). Impurities in Oligonucleotide Drug Substances and Drug Products. Nucleic Acid Therapeutics, (), nat.2017.0691–. doi:10.1089/nat.2017.0691
[7] Capaldi, D.; Ackley, K.; Brooks, D.; Carmody, J.; Draper, K.; Kambhampati, R.; Kretschmer, M.; Levin, D.; McArdle, J.; Noll, B.; Raghavachari, R.; Roymoulik, I.; Sharma, B. P.; Thurmer, R.; Wincott, F. (2012). Quality Aspects of Oligonucleotide Drug Development: Specifications for Active Pharmaceutical Ingredients. Therapeutic Innovation & Regulatory Science, 46(5), 611–626. doi:10.1177/0092861512445311