引言
本文帶大家通過查詢藥典及參比制劑資料等信息���,系統(tǒng)的分析原輔料和制劑的物理���、化學(xué)、生物及微生物性質(zhì)��,為后期的小試開發(fā)工藝參數(shù)提供依據(jù)�。
1、原料藥性質(zhì)及穩(wěn)定性
1.1原料藥性質(zhì)
1.1.1原料藥性質(zhì)查詢方式
(1)中國(guó)藥典�;
(2)主流國(guó)家(歐美日)藥典�����;
(3)購(gòu)買原料藥小樣(多廠家購(gòu)買�����,數(shù)量夠原輔料相容即可)���,詢問其要原料藥全套資料,包括原料藥性質(zhì)�����、雜質(zhì)譜����、元素雜質(zhì)及致突變等資料。
(4)參比制劑資料中關(guān)于原料藥的信息����,如美國(guó)的review、日本的IF文件��、歐洲的審評(píng)報(bào)告等資料�����。
(5)百度學(xué)術(shù)、中國(guó)知網(wǎng)�����、PubChem及藥智網(wǎng)等網(wǎng)站���;
1.1.2原料藥性質(zhì)匯總
常規(guī)劑型的考察項(xiàng)目通常包括:性狀(外觀、旋光度或比旋度等)�、酸堿度、溶液的澄清度與顏色�、雜質(zhì)(工藝雜質(zhì)、降解產(chǎn)物等)����、對(duì)映異構(gòu)體、晶型���、粒度��、干燥失重/水分�����、含量等�����。
特殊劑型的考察項(xiàng)目包括:黏度�����、分子量及分子量分布等����。
無菌制劑的考察項(xiàng)目通常包括:細(xì)菌內(nèi)毒素/熱原、無菌等����。
1.1.3原料藥性質(zhì)解析
(1)性狀(外觀、旋光度或比旋度等)�,與產(chǎn)品的安全性及有效性相關(guān),性狀的改變間接顯示出產(chǎn)品質(zhì)量或生產(chǎn)工藝的改變���,性狀控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求��;
(2)酸堿度���,影響產(chǎn)品的穩(wěn)定性�����,進(jìn)而影響產(chǎn)品的安全性和有效性�����,酸堿度控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求;
(3)溶液的澄清度與顏色�����,影響產(chǎn)品的安全性和有效性����,溶液的澄清度與顏色控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求,若易受光����、熱、氧等條件影響�,先控制使用中環(huán)境條件,若控制效果不理想����,需對(duì)其內(nèi)控收緊限度�����;
(4)雜質(zhì)(工藝雜質(zhì)��、降解產(chǎn)物等)����,影響產(chǎn)品的安全性和有效性�,區(qū)分雜質(zhì)類別及性質(zhì),結(jié)合Q3A(R2):新原料藥中的雜質(zhì)及Q3B(R2):新藥制劑中的雜質(zhì)等標(biāo)準(zhǔn)分析��,雜質(zhì)需符合中國(guó)藥典��,若易受光��、熱��、氧等條件影響���,先控制使用中環(huán)境條件���,若控制效果不理想,需對(duì)其內(nèi)控收緊限度;
(5)對(duì)映異構(gòu)體�����,對(duì)映異構(gòu)體的改變間接顯示出產(chǎn)品質(zhì)量或生產(chǎn)工藝的改變�����,進(jìn)而影響制劑的安全性和有效性�����,對(duì)映異構(gòu)體控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求�;
(6)晶型���,影響產(chǎn)品的溶解度及溶出度等����,進(jìn)而直接影響產(chǎn)品的安全性和有效性����,晶型控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求;
(7)粒度�����,影響物料的溶解性,進(jìn)而直接影響產(chǎn)品的安全性和有效性�����,粒度控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求�����;
(8)干燥失重/水分��,原料藥含有較大量的水分時(shí)�����,不僅使其含量降低��,還會(huì)引起水解或發(fā)生變質(zhì)���,從而使藥物失效����,進(jìn)而直接影響產(chǎn)品的安全性和有效性���,干燥失重/水分控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求���;
(9)含量���,含量影響投料準(zhǔn)確性,含量過低直接影響產(chǎn)品的安全性和有效性�����,含量控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求���;
(10)黏度��、分子量及分子量分布���,控制不低于中國(guó)藥典標(biāo)準(zhǔn)(若收錄)且符合制劑使用要求����;
(11)細(xì)菌內(nèi)毒素/熱原,直接影響產(chǎn)品的安全性和有效性���,控制原輔包�����、生產(chǎn)設(shè)備及注射用水等多途徑的細(xì)菌內(nèi)毒素不高于制劑標(biāo)準(zhǔn)��,盡量形成細(xì)菌內(nèi)毒素/熱原控制策略�����,若形不成細(xì)菌內(nèi)毒素/熱原控制策略則需要對(duì)原料藥或制劑進(jìn)行內(nèi)控���,細(xì)菌內(nèi)毒素/熱原控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求���;
(12)無菌,直接影響產(chǎn)品的安全性和有效性��,有無菌檢查項(xiàng)的制劑控制原料藥的無菌���,無菌控制不低于中國(guó)藥典標(biāo)準(zhǔn)且符合制劑使用要求�;
1.2原料藥穩(wěn)定性
1.2.1原料藥穩(wěn)定性查詢
(1)購(gòu)買原料藥小樣(多廠家購(gòu)買��,數(shù)量夠原輔料相容即可)��,詢問其要原料藥全套資料��,包括原料藥性質(zhì)、雜質(zhì)譜���、元素雜質(zhì)及致突變等資料��。(重點(diǎn)關(guān)注)
(2)參比制劑資料中關(guān)于原料藥的信息�,如美國(guó)的review��、日本的IF文件��、歐洲的審評(píng)報(bào)告等資料��。(重點(diǎn)關(guān)注)
(3)百度學(xué)術(shù)�、中國(guó)知網(wǎng)、PubChem及藥智網(wǎng)等網(wǎng)站�����;
1.2.2原料藥穩(wěn)定性匯總
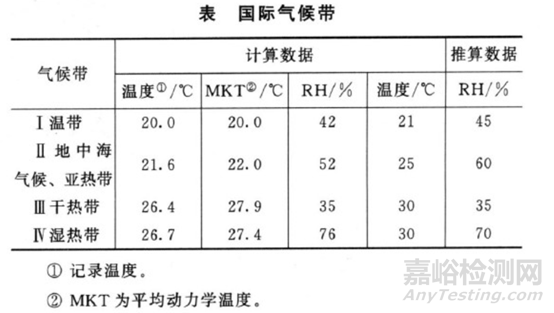
(1)國(guó)際氣候帶
中國(guó)總體來說屬亞熱帶�,部分地區(qū)屬濕熱帶,故長(zhǎng)期試驗(yàn)采用溫度為25℃±2℃���、相對(duì)濕度為60%±5%,或溫度30℃±2℃�����、相對(duì)濕度65%±5%,與美��、日�����、歐國(guó)際協(xié)調(diào)委員會(huì)(ICH)采用條件基本是一致的���。
原料藥物進(jìn)行加速試驗(yàn)與長(zhǎng)期試驗(yàn)所用包裝應(yīng)釆用模擬小桶���,但所用材料與封裝條件應(yīng)與大桶一致。
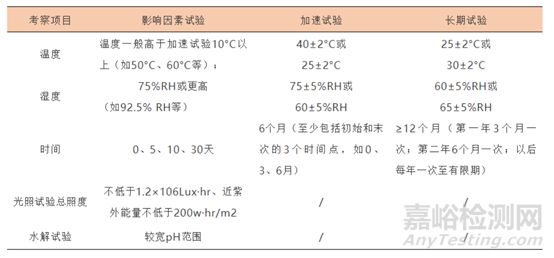
(2)原料藥穩(wěn)定性重點(diǎn)考察項(xiàng)目
(3)原料藥穩(wěn)定性試驗(yàn)選擇條件一般原則
(4)穩(wěn)定性試驗(yàn)包括影響因素試驗(yàn)�、加速試驗(yàn)與長(zhǎng)期試驗(yàn)。影響因素試驗(yàn)用1批原料藥物進(jìn)行����;如果試驗(yàn)結(jié)果不明確,則應(yīng)加試2個(gè)批次樣品��。生物制品應(yīng)直接使用3個(gè)批次����。加速試驗(yàn)與長(zhǎng)期試驗(yàn)要求用3批供試品進(jìn)行����。
(5)原料藥物供試品應(yīng)是一定規(guī)模生產(chǎn)的�。供試品量相當(dāng)于制劑穩(wěn)定性試驗(yàn)所要求的批量,原料藥物合成工藝路線�、方法�、步驟應(yīng)與大生產(chǎn)一致。藥物制劑供試品應(yīng)是放大試驗(yàn)的產(chǎn)品����,其處方與工藝應(yīng)與大生產(chǎn)一致���。每批放大試驗(yàn)的規(guī)模,至少是中試規(guī)模����。大體積包裝的制劑,如靜脈輸液等��,每批放大規(guī)模的數(shù)量通常應(yīng)為各項(xiàng)試驗(yàn)所需總量的10倍���。特殊品種�����、特殊劑型所需數(shù)量����,根據(jù)情況另定����。
(6)加速試驗(yàn)與長(zhǎng)期試驗(yàn)所用供試品的包裝應(yīng)與擬上市產(chǎn)品一致。
(7)研究藥物穩(wěn)定性��,要采用專屬性強(qiáng)���、準(zhǔn)確���、精密、靈敏的藥物分析方法與有關(guān)物質(zhì)(含降解產(chǎn)物及其他變化所生成的產(chǎn)物)的檢查方法����,并對(duì)方法進(jìn)行驗(yàn)證,以保證藥物穩(wěn)定性試驗(yàn)結(jié)果的可靠性���。在穩(wěn)定性試驗(yàn)中�����,應(yīng)重視降解產(chǎn)物的檢查���。
(8)若放大試驗(yàn)比規(guī)模生產(chǎn)的數(shù)量要小���,故申報(bào)者應(yīng)承諾在獲得批準(zhǔn)后,從放大試驗(yàn)轉(zhuǎn)入規(guī)模生產(chǎn)時(shí)�����,對(duì)最初通過生產(chǎn)驗(yàn)證的3批規(guī)模生產(chǎn)的產(chǎn)品仍需進(jìn)行加速試驗(yàn)與長(zhǎng)期穩(wěn)定性試驗(yàn)���。
(9)對(duì)包裝在有通透性容器內(nèi)的藥物制劑應(yīng)當(dāng)考慮藥物的濕敏感性或可能的溶劑損失��。
1.2.3原料藥穩(wěn)定性解析
(1)外觀���、物理常數(shù)、功能試驗(yàn)��,外觀��、物理常數(shù)��、功能試驗(yàn)(如顏色、粘度�����、硬度等指標(biāo))穩(wěn)定性過程中應(yīng)符合規(guī)定����,若超過標(biāo)準(zhǔn)限度要求���,通常被定義為“顯著變化”�����,不可被接受��;
(2)降解產(chǎn)物����,降解產(chǎn)物(即有關(guān)物質(zhì))穩(wěn)定性過程中增長(zhǎng)速度應(yīng)不高于參比制劑���,若降解產(chǎn)物(即有關(guān)物質(zhì))超過標(biāo)準(zhǔn)限度要求�,通常被定義為“顯著變化”���,不可被接受�����;
(3)pH值�����,pH值穩(wěn)定性過程中應(yīng)符合規(guī)定�,若超過標(biāo)準(zhǔn)限度要求,通常被定義為“顯著變化”����,不可被接受;
(4)含量�,含量與初始值相差5%;或釆用生物或免疫法測(cè)定時(shí)效價(jià)不符合規(guī)定���,通常被定義為“顯著變化”����,不可被接受�;
2、輔料性質(zhì)及穩(wěn)定性
2.1輔料性質(zhì)
2.1.1輔料性質(zhì)查詢方式
輔料性質(zhì)查詢方式同原料藥一致�,重點(diǎn)關(guān)注抗氧劑���、抑菌劑等特殊輔料性質(zhì);
2.1.2輔料性質(zhì)匯總
輔料性質(zhì)匯總同原料藥一致���,重點(diǎn)關(guān)注抗氧劑�、抑菌劑等特殊輔料性質(zhì)���;
2.1.3輔料性質(zhì)解析
輔料性質(zhì)解析同原料藥一致,重點(diǎn)關(guān)注抗氧劑�����、抑菌劑等特殊輔料性質(zhì)���;
2.2輔料穩(wěn)定性
2.2.1輔料穩(wěn)定性查詢
輔料穩(wěn)定性查詢同原料藥一致���,重點(diǎn)關(guān)注抗氧劑、抑菌劑等特殊輔料穩(wěn)定性����;
2.2.2輔料穩(wěn)定性匯總
輔料穩(wěn)定性匯總同原料藥一致,重點(diǎn)關(guān)注抗氧劑����、抑菌劑等特殊輔料穩(wěn)定性�;
2.2.3輔料穩(wěn)定性解析
輔料穩(wěn)定性匯總同原料藥一致����,重點(diǎn)關(guān)注抗氧劑、抑菌劑等特殊輔料穩(wěn)定性�����;
3���、制劑性質(zhì)及穩(wěn)定性
3.1制劑性質(zhì)
3.1.1制劑性質(zhì)查詢方式
制劑性質(zhì)查詢方式同原料藥一致����,重點(diǎn)關(guān)注特殊劑型如滴眼劑��、膠束等特殊制劑��;
3.1.2制劑性質(zhì)匯總
制劑性質(zhì)匯總同原料藥一致�,重點(diǎn)關(guān)注特殊劑型如滴眼劑、膠束等特殊制劑�����;
3.1.3制劑性質(zhì)解析
制劑性質(zhì)解析同原料藥一致,重點(diǎn)關(guān)注特殊劑型如滴眼劑����、膠束等特殊制劑;
3.2制劑穩(wěn)定性
3.2.1制劑穩(wěn)定性查詢
制劑穩(wěn)定性查詢同原料藥一致�����,重點(diǎn)關(guān)注特殊劑型如滴眼劑����、膠束等特殊制劑;
3.2.2制劑穩(wěn)定性匯總
制劑穩(wěn)定性匯總同原料藥一致�����,重點(diǎn)關(guān)注特殊劑型如滴眼劑��、膠束等特殊制劑��;
3.2.3制劑穩(wěn)定性解析
制劑穩(wěn)定性解析同原料藥一致�����,重點(diǎn)關(guān)注特殊劑型如滴眼劑���、膠束等特殊制劑�����;
4�����、附帶溶劑及配件性質(zhì)及穩(wěn)定性
4.1附帶溶劑及配件性質(zhì)
附帶溶劑及配件性質(zhì)不劣于參比制劑��,信息處理方式同制劑一致��;
4.2附帶溶劑及配件穩(wěn)定性
附帶溶劑及配件穩(wěn)定性不劣于參比制劑�����;
5����、總結(jié)
本篇通過查詢藥典及參比制劑資料等信息�����,系統(tǒng)的分析了《注射劑項(xiàng)目研發(fā)生產(chǎn)策略全解析》中(原輔料性質(zhì)及制劑穩(wěn)定性)��,深入了解了其物理、化學(xué)�、生物及微生物性質(zhì)及穩(wěn)定性,為后期的小試開發(fā)工藝參數(shù)提供依據(jù)���。
6���、資料收集途徑
1、https://db.yaozh.com/(藥智數(shù)據(jù)庫(kù)���,很全面�,90%以上的資料都有)
2�����、https://xueshu.baidu.com/(百度學(xué)術(shù)��,查制劑的文獻(xiàn)資料等)
3��、https://www.baidu.com/(百度��,查上市歷史�����、銷售數(shù)據(jù)等)
4���、https://www.drugfuture.com/pmda/(日本上市藥品數(shù)據(jù)庫(kù)�,查處方����、說明書等)
5、https://db.ouryao.com/(中國(guó)藥典��、法規(guī)及標(biāo)準(zhǔn)�����,查藥品及檢測(cè)標(biāo)準(zhǔn)等)
6�����、https://www.cde.org.cn/ (國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心�����,查原輔料上市信息及指導(dǎo)原則等)
7���、https://www.canbigou.com/directory.html (參比購(gòu)���,查參比制劑目錄)
8、https://www.drugfuture.com/fda/ (美國(guó)FDA藥品數(shù)據(jù)庫(kù)(U.S. FDA Drugs Database)��,查處方�����、說明書等)
9�����、https://www.drugfuture.com/ema/(歐盟EMA藥品數(shù)據(jù)庫(kù)��,查處方���、說明書等)
10�、https://drugx.cn/ (藥研導(dǎo)航,查各國(guó)藥監(jiān)局及藥典等)