摘要:目的:為規(guī)范藥品生產(chǎn)企業(yè)電子秤管理�����,保證藥品生產(chǎn)過(guò)程法規(guī)符合性。方法:對(duì)2020 年省內(nèi)注冊(cè)及GMP 符合性檢查中�����,電子秤使用缺陷進(jìn)行統(tǒng)計(jì)分析總結(jié)�����。結(jié)果與結(jié)論:通過(guò)共性問(wèn)題及法規(guī)要求�����,從藥品生產(chǎn)特點(diǎn)�����,闡述電子秤使用的規(guī)范�����,建議企業(yè)在藥品生產(chǎn)過(guò)程中�����,從設(shè)備選型�����、校準(zhǔn)�����、使用�����、清潔�����、持續(xù)監(jiān)控全生命周期入手�����,規(guī)范合理使用�����。
本文對(duì)2020年湖北省內(nèi)注冊(cè)及GMP符合性檢查中發(fā)現(xiàn)的高頻缺陷進(jìn)行針對(duì)性分析�����,通過(guò)共性問(wèn)題及法規(guī)要求,從藥品生產(chǎn)特點(diǎn)�����,對(duì)電子秤使用的缺陷問(wèn)題進(jìn)行分析�����,并提出相應(yīng)的改進(jìn)措施和建議�����,為藥品生產(chǎn)企業(yè)規(guī)范使用電子秤提供參考�����。
1�����、 我省檢查情況
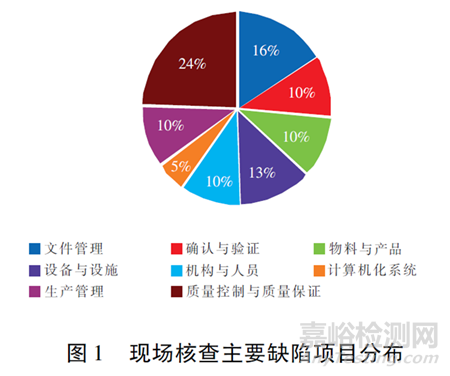
2020年湖北省共接收藥品GMP認(rèn)證及符合性檢查45家�����,其中�����,主要缺陷26 項(xiàng)�����,一般缺陷389項(xiàng)�����。新版GMP認(rèn)證條款分為12個(gè)部分[1]�����,缺陷排前三位的依次為質(zhì)量控制與質(zhì)量保證(94項(xiàng)) �����、文件管理(61項(xiàng)) �����、設(shè)備與設(shè)施(47項(xiàng)) ?����,F(xiàn)場(chǎng)檢查主要缺陷項(xiàng)目分布見(jiàn)圖1,其中�����,設(shè)備與設(shè)施涉及計(jì)量規(guī)范中的電子秤�����,使用缺陷問(wèn)題比較集中�����。
2�����、 電子秤使用時(shí)存在的問(wèn)題
2. 1 選型不合理
(1) 未根據(jù)藥品生產(chǎn)特點(diǎn)環(huán)境�����。潔凈區(qū)內(nèi)使用的普通電子秤�����,不方便清潔�����。
(2) 原料藥合成區(qū)�����,未使用防爆電子秤�����。
(3) 電子秤選材不合理�����,設(shè)備銹蝕嚴(yán)重�����。
(4) 稱量量程及最小分度值�����、等級(jí)選擇不合理�����,未滿足稱量需求。
(5) 稱量設(shè)備未滿足稱量精度需求�����,如提取車間磅秤精度0. 2kg時(shí)�����,與本品所需物料( 如: 五味子2. 88kg) 稱量精度不符�����。
(6) 未合理選擇稱量器具并記錄�����,如稱量氫氧化鈉使用天平最大稱量為1000g�����,燒杯283g�����,稱氫氧化鈉864g�����。
(7) 產(chǎn)品有12 種原輔料的稱量使用同一臺(tái)電子稱�����,未根據(jù)物料重量選擇合適稱量范圍和精度的電子稱�����。如稱量范圍(2~120) kg�����,精度0. 1kg時(shí)�����,物料最大使用量應(yīng)為120kg�����,最小使用量為2. 2kg�����。
(8) 口服溶液劑車間配料稱量單元內(nèi)僅一臺(tái)臺(tái)秤,且使用量程(0. 5~50) kg�����,不符合所有物料的稱量要求�����。
2. 2 校準(zhǔn)存在不足
(1) 《計(jì)量器具管理規(guī)程》中規(guī)定: 校準(zhǔn)砝碼在( 0~ 2. 5) kg 時(shí)�����,允許誤差為± 0. 05g�����。但實(shí)際誤差超過(guò)了允許誤差范圍�����。
(2) 貼膏劑使用的臺(tái)秤校驗(yàn)已過(guò)有效期�����。
(3) 校準(zhǔn)砝碼未涵蓋實(shí)際稱量使用范圍�����。膠囊填充間的天平日常使用砝碼為100g�����、500g�����,但車間常年生產(chǎn)的膠囊粒重為330mg�����。
(4) 原料藥噴霧干燥稱量臺(tái)秤應(yīng)采用10g砝碼進(jìn)行稱量前校準(zhǔn)�����,但該臺(tái)秤最小稱量值為400g�����,最大稱量值為60kg�����,分度值為20g�����,因此,日常采用10g和1kg 砝碼進(jìn)行校準(zhǔn)�����。
(5) 天平及臺(tái)秤未定期進(jìn)行檢查并記錄�����。
(6) 使用前�����,電子稱未用標(biāo)準(zhǔn)砝碼進(jìn)行校準(zhǔn)或檢查�����,且無(wú)記錄�����。
(7) 電子秤每日校準(zhǔn)所用的砝碼為20kg�����,但日常使用稱量重量為65kg�����,且裸露放置于電子秤旁邊的板凳上�����。
(8) 制劑車間所用校準(zhǔn)砝碼與實(shí)際需求不匹配�����。如露劑車間校準(zhǔn)砝碼為1kg�����、2kg�����,而常用稱量為( 25~50) kg�����。
2. 3 維護(hù)保養(yǎng)不足
(1) 天平室內(nèi)的天平臺(tái)不能防止震動(dòng); 十萬(wàn)分之一的精密電子天平無(wú)有效防震措施; 質(zhì)檢中心天平臺(tái)為鋼制結(jié)構(gòu)�����,不穩(wěn)定。
(2) 車間的稱量室的稱量臺(tái)不穩(wěn)固�����、明顯晃動(dòng)�����。
(3) 車間內(nèi)�����,稱量間所用臺(tái)秤的平衡氣泡點(diǎn)已損壞�����,不能顯示電子秤水平狀態(tài)�����。
(4) 提取車間中檢室天平放置的臺(tái)面未進(jìn)行防震設(shè)計(jì)�����。
(5) 用于試劑配制的校準(zhǔn)砝碼已被腐蝕�����。
2. 4 相關(guān)記錄不規(guī)范
(1) 實(shí)驗(yàn)室中�����,萬(wàn)分之一天平的儀器使用日志記錄�����,且每班記錄時(shí)間均一致�����,不能反應(yīng)真實(shí)情況�����。
(2) 企業(yè)對(duì)電子秤�����、臺(tái)秤沒(méi)有校準(zhǔn)記錄�����。
(3) D 級(jí)潔凈區(qū)電子天平無(wú)使用記錄。
(4) 檢驗(yàn)使用的電子天平記錄時(shí)�����,僅有使用時(shí)間�����、檢品名稱及劑型�����、批號(hào)等內(nèi)容�����,未見(jiàn)使用前校準(zhǔn)內(nèi)容�����。
(5) 電子秤最大量程為30kg�����,而儀器使用維護(hù)保養(yǎng)記錄中�����,某藥液的稱量顯示為39. 8kg�����。
2. 5 數(shù)據(jù)完整性問(wèn)題
(1) 記錄中�����,打印的稱量記錄設(shè)備型號(hào)與實(shí)際不一致�����。
(2) 設(shè)備打印的實(shí)際時(shí)間與使用時(shí)間不一致�����。
(3) 設(shè)備打印的數(shù)據(jù)與實(shí)際記錄不一致�����。
3�����、 缺陷問(wèn)題分析及建議
藥品質(zhì)量是企業(yè)的生命,制藥生產(chǎn)中最常見(jiàn)的操作為稱重操作�����,對(duì)設(shè)備本身要求比較高�����,并對(duì)日常使用�����、維護(hù)保養(yǎng)提出了更高的要求�����。若稱量過(guò)程中出現(xiàn)偏差�����,則可能導(dǎo)致一批產(chǎn)品不合格�����。因此�����,保障各參數(shù)計(jì)量顯示儀表的準(zhǔn)確無(wú)誤�����、正常運(yùn)轉(zhuǎn)�����,是企業(yè)計(jì)量工作的重要內(nèi)容�����。
3. 1 熟悉藥品相關(guān)法規(guī)要求
中國(guó)GMP 規(guī)定對(duì)“電子秤”無(wú)專章規(guī)定�����。“電子秤”使用規(guī)范可參考《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂版) 》中“第四章廠房與設(shè)施�����、第五章設(shè)備的相關(guān)法規(guī)”�����。為了后期的合理選型、使用和維護(hù)保養(yǎng)�����,藥品生產(chǎn)過(guò)程中�����,應(yīng)考慮污染和交叉污染的風(fēng)險(xiǎn)�����,設(shè)備應(yīng)根據(jù)所生產(chǎn)藥品的特性�����、工藝流程及相應(yīng)潔凈度級(jí)別�����,要求合理的設(shè)計(jì)�����、布局和使用; 對(duì)于靈敏度高的儀器,應(yīng)避免靜電�����、震動(dòng)�����、潮濕或其他外界因素的干擾; 與藥品直接接觸的生產(chǎn)設(shè)備�����,表面應(yīng)平整�����、耐腐蝕�����,配備適當(dāng)量程和精度的衡器�����、量具�����、儀器和儀表; 應(yīng)確保生產(chǎn)和檢驗(yàn)使用的關(guān)鍵衡器�����、量具�����、儀表�����,且記錄的控制設(shè)備和儀器應(yīng)經(jīng)校準(zhǔn)�����,確保數(shù)據(jù)準(zhǔn)確�����、可靠;生產(chǎn)�����、包裝、倉(cāng)儲(chǔ)過(guò)程中使用的自動(dòng)或電子設(shè)備�����,應(yīng)按照操作規(guī)程定期進(jìn)行校準(zhǔn)和檢查[2]�����,確保操作功能正常; 校準(zhǔn)和檢查應(yīng)有相應(yīng)的記錄�����。
3. 2 規(guī)范合理的選型
(1) 選型應(yīng)從產(chǎn)品質(zhì)量的影響�����,判定稱量的電子秤使用時(shí)的操作是否為關(guān)鍵步驟�����,并重點(diǎn)關(guān)注�����。
(2) 電子秤合理的選型通常應(yīng)考慮[3-6]: ①材質(zhì)選型是否合理�����,滿足藥品生產(chǎn)環(huán)境要求�����,如用于原料藥生產(chǎn)是否具備防爆要求; ②精度和準(zhǔn)確度否合理; ③是否滿足藥品生產(chǎn)法規(guī)的校準(zhǔn)要求; ④是否滿足生產(chǎn)工藝流程需求; ⑤是否滿足數(shù)據(jù)完整性要求�����。
(3) 藥品生產(chǎn)不同于一般工業(yè)生產(chǎn)�����,選型時(shí)應(yīng)滿足藥品法規(guī)中規(guī)定的設(shè)備�����、環(huán)境等相關(guān)要求�����。
3. 3 規(guī)范的校準(zhǔn)
GMP規(guī)范中要求: (1) 電子秤的計(jì)量校準(zhǔn)應(yīng)按照操作規(guī)程和校準(zhǔn)計(jì)劃�����,定期進(jìn)行校準(zhǔn)和檢查,并保存相關(guān)記錄; (2) 校準(zhǔn)的量程范圍應(yīng)涵蓋實(shí)際生產(chǎn)和檢驗(yàn)的使用范圍; (3) 日常使用校準(zhǔn)模式或周期性校準(zhǔn)模式�����。
在藥品生產(chǎn)過(guò)程中�����,電子秤的校準(zhǔn)分為日常檢查和校準(zhǔn)[7]�����。日校根據(jù)天平的關(guān)鍵性和使用頻率而定�����,若稱量結(jié)果不影響產(chǎn)品質(zhì)量和檢驗(yàn)數(shù)據(jù)�����,則可減少檢查頻率�����。為了控制風(fēng)險(xiǎn)�����,可在日校中控制兩個(gè)值�����,即限度值( 超出后應(yīng)進(jìn)行調(diào)查) 和警戒限( 避免超出限度) �����。若處于警戒限以內(nèi)�����,則可不做任何處理; 反之�����,則應(yīng)立即對(duì)天平進(jìn)行校準(zhǔn)�����,再重新日校�����。電子秤檢定校準(zhǔn)應(yīng)定期進(jìn)行,并保存相關(guān)記錄�����,且自校范圍應(yīng)涵蓋所稱量范圍[8]�����。選擇儀器時(shí)�����,應(yīng)考慮校準(zhǔn)的方法和成本�����,且選擇前�����,應(yīng)要求儀器供應(yīng)商提供全面的校準(zhǔn)指南�����。
3. 4 合理的使用及維護(hù)
稱重環(huán)境是指現(xiàn)場(chǎng)溫度�����、濕度�����、粉塵及振動(dòng)等對(duì)稱重結(jié)果造成重大影響的外部環(huán)境�����,應(yīng)根據(jù)外部環(huán)境的不同�����,選擇不同的秤滿足現(xiàn)場(chǎng)需求�����,如非常潮濕的環(huán)境�����,應(yīng)選擇IP 等級(jí)較高的秤; 對(duì)原料藥各種酸堿腐蝕�����、有機(jī)氣體,高溫�����、高濕惡劣的工業(yè)環(huán)境�����,應(yīng)要求復(fù)雜的精度[9]; 對(duì)干燥多塵環(huán)境化工的特殊環(huán)境�����,應(yīng)有防爆要求�����,而一般廠房為甲級(jí)防爆�����,符合安全生產(chǎn)要求; 從微量到重載�����,應(yīng)高效清潔�����、衛(wèi)生�����,且在無(wú)菌制劑C 級(jí)環(huán)境中�����,設(shè)備清潔必須滿足潔凈環(huán)境要求[10]�����。
根據(jù)電子稱的應(yīng)變片原理�����,每次搬動(dòng)可能造成形變�����,導(dǎo)致稱量結(jié)果的偏移[11]�����,應(yīng)根據(jù)日常使用地點(diǎn),固定位置存放和使用�����。為保持其安裝位置平穩(wěn)�����,處于水平狀態(tài)�����,可調(diào)整秤臺(tái)下的四角可調(diào)腳墊�����,使水銀泡處于中心位置�����,且四角需平穩(wěn)落地�����,處于懸空狀態(tài); 開(kāi)啟和關(guān)閉電源應(yīng)輕緩�����,稱量過(guò)程應(yīng)輕拿輕放�����,避免壓力傳感器受損; 使用場(chǎng)地應(yīng)避免振動(dòng)和較大的氣流影響�����,出現(xiàn)稱重不準(zhǔn)確�����。同時(shí)�����,應(yīng)滿足生產(chǎn)環(huán)境的清潔法規(guī)要求�����。
電子秤長(zhǎng)時(shí)間使用會(huì)受環(huán)境條件和人為因素影響出現(xiàn)問(wèn)題�����,為了確保計(jì)量的準(zhǔn)確性,在日常維護(hù)時(shí)�����,應(yīng)保持整機(jī)清潔�����,如粉塵�����、物料進(jìn)人電控箱�����、儀表盒等�����,應(yīng)及時(shí)使用壓縮空氣吹凈�����,并用干布捺拭干凈; 計(jì)量桶內(nèi)壁有物料粘附,應(yīng)及時(shí)清理; 設(shè)備中的易損件應(yīng)及時(shí)檢查�����、維護(hù)和更換�����,并檢查運(yùn)動(dòng)部件是否脫落�����、松動(dòng); 使用后�����,應(yīng)及時(shí)充電保持良好狀態(tài)�����。
3. 5 數(shù)據(jù)完整性的合規(guī)性
制藥數(shù)據(jù)的可靠性和完整性是確保合規(guī)性和患者安全的基礎(chǔ)�����,是生成數(shù)據(jù)和重建活動(dòng)的關(guān)鍵�����。全球制藥行業(yè)的基本法規(guī)要求: 從研發(fā)到生產(chǎn)和物流�����,應(yīng)記錄在案; 生成的數(shù)據(jù)應(yīng)進(jìn)行分析�����,并提供結(jié)果和報(bào)告�����,用于限定時(shí)間段內(nèi)的審查過(guò)程或?qū)徲?jì); 整條藥品生產(chǎn)鏈上生成的數(shù)據(jù)必須可靠且可追溯�����。稱重過(guò)程( 尤其是對(duì)于質(zhì)量至關(guān)重要的稱重過(guò)程) 必須符合良好的文件記錄規(guī)范( GDP) 準(zhǔn)則[12]�����。少量電子秤不具備數(shù)據(jù)完整性可追溯要求�����。
電子秤應(yīng)根據(jù)合理選型后,進(jìn)行有效數(shù)據(jù)的讀取和存儲(chǔ)�����,讀取顯示屏的數(shù)據(jù)即為原始的記錄數(shù)據(jù)�����。打印機(jī)應(yīng)符合GLP格式�����,至少包括天平序列號(hào)Header 和Footer 等內(nèi)容�����,一般會(huì)有填寫(xiě)樣品信息�����、人員簽字�����。
4�����、 結(jié)論
綜上所述�����,針對(duì)通過(guò)共性問(wèn)題�����,企業(yè)應(yīng)密切重視藥品生產(chǎn)的特殊性�����,遵從藥品法規(guī)�����,建立全生命周期的使用理念�����,從設(shè)備選型�����、校準(zhǔn)�����、使用�����、清潔�����、持續(xù)監(jiān)控全生命周期控制。同時(shí)�����,規(guī)范各項(xiàng)操作�����,確保企業(yè)稱量操作規(guī)范性�����,生產(chǎn)符合預(yù)期質(zhì)量的藥品�����。