概述:對于非無菌化學藥品及原輔料����,微生物限度是反映產(chǎn)品安全性和質量可控性的重要指標之一��。
一����、非無菌原輔料微生物限度研究
原輔料微生物控制策略的建立:
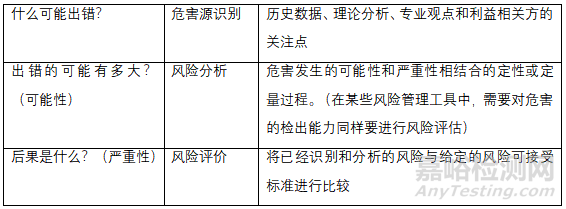
原輔料微生物限度研究應基于風險評估����,風險評估方法可以參考風險評估方法表和公認的風險管理工具表或適用合理的方法。
風險評估方法表
首先企業(yè)需要對自己的產(chǎn)品做到心里有數(shù)��,然后針對以上的三個問題進行評估��,而風險評價要綜合以上三個基本問題且有詳實的數(shù)據(jù)作為強有力的支撐��,這決定了評估結果的質量����。
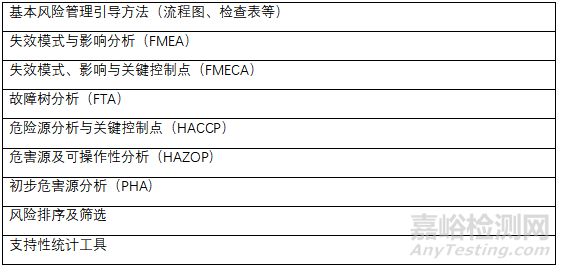
公認的風險管理工具
上述工具可適用于DS和DP質量等相關的特定領域�。質量風險管理方法和支持性統(tǒng)計工具可以組合使用,有助于質量風險管理原則的靈活應用��。
● 風險評估需綜合考慮原輔料的性質�、物料性質(包括起始物料、溶劑�、試劑�、催化劑等)��、生產(chǎn)工藝��、車間環(huán)境��、設備清潔狀態(tài)��、人員素質��、最差生產(chǎn)條件��、歷史數(shù)據(jù)及趨勢等因素��,參考ICH Q6A(原料藥和輔料的微生物限度檢查)制定微生物控制策略����。
● 首先判斷微生物能否在原輔料中生長或存活,若有足夠的科學支持性數(shù)據(jù)表明微生物既不能生長也不能存活����,結合風險評估結果可不考慮對微生物限度進行檢測。反之�,應進行研究和檢查。
● 需要說明的是,某些情況下原輔料不支持微生物的生長和繁殖��,但仍需要對微生物限度進行研究和控制�。例如,一些水分活度低的原輔料不適宜微生物的生長和繁殖��,但如果原輔料的初始生物負載較高����,某些耐受性較強的微生物仍可能存活并引入到終產(chǎn)品中。
二�、非無菌化學藥品微生物限度研究
微生物控制策略的建立:
* 當制劑中含有抑菌劑或制劑本身具有抗菌效力時,應進行如下研究:
● 含有抑菌劑����,應制定抑菌劑濃度可接受范圍,通過抑菌效力試驗來證明低于或等于擬定的抑菌劑最低濃度時的有效性�;
● 或提供科學依據(jù)證明制劑本身具有抗菌效力。需制定合理的微生物限度可接受標準����,并對微生物限度進行逐批檢測�。
1)若每批微生物限度檢測結果均符合可接受標準,可進行定期抽樣檢測�,抽樣頻率通過風險評估結果確定,或提供科學依據(jù)證明可不考慮進行常規(guī)微生物檢測��。
2)若定期抽樣檢測樣品出現(xiàn)微生物檢測結果大于可接受標準或微生物增長趨勢明顯的情況,應及時進行原因調查并將控制策略調整為逐批檢測����。
3)若微生物限度檢測結果大于可接受標準或微生物增長趨勢明顯時,則需將微生物限度訂入注冊標準并逐批檢測����。
4)需要說明的是,對于部分非無菌化學藥品如口服溶液劑�、栓劑等中國藥典中明確需進行微生物限度檢查的劑型,應結合中國藥典相關要求將微生物限度訂入注冊標準逐批檢測��。
* 如制劑中不含抑菌劑或制劑本身不具有抗菌效力��,應判斷制劑是否為固體制劑(如��,口服固體制劑)��。
● 如制劑屬于固體制劑�,且具有足夠的科學依據(jù)證明其具有抑制微生物生長的特性,可不考慮進行微生物限度檢查�。
● 如制劑不屬于固體制劑,或雖屬于固體制劑但沒有足夠的科學依據(jù)證明其具有抑制微生物生長的特性��,可參照以上1)和2)兩步執(zhí)行。
檢測方法的選擇:
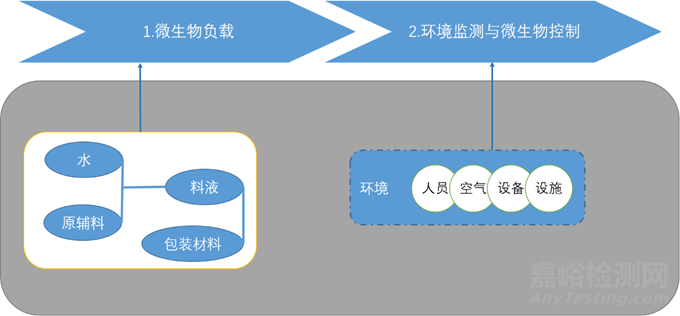
微生物負載控制策略:
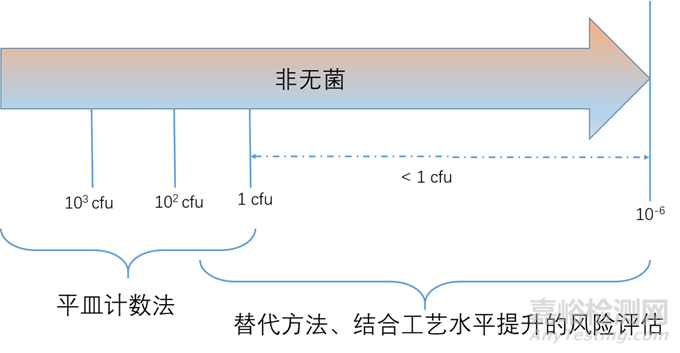
在原輔料生產(chǎn)過程的質量控制或終產(chǎn)品放行過程中����,其方法與藥典方法中相比,某些參數(shù)可能存在差異�,但二者應有明確的相關性;當藥典方法難以滿足質量控制要求時����,可根據(jù)風險評估結果,采用經(jīng)驗的替代方法進行質量控制��。當替代方法應用于終產(chǎn)品放行時�,其應優(yōu)于或等同于藥典方法。
限度的制定:
● 綜合考慮中國藥典相關要求�、原輔料來源、性質�、生產(chǎn)工藝條件、給藥途徑及微生物污染對患者的潛在危險�、目標患者人群等因素。
● 對于特殊品種(如��,小規(guī)格的吸入制劑)可在對上述因素評估的基礎上����,考慮以最小包裝單位規(guī)定限度標準,并提供相應的風險評估資料����。對藥品成份中含有動物內(nèi)臟提取物、未經(jīng)提取的動植物來源成分及礦物質��,或與上述產(chǎn)品共線生產(chǎn)時�,還應對沙門菌進行檢測。
● 境外上市藥品申請進口時��,應結合產(chǎn)品具體劑型�,原則上不低于中國藥典的要求;或根據(jù)風險評估結果�,結合中國藥典要求,制定合理的控制策略����。
非無菌藥品微生物限度標準可以參考《中國藥典》2020版通則(1107);微生物負載和微生物限度之間區(qū)別和聯(lián)系:微生物限度是根據(jù)患者的給藥途徑��,而微生物負載則是基于生產(chǎn)工藝控制需要�;兩者之間的聯(lián)系都是采用微生物計數(shù)法。
生產(chǎn)過程中的微生物控制:
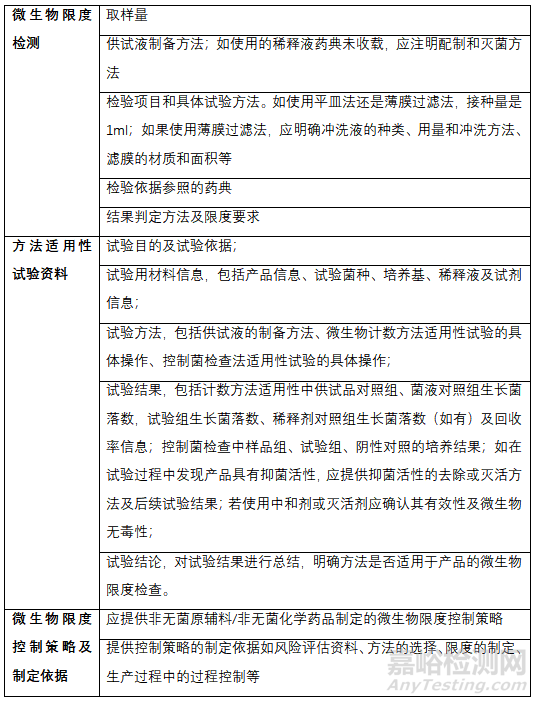
三�、微生物限度申報資料要求
申報資料內(nèi)容