歐盟發(fā)布 MDCG 2023-7
2023年12月21日�����,歐盟發(fā)布了“MDCG 2023-7 - Guidance on exemptions from the requirements to perform clinical investigations pursuant to Article 61(4)-(6) MDR”關(guān)于根據(jù) MDR 第61(4)-(6)條豁免臨床研究要求的指南����。
本指南旨在澄清將投放歐洲市場(chǎng)的植入式和III類醫(yī)療器械的臨床研究要求豁免以及與等同性證明的相關(guān)條件。它還提供了與根據(jù)附錄XIV第3節(jié)證明“足夠程度的數(shù)據(jù)訪問”相關(guān)的例子和考慮因素�����。
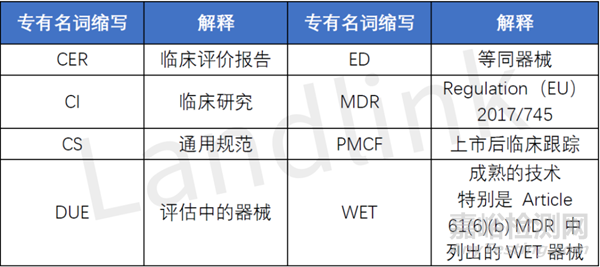
本文將涉及到諸多專有名詞的縮寫����,具體如下:
1、植入式及III類器械豁免臨床研究的要求
根據(jù) Article 61(4) MDR 規(guī)定��,應(yīng)對(duì)植入式和III類器械進(jìn)行臨床研究����,除非滿足以下幾種情況:
需要注意的是,這四個(gè)免于進(jìn)行臨床研究的情況相互獨(dú)立����。這意味著�����,除非直接引用��,否則其中一種情況中概述的條件不適用于其他情況��。
在情況1至3中的任何一種情況下��,制造商可以在不簽訂合同的情況下�����,在DUE的臨床評(píng)價(jià)中使用另一制造商的ED生成的臨床數(shù)據(jù)。這方面的唯一要求是滿足附錄XIV第3節(jié)中描述的等同性標(biāo)準(zhǔn)��。
ED數(shù)據(jù)的使用可以使制造商證明其臨床評(píng)價(jià)是基于“足夠的臨床數(shù)據(jù)”��。然而��,只有滿足上述情況中豁免條件的醫(yī)療器械��,制造商才能免于進(jìn)行臨床調(diào)查��。
2��、等同性聲明所需的"數(shù)據(jù)獲取的充分程度"
除了概述證明等同性所需考慮的技術(shù)、生物學(xué)和臨床特征外����,附錄XIV第3節(jié)MDR還要求制造商“[…] 有充分的條件獲取具有等同性的相關(guān)器械上數(shù)據(jù),以證明其等同性聲明”����。
如上節(jié)表格所述,證明“數(shù)據(jù)獲取的充分程度”并不需要在所有情況下簽訂合同�����。合同僅適用于 Article 61(5) MDR 所述的豁免情況��。還應(yīng)注意的是����,附錄XIV第3節(jié)專門提到了證明等同性聲明所需的數(shù)據(jù):即,要求有足夠的獲取途徑來確定評(píng)估等同性所依據(jù)的臨床����、技術(shù)和生物特征,而不是獲得完整的技術(shù)文件����。
Article 61(5) MDR所述的兩家制造商簽訂的合同被推定為能夠提供了證明等同性所需的全部數(shù)據(jù)��。然而��,在不需要合同的情況下����,其他獲取數(shù)據(jù)的手段也足以支持等同性證明����,例如前文提到的情況1-3及情況4的特殊子集。
在情況4中����,MDR不禁止在DUE的臨床評(píng)價(jià)中使用來自多個(gè)制造商ED的臨床數(shù)據(jù)。在這種情況下����,只需要與一家制造商簽訂合同��,就可以豁免臨床調(diào)查��,并在沒有合同的情況下使用其他制造商器械的數(shù)據(jù)(證明其等同性)來補(bǔ)充臨床評(píng)價(jià)中的數(shù)據(jù)��。但DUE的制造商必須在CER中陳述他們充分獲取數(shù)據(jù)級(jí)別的理由��,并且必須得到公告機(jī)構(gòu)的認(rèn)可。
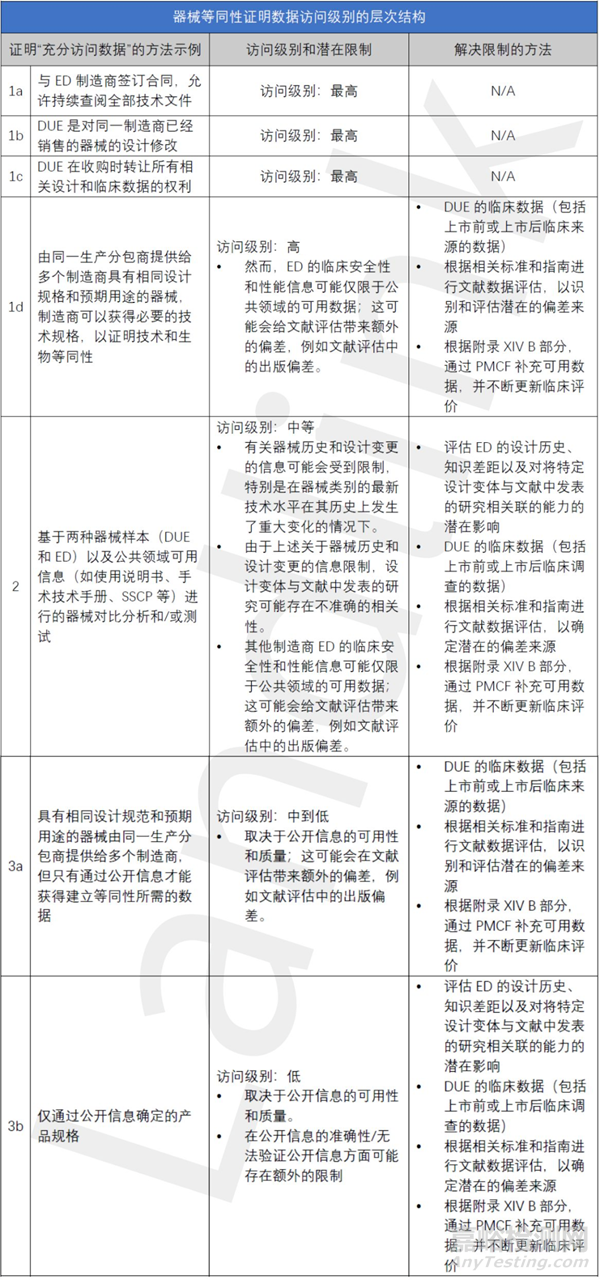
下表提供了一些與證明等同性相關(guān)的數(shù)據(jù)獲取方式的示例��,并提出了與該數(shù)據(jù)獲取級(jí)別相關(guān)的等級(jí)結(jié)構(gòu)�����。它還指出了這些方法和手段的潛在局限性�����,可以通過這些方法和途徑來解決這些局限性��,但此表僅用于說明目的�����,并非涵蓋所有情況或是規(guī)定性的�����。