對(duì)于植入和III類器械的制造商申請(qǐng)CE認(rèn)證來說�����,困擾的首要問題通常都是到底是否需要進(jìn)行臨床試驗(yàn)��;若是不做臨床試驗(yàn)�����,走等同路徑到底是否一定需要合同���?MDCG協(xié)調(diào)小組似乎洞察到了大家的這一疑問���,這次發(fā)布的指南文件MDCG2023-7直指這兩大敏感問題���。本指南旨在澄清將投放歐洲市場(chǎng)的植入式和III類醫(yī)療器械的臨床試驗(yàn)要求豁免以及與等效性證明相關(guān)的相關(guān)條件。它還提供了與根據(jù)MDR附錄XIV第3節(jié)證明“足夠程度的數(shù)據(jù)訪問”相關(guān)的例子和考慮因素�����。
臨床試驗(yàn)要求豁免
對(duì)于III類和植入醫(yī)療器械來說���,MDR原文中提到的4種可豁免進(jìn)行臨床試驗(yàn)的情況:
1.Article 61(4) 前三個(gè)短劃線所指明的情況:
— 該器械由同一制造商對(duì)已投放市場(chǎng)的器械進(jìn)行改造而成���;
— 依據(jù)附錄XIV第3節(jié)規(guī)定,已改進(jìn)的器械經(jīng)制造商證明后等同于投放市場(chǎng)的器械��,且此證明已得到公告機(jī)構(gòu)認(rèn)可��;
— 對(duì)投放市場(chǎng)的器械進(jìn)行臨床評(píng)價(jià)足以證明已改進(jìn)的器械符合相關(guān)的安全性能要求
在這種情況下��,公告機(jī)構(gòu)應(yīng)核查 PMCF(上市后臨床跟蹤) 計(jì)劃是合適的���,且其中包括上市后研究�����,以證明器械的安全和能�����。此外��,MDR第61條第 6 段所述的情況無需進(jìn)行臨床研究���。
2.Article 61(6)(a):
此類器械依據(jù)第 90/385/EEC 號(hào)指令或第 93/42/EEC 號(hào)指令已合法投放市場(chǎng)或投入使用��,其臨床評(píng)價(jià):
— 基于足夠的臨床數(shù)據(jù)���;
— 符合此類器械臨床評(píng)價(jià)相關(guān)的產(chǎn)品CS(如果有)。
3.Article 61(6)(b):
針對(duì)縫線��、訂書釘�����、牙齒填充物��、牙套�����、齒冠���、螺釘��、楔子�����、板�����、電線��、別針��、小夾和連接器而進(jìn)行的臨床評(píng)價(jià)均應(yīng)建立在充分的臨床數(shù)據(jù)上且符合相關(guān)的產(chǎn)品特定的 CS(如果有)�����。
4.Article 61(5):
依據(jù)MDR第61條第4段規(guī)定��,制造商生產(chǎn)出的器械經(jīng)證實(shí)等同于已投放市場(chǎng)的器械(不屬于同一制造商生產(chǎn))��,除此條所要求的內(nèi)容外��,若以下條件均滿足���,則無需進(jìn)行臨床研究:
— 在這兩個(gè)制造商擬定合同的適當(dāng)位置明確允許第二種器械制造商在現(xiàn)有基礎(chǔ)上全權(quán)使用技術(shù)文件��。
— 原始臨床評(píng)價(jià)已依照MDR要求執(zhí)行���,且第二種器械制造商向公告機(jī)構(gòu)提供其明確證據(jù)。
總結(jié):
對(duì)于植入和III類器械來說��,若能滿足如下其中一條��,則有可能豁免進(jìn)行臨床試驗(yàn):
● 該產(chǎn)品是本公司已經(jīng)上市產(chǎn)品改型而成���,且能證明等同��;
● 該產(chǎn)品已獲取MDD下的CE認(rèn)證證書���,且基于較為充足的臨床數(shù)據(jù);
● 該產(chǎn)品為WET清單中的器械�����;
● 與任何一家可以作為等同的器械的制造商簽訂了授權(quán)合同�����;
獲取數(shù)據(jù)的充分程度
MDCG2023-7強(qiáng)調(diào)�����,證明“足夠的訪問水平”并不需要在所有情況下簽訂合同���。合同僅適用于MDR中第61(5)條所述的豁免情況���。還應(yīng)注意的是,MDR的附錄XIV第3節(jié)專門提到了證明等效性聲明所需的數(shù)據(jù):即���,要求有足夠的途徑來確定評(píng)估等效性所依據(jù)的臨床�����、技術(shù)和生物特征�����,而不是獲得完整的技術(shù)文件�����。
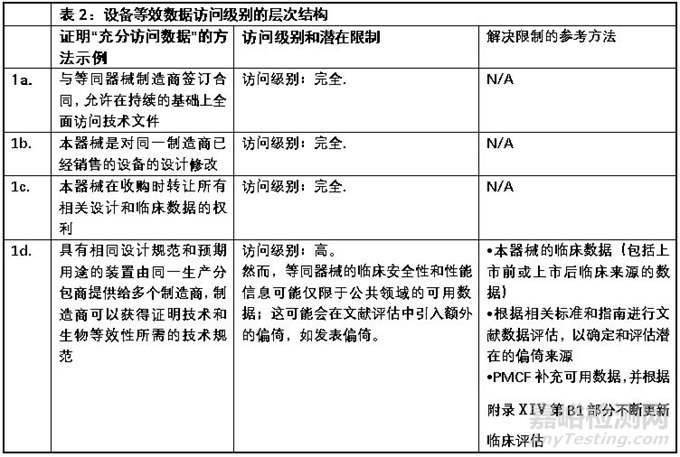
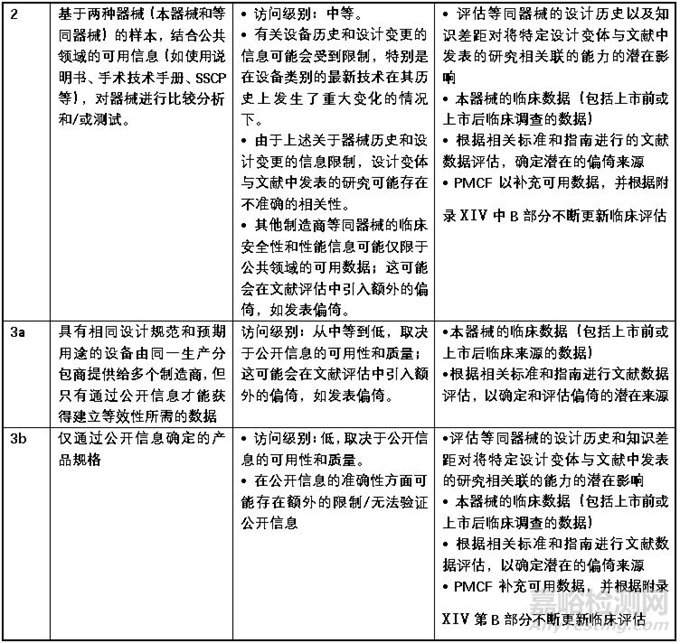
MDCG2023-7用附表2的形式對(duì)“充分訪問數(shù)據(jù)”的方法進(jìn)行了闡述���,該表格內(nèi)容對(duì)公告機(jī)構(gòu)和制造商來說都是評(píng)估等同數(shù)據(jù)是否可認(rèn)為充分獲得的重要參考�����。