由于化學(xué)仿制藥注射劑過(guò)量灌裝沒(méi)有明確的指導(dǎo)原則��,近年來(lái)針對(duì)化學(xué)仿制藥注射劑過(guò)量灌裝的發(fā)補(bǔ)通知逐年增多���,審評(píng)老師大體會(huì)問(wèn)(1)過(guò)量灌裝的合理性���,(2)過(guò)量灌裝的量制定的合理性,(3)并結(jié)合臨床用法及本品和參比制劑復(fù)溶后抽取情況予以說(shuō)明��,審評(píng)老師的靈魂三問(wèn)直擊化學(xué)仿制藥注射劑過(guò)量灌裝的本質(zhì)�����,令對(duì)化學(xué)仿制藥注射劑過(guò)量灌裝缺乏科學(xué)性���、合理性研究的藥企手足無(wú)措��?�;瘜W(xué)仿制藥注射劑過(guò)量灌裝指導(dǎo)原則的缺乏���、有指導(dǎo)原則缺無(wú)實(shí)例解析讓藥企有種“停杯投箸不能食,拔劍四顧心茫然”之感�����。
本文依據(jù)(1)2020年5月CDE發(fā)布的《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評(píng)價(jià)技術(shù)要求》中關(guān)于過(guò)量灌裝的闡述“如參比制劑存在過(guò)量灌裝���,仿制藥的過(guò)量灌裝宜與參比制劑保持一致�����,如不一致需提供合理性論證��。”��、(2)2023年9月CDE發(fā)布的《化學(xué)仿制藥注射劑過(guò)量灌裝研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》及本人在實(shí)際工作中的實(shí)戰(zhàn)經(jīng)驗(yàn)并結(jié)合實(shí)例對(duì)化學(xué)仿制藥注射劑過(guò)量灌裝進(jìn)行較為系統(tǒng)的思考��,不當(dāng)之處還請(qǐng)業(yè)內(nèi)同行予以探討補(bǔ)充��。
1�����、化學(xué)仿制藥注射劑過(guò)量灌裝解析
在對(duì)化學(xué)仿制藥注射劑過(guò)量灌裝系統(tǒng)思考之前首先需要明確(1)何為過(guò)量灌裝���?(2)影響過(guò)量灌裝的因素��,(3)不科學(xué)合理過(guò)量灌裝的危害���,(4)過(guò)量灌裝的目的,(5)過(guò)量灌裝制定的依據(jù)���。
(1)何為過(guò)量灌裝�����?
《化學(xué)仿制藥注射劑過(guò)量灌裝研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》給出了詳細(xì)的闡述:注射劑的過(guò)量灌裝是指每個(gè)容器中藥品的灌裝量較標(biāo)示量適當(dāng)增加的體積或重量���,以確保實(shí)際給藥劑量滿足說(shuō)明書(shū)中規(guī)定的用量。
(2)影響過(guò)量灌裝的因素
由于在臨床使用過(guò)程中需將注射劑轉(zhuǎn)移出來(lái)輸注至患者體內(nèi)���,實(shí)際給藥劑量不可避免的受到包材黏附�����、藥液粘度及輸注系統(tǒng)黏附的影響���。
(3)不科學(xué)合理過(guò)量灌裝的危害
增加的灌裝量使可轉(zhuǎn)移劑量低于標(biāo)示量:導(dǎo)致患者用藥不足,療效降低。
增加的灌裝量使可轉(zhuǎn)移劑量高于標(biāo)示量:可能會(huì)由于明顯的藥物過(guò)量而引起安全性方面的風(fēng)險(xiǎn)�����,以及給藥后藥瓶中殘留藥品過(guò)多可能用于第二劑而造成的藥品污染���、錯(cuò)用等風(fēng)險(xiǎn)。
(4)過(guò)量灌裝的目的
保證患者實(shí)際給藥劑量達(dá)到說(shuō)明書(shū)中規(guī)定的用量��。
(5)過(guò)量灌裝制定的依據(jù)
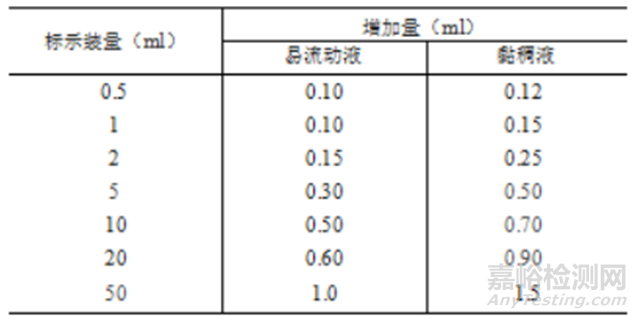
①《中國(guó)藥典》(2020年版四部0102注射劑)注射劑的灌裝標(biāo)示裝量不大于50ml時(shí)�����,可參考中國(guó)藥典推薦的易流動(dòng)液和粘稠液過(guò)量灌裝量�����,適當(dāng)增加裝量�����。
②注射液應(yīng)照《中國(guó)藥典》(2020年版四部0102注射劑)項(xiàng)下裝量方法進(jìn)行檢查��,每支(瓶)的裝量均不得少于其標(biāo)示裝量���。
③凍干粉針應(yīng)照說(shuō)明書(shū)中規(guī)定的使用方法進(jìn)行抽提試驗(yàn)并測(cè)定復(fù)溶后溶液濃度��,保證自制制劑實(shí)際可抽取劑量與參比制劑保持一致且不低于標(biāo)示量��。
④《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評(píng)價(jià)技術(shù)要求》:為確保仿制藥用法用量與參比制劑的一致性�����,化學(xué)仿制藥注射劑的過(guò)量灌裝宜與參比制劑保持一致���,如不一致需提供合理性論證���,應(yīng)確保每支(瓶)產(chǎn)品的給藥劑量均不低于標(biāo)示量。
綜上所述���,化學(xué)仿制藥注射劑的過(guò)量灌裝宜與參比制劑保持一致���,確保每支(瓶)產(chǎn)品的給藥劑量均不低于標(biāo)示量,并符合《中國(guó)藥典》(2020年版四部0102注射劑)中關(guān)于增加裝量及裝量檢測(cè)的要求��。
2��、參比制劑研究
研發(fā)人員應(yīng)充分調(diào)研參比制劑信息�����,并對(duì)多批參比制劑的裝量進(jìn)行詳細(xì)研究,綜合分析參比制劑的過(guò)量灌裝情況��。
(1)注射液
如規(guī)格為10ml:50mg的參比制劑���,按照《中國(guó)藥典》(2020年版四部0102注射劑)項(xiàng)下裝量方法進(jìn)行檢查�����,確定參比制劑裝量為10.1ml,絕對(duì)裝量為10.5ml���,裝量不少于其標(biāo)示裝量10ml���,參比制劑的含量符合質(zhì)量標(biāo)準(zhǔn)。
自制制劑在制定灌裝量時(shí)需依據(jù)中國(guó)藥典增加裝量��,保證自制制劑過(guò)量灌裝與參比制劑保持一致�����,確保每支(瓶)產(chǎn)品的給藥劑量均不低于標(biāo)示量�����。
(2)注射用無(wú)菌粉末
如規(guī)格為0.2g的參比制劑,按照說(shuō)明書(shū)中規(guī)定的使用方法進(jìn)行抽提試驗(yàn)并測(cè)定復(fù)溶后溶液濃度�����,確定可抽取體積�����、總體積���,計(jì)算出可抽取劑量�����、總劑量�����,保證自制制劑實(shí)際可抽取劑量與參比制劑保持一致且不低于標(biāo)示量��。
3���、仿制藥過(guò)量灌裝的研究
3.1注射液
以仿制的參比制劑規(guī)格為10ml:50mg為例��,按照“2�����、參比制劑(1)注射劑”對(duì)參比制劑的裝量進(jìn)行了研究�����。
(1)理論灌裝量上下限
理論灌裝量下限=標(biāo)示裝量+過(guò)量體積(ml)
理論灌裝量上限=標(biāo)示裝量×合理論證的系數(shù)+過(guò)量體積(ml)
過(guò)量體積:根據(jù)藥典建議過(guò)量灌裝體積為0.5ml
合理論證系數(shù):①合理論證系數(shù)考慮灌裝精度的話���,灌裝精度為±1%,合理論證系數(shù)的中間值為1.01��,下限1.00���,上限1.02,合理論證系數(shù)取上限1.02���,②合理論證系數(shù)考慮含量的話���,含量范圍是95%-105%,則合理論證系數(shù)上限就為1.05��,經(jīng)過(guò)分析論證后取系數(shù)較大者經(jīng)計(jì)算作為灌裝上限。
理論灌裝量下限=10ml(標(biāo)示裝量)+0.50ml(過(guò)量體積)=10ml +0.50ml =10.50ml
理論灌裝量上限=10ml(標(biāo)示裝量)×1.05(合理論證系數(shù))+0.50ml(過(guò)量體積) =10.50ml+0.50ml=11.00ml
如果真的以理論灌裝量上下限的中間值去進(jìn)行生產(chǎn)的話��,該品種的含量均值會(huì)在102.5%附近���,還可以接受�����,但如果以接近灌裝量上限灌裝的話�����,再考慮檢測(cè)誤差��,含量結(jié)果很大可能會(huì)超過(guò)質(zhì)量標(biāo)準(zhǔn)105%的規(guī)定��。
在實(shí)際生產(chǎn)中根據(jù)灌裝精度控制灌裝量上限更具有科學(xué)性及實(shí)用性��,所以選擇灌裝精度上限作為合理論證系數(shù)��。
(2)內(nèi)控灌裝量上下限
生產(chǎn)時(shí)需考慮生產(chǎn)設(shè)備的灌裝精度的影響��,以保證實(shí)際給藥劑量不低于標(biāo)示量��,如產(chǎn)品所用生產(chǎn)設(shè)備的灌裝精度在灌裝量10ml時(shí)為±1%(生產(chǎn)設(shè)備的灌裝精度在不同的灌裝量是不一樣的)�����,即±0.10ml���。
內(nèi)控灌裝量下限=10ml(標(biāo)示裝量)+0.50ml(過(guò)量體積)+0.00ml(灌裝精度下限)=10ml +0.50ml +0.00ml=10.50ml
內(nèi)控灌裝量中間值=10ml(標(biāo)示裝量)+0.50ml(過(guò)量體積)+0.10ml(灌裝精度中間值)=10ml +0.50ml +0.10ml=10.60ml
在實(shí)際生產(chǎn)中根據(jù)灌裝精度控制灌裝量上限更具有科學(xué)性及實(shí)用性�����,即選擇灌裝精度上限作為合理論證系數(shù)��。
內(nèi)控灌裝量上限=10ml(標(biāo)示裝量)×1.02(合理論證系數(shù))+0.50ml(過(guò)量體積)=10.20ml+0.5ml=10.70ml
(3)小結(jié)
該品種灌裝量可以設(shè)定為理論灌裝量范圍:10.50ml~11.00ml�����,內(nèi)控灌裝量范圍:10.50ml~10.70ml���。
3.2��、參比制劑說(shuō)明書(shū)中明確復(fù)溶后濃度的情形
以仿制的參比制劑規(guī)格為0.2g為例���,按照“2��、參比制劑(2)注射用無(wú)菌粉末”對(duì)參比制劑的裝量進(jìn)行了研究���。
(1)理論灌裝量上下限
總藥量下限=復(fù)溶后標(biāo)示濃度(mg/ml)×復(fù)溶后總體積
總藥量上限=復(fù)溶后標(biāo)示濃度(mg/ml)×合理論證的系數(shù)×復(fù)溶后總體積
復(fù)溶后標(biāo)示濃度:40mg/ml
復(fù)溶后總體積:5.4ml
檢測(cè)藥液實(shí)際濃度:39.5mg/ml
合理論證系數(shù):①合理論證系數(shù)考慮灌裝精度的話���,灌裝精度為±1%,合理論證系數(shù)的中間值為1.01���,下限1.00��,上限1.02�����,合理論證系數(shù)取上限1.02���,②合理論證系數(shù)考慮含量的話,含量范圍是95%-105%��,則合理論證系數(shù)上限就為1.05���,經(jīng)過(guò)分析論證后取系數(shù)較大者經(jīng)計(jì)算作為灌裝上限���。
理論總藥量下限=復(fù)溶后標(biāo)示濃度(mg/ml)×復(fù)溶后總體積=40mg/ml×5.4ml=216mg
總藥量上限=復(fù)溶后標(biāo)示濃度(mg/ml)×合理論證的系數(shù)×復(fù)溶后總體積=40mg/ml×1.05×5.4ml=226.8mg
理論灌裝量下限=理論總藥量下限/產(chǎn)品濃度=216 mg /39.5 mg/ml =5.47ml
理論灌裝量上限=理論總藥量上限/產(chǎn)品濃度=226.8 mg /39.5mg/ml =5.74ml
這樣會(huì)與注射液出現(xiàn)同樣的問(wèn)題,如果真的以理論灌裝量上下限的中間值去進(jìn)行生產(chǎn)的話,該品種的含量均值會(huì)在102.5%附近���,還可以接受�����,但如果以接近灌裝量上限灌裝的話�����,再考慮檢測(cè)誤差���,含量結(jié)果很大可能會(huì)超過(guò)質(zhì)量標(biāo)準(zhǔn)105%的規(guī)定。
在實(shí)際生產(chǎn)中根據(jù)灌裝精度控制灌裝量上限更具有科學(xué)性及實(shí)用性��,選擇灌裝精度上限作為合理論證系數(shù)�����。
(2)內(nèi)控灌裝量上下限
該品種的灌裝精度(注意:一般而言��,灌裝量越低���,按百分?jǐn)?shù)計(jì)算灌裝精度也越低)為灌裝體積的±1%,合理論證系數(shù)中間值為1.01���,下限為1.00�����,上限為1.02��,為確保每支(瓶)產(chǎn)品的實(shí)際給藥劑量均不低于標(biāo)示量�����,則以灌裝精度為合理論證系數(shù)��,取上限1.02���。
內(nèi)控總藥量下限=復(fù)溶后標(biāo)示濃度(mg/ml)×復(fù)溶總體積=40 mg/ml×5.4ml=216mg
內(nèi)控總藥量上限=復(fù)溶后標(biāo)示濃度(mg/ml)×合理論證系數(shù)×復(fù)溶總體積=40mg/ml×1.02×5.4ml=220.32mg
內(nèi)控灌裝量下限=總藥量下限/產(chǎn)品濃度×灌裝精度下限=216 mg /39.5 mg/ml *1.00=5.47ml
內(nèi)控灌裝量上限=總藥量上限/產(chǎn)品濃度=220.32mg /39.5 mg/ml =5.58ml
(3)小結(jié)
該品種總藥量可以設(shè)定為理論總藥量范圍:216mg~226.8mg�����,內(nèi)控總藥量范圍:216mg~220.32mg�����。
該品種灌裝量可以設(shè)定為理論灌裝量范圍:5.47ml~5.74ml���,內(nèi)控灌裝量范圍:5.47ml~5.58ml�����。
3.3 參比制劑說(shuō)明書(shū)中未明確復(fù)溶后濃度的情形
(1)解析參比制劑
某凍干制劑規(guī)格為0.4g�����,含量為標(biāo)示量的95%~105%���,根據(jù)參比制劑說(shuō)明書(shū)的用法,加20ml注射用水將參比制劑進(jìn)行復(fù)溶�����。
根據(jù)參比制劑凍干塊狀物體積的測(cè)定��,復(fù)溶前藥液體積約為5ml�����。根據(jù)參比制劑以上信息確定自制制劑的總藥量和灌裝量�����。
(2)自制制劑
配制自制制劑藥液濃度80mg/ml,精確灌裝5ml��,凍干��,加入20ml注射用水將自制制劑進(jìn)行復(fù)溶��。
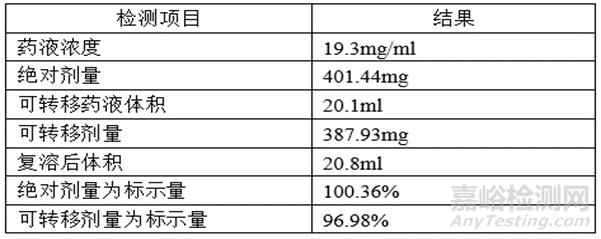
檢測(cè)結(jié)果雖然符合質(zhì)量標(biāo)準(zhǔn)規(guī)定的標(biāo)示量的95%~105%���,但自制制劑的可轉(zhuǎn)移劑量明顯低于參比制劑,因此需要調(diào)整灌裝量以保證自制制劑的過(guò)量灌裝與參比制劑保持一致���,確保每支(瓶)產(chǎn)品的給藥劑量均不低于標(biāo)示量���。
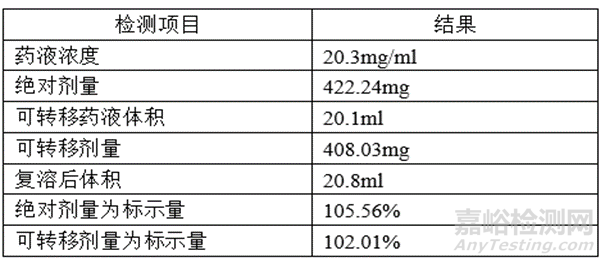
如果檢測(cè)多批參比制劑可轉(zhuǎn)移劑量均值為408.03mg,絕對(duì)劑量均值為422.24mg��,自制制劑與參比制劑包材中藥液殘留一致��,可采用
參比制劑可轉(zhuǎn)移劑量均值=自制制劑可轉(zhuǎn)移劑量=408.03mg
參比制劑絕對(duì)劑量均值=自制制劑絕對(duì)劑量=422.24mg
自制制劑灌裝體積=自制制劑絕對(duì)劑量/自制制劑藥液濃度=422.24mg/ 80mg/ml�����,灌裝體積為5.28ml
在實(shí)際生產(chǎn)中根據(jù)灌裝精度控制灌裝量上限更具有科學(xué)性及實(shí)用性��,例如,該品種的灌裝精度為灌裝體積的±1%�����,合理論證系數(shù)中間值為1.01�����,下限為1.00�����,上限為1.02���,為確保每支(瓶)產(chǎn)品的實(shí)際給藥劑量均不低于標(biāo)示量且可轉(zhuǎn)移劑量與參比制劑一致�����,則以灌裝精度為合理論證系數(shù)���,取下限1.00和上限1.02。
內(nèi)控灌裝量下限=自制制劑灌裝體積*灌裝精度下限=5.28ml *1.00=5.28ml
內(nèi)控灌裝量上限=自制制劑灌裝體積*灌裝精度上限=5.28ml *1.02=5.39ml
因此��,該品種絕對(duì)灌裝劑量為422.24mg�����,該品種內(nèi)控灌裝量范圍:5.28ml~5.39ml
4、總結(jié):長(zhǎng)風(fēng)破浪會(huì)有時(shí)��,直掛云帆濟(jì)滄海
通過(guò)對(duì)《化學(xué)仿制藥注射劑過(guò)量灌裝研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》深度思考��,結(jié)合工作中的實(shí)際案例分析包材黏附�����、制劑本身性質(zhì)�����、說(shuō)明書(shū)規(guī)定及臨床操作��,科學(xué)���、合理的制定化學(xué)仿制藥注射劑過(guò)量灌裝及理論、內(nèi)控的灌裝量上下限��,希望可以給到同行一些參考���。
隨著《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評(píng)價(jià)技術(shù)要求》�����、《化學(xué)仿制藥注射劑過(guò)量灌裝研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》相繼發(fā)布�����,關(guān)于化學(xué)仿制藥注射劑過(guò)量灌裝的研究方法和研究策略逐漸增多��,科學(xué)�����、合理的制定化學(xué)仿制藥注射劑過(guò)量灌裝�����,在滿足說(shuō)明書(shū)中規(guī)定用量的同時(shí)減少使用過(guò)程中的安全性風(fēng)險(xiǎn)變得可實(shí)現(xiàn)���。
5���、參考文獻(xiàn)
1. 國(guó)家食品藥品監(jiān)督管理總局《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評(píng)價(jià)技術(shù)要求》(2020 年 5 月).
2. 國(guó)家食品藥品監(jiān)督管理總局《化學(xué)仿制藥注射劑過(guò)量灌裝研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》(2023 年9 月).
3. 《中國(guó)藥典》(2020年版四部0102注射劑)
4. FDA. Allowable Excess Volume/Content in Injectable 104 Drug and Biological Products(MAPP 5019.1 Rev 1).2022
5. USP<1151> Pharmaceutical dosage forms
6. USP< 697> Container content for injections