今日頭條
恒瑞MOR靶向鎮(zhèn)痛藥報新NDA�����。恒瑞醫(yī)藥1類新藥富馬酸泰吉利定注射液(SHR8554)的新適應癥上市申請獲CDE受理��,推測申報的適應癥為“骨科手術后鎮(zhèn)痛”�。SHR8554可激活μ阿片受體(MOR),選擇性地激活G蛋白偶聯(lián)通路�����,具有中樞鎮(zhèn)痛效果的同時���,可減輕胃腸道不良反應和減少呼吸抑制不良反應的發(fā)生率����。2022年7月���,泰吉利定針對“腹部手術后中重度疼痛”上市申請已獲得CDE受理����。
國內藥訊
1.復宏漢霖PD-1單抗獲批印尼上市。復宏漢霖PD-1抑制劑漢斯狀®(斯魯利單抗�����,H藥)獲得印度尼西亞藥監(jiān)部門(BPOM)批準上市��,用于治療廣泛期小細胞肺癌(ES-SCLC)��,商品名為Zerpidio®�。這是H藥首次在海外獲批上市。PT Kalbe Genexine Biologics(KGbio)公司擁有H藥在東盟十國以及在沙特阿拉伯���、阿聯(lián)酋�、埃及��、卡塔爾�、約旦、摩洛哥等12個中東和北非地區(qū)(MENA)國家的部分適應癥獨家權益�。
2.益方KRAS G12C抑制劑報產�。益方生物1類化藥格舒瑞昔片(D-1553,Garsorasib)的上市申請獲CDE受理����,用于治療KRAS G12C突變的局部晚期或轉移性非小細胞肺癌��。在I/II期研究中��,D-1553確認的客觀緩解率(ORR)為40.5%�,疾病控制率(DCR)為91.9%�����,無進展生存期(PFS)達到8.2個月�����。正大天晴擁有該新藥在中國大陸地區(qū)的獨占性開發(fā)����、注冊、生產和商業(yè)化權益��。
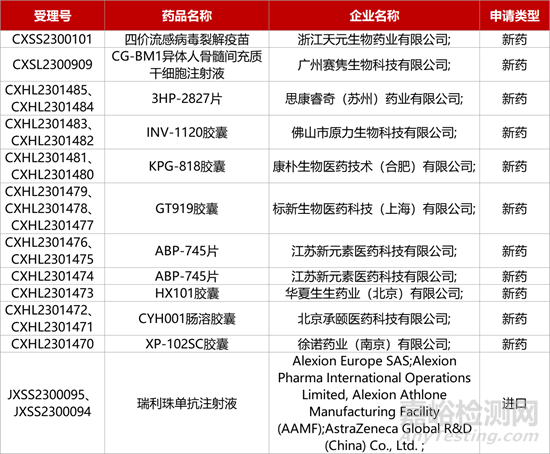
3.AZ長效C5補體抑制劑中國報產�。阿斯利康補體C5抑制劑瑞利珠單抗注射液(ravulizumab,Ultomiris)的上市申請獲CDE受理�。該新藥目前正在中國開展III期研究評估用于預防體外心肺循環(huán)時慢性腎病患者的嚴重腎臟不良事件的效果。在美國�,該藥已獲批治療多種自身免疫性疾病��,包括陣發(fā)性睡眠性血紅蛋白尿�、非典型溶血尿毒綜合征以及全身型重癥肌無力�����。
4.禮來口服GLP-1R激動劑啟動降糖III期研究�����。禮來GLP-1R小分子激動劑orforglipron(LY3502970)登記啟動一項III期ACHIEVE-2研究���,評估orforglipron與達格列凈相比�,用于血糖控制不佳的2型糖尿病患者的有效性和安全性�����。該項試驗主要研究者由上海市第六人民醫(yī)院醫(yī)學博士賈偉平和于浩泳共同擔任����。II期研究(NCT05048719)26周數(shù)據(jù)顯示,orforglipron組受試者A1c平均降幅高達2.1%�,而安慰劑組和度拉糖肽組這一數(shù)值分別為0.4%和1.1%。
5.三葉草促血小板生成劑早期臨床積極���。三葉草生物1類新藥SCB-219M在I期臨床中獲積極結果�����。SCB-219M 是一款創(chuàng)新型包含血小板生成素受體激動劑(TPO-RA)模肽的雙特異性Fc融合蛋白靶向藥物����,用于腫瘤患者化療引起的血小板減少癥 (CIT) ����。初步數(shù)據(jù)顯示,SCB-219M給藥一周后��,所有受試者均觀察到血小板計數(shù)可保持或恢復到大于75x109/L(CIT警戒線)��,且療效持續(xù)長達三周����;此外,藥物耐受性良好�����。
6.康德賽巨噬細胞療法報肝硬化IND���。四川康德賽1類生物制品“CUD005注射液”的臨床試驗申請獲CDE受理���。CUD005是一種巨噬細胞療法���,可以通過分泌多種基質金屬蛋白酶(MMPs)來有效降解胞外基質,減少肝臟瘢痕淤積���,同時通過釋放抗炎因子(IL-1RN等)來抑制炎癥反應的發(fā)生�����,以改善肝臟炎癥微環(huán)境���,減緩病情發(fā)展。該新藥擬開發(fā)用于治療中晚期肝硬化�����。
7.上海健信兩款雙抗報新IND��。上海健信生物兩款1類生物制品注射用LB4330(Bis2)和注射用重組抗PD1/TIM3人源化雙特異抗體(Bis5�����,LB1410)的臨床試驗申請同日獲得CDE受理。Bis2是一款靶向腫瘤CD8+T細胞和CLDN18.2的雙功能免疫治療產品���;Bis5是一款針對PD-1治療無效和耐藥病人的產品。Bis5和Bis2目前均已在中美兩地同步臨床開發(fā), 并已經完成Ⅰ期劑量爬坡�。
國際藥訊
1.首款自體TIL療法2024年初有望獲批。Iovance公司腫瘤浸潤淋巴細胞(TIL)療法Lifileucel用于治療晚期黑色素瘤的生物制劑許可申請(BLA)即將在2月24日獲得FDA最終審批結果�����。去年FDA由于自身的資源限制��,將Lifileucel的優(yōu)先審查PDUFA日期由11月25日延長了3個月����。在II期C-144-01研究中,Lifileucel的客觀緩解率(ORR)達到31.4%��;有41.7%的緩解持續(xù)時間≥18個月���。Lifileucel有望成為首款獲FDA批準用于這類患者的全新的治療方法���。
2.阿斯利康ATTR抗體啟動Ⅲ期臨床。阿斯利康旗下Alexion公司在Clinicaltrials.gov網站上注冊ATTR抗體ALXN2220(NI006)一項Ⅲ期臨床�����,擬評估用于治療轉甲狀腺素蛋白淀粉樣心肌病(ATTR-CM)的有效性與安全性。NI006旨在特異性靶向錯誤折疊的轉甲狀腺素蛋白����,以清除心臟中的淀粉樣纖維沉積物。12個月治療數(shù)據(jù)顯示�����,NI006顯著減少患者心臟淀粉樣蛋白沉積����;未觀察到明顯的劑量限制性毒性或與藥物相關的嚴重不良反應。
3.ROR1 CAR-T療法早期臨床出現(xiàn)患者死亡����。Oncternal公司ROR1靶向自體CAR-T療法ONCT-808治療復發(fā)或難治性侵襲性B細胞淋巴瘤的I/II期ONCT-808-101研究出現(xiàn)5級(致命)嚴重不良事件。在ONCT-808(1x10^6)初始劑量下����,3例患者中有2例獲得完全代謝緩解(CMR),1例獲得部分緩解(PR)����。但首例接受第二劑ONCT-808(3x10^6)治療后��,患者由于胞因子釋放綜合征(CRS)和神經毒性綜合征(ICANS)導致死亡����。
4.新型減肥膠囊臨床前研究積極�����。來自麻省理工學院�、哈佛醫(yī)學院和劍橋大學的研究團隊開發(fā)的可以在胃內震動的可服用新型減肥膠囊藥物��,能通過振動調節(jié)胃部拉伸感受器來刺激迷走神經向大腦發(fā)送信號�,改變與食欲有關的激素水平,從而讓胃產生強烈的飽腹感����。動物實驗顯示,在進食前20分鐘服用可使動物的進食量比平時減少約40%�,而且未檢出任何副作用,膠囊在四五天內就能通過消化道排出體外���。研究成果近日發(fā)表于《科學進展》上����。
5.口服環(huán)肽藥物臨床前研究積極。瑞士洛桑聯(lián)邦理工學院科學家開發(fā)的靶向凝血酶的口服環(huán)肽藥物的臨床前研究成果近日發(fā)表于《自然·化學生物學》雜志上���。研究人員開發(fā)了一種兩步合成策略�,以合成大量具有硫醚鍵的環(huán)肽���,提高了這些環(huán)肽在口服時的代謝穩(wěn)定性�。在大鼠身上測試時����,口服肽藥物生物利用度高達18%,有望為一系列疾病提供新的治療選擇���。
6.張鋒學生創(chuàng)辦的基因編輯公司獲15億融資���。Tome Biosciences公司宣布完成2.13億美元的A輪和B輪融資(約15億人民幣),用于推進其程序化基因組整合(PGI)的新型基因編輯技術,用于精確插入任何大小的DNA序列到目標基因組位置���,以開發(fā)能夠在體內糾正基因的針對單基因肝病和自身免疫疾病的細胞療法�。該公司的聯(lián)合創(chuàng)始人Omar Abudayyeh博士和Jonathan Gootenberg博士二人曾是CRISPR基因編輯先驅張鋒教授的研究生���,現(xiàn)為麻省理工學院(MIT)的研究員��。
醫(yī)藥熱點
1.上海交通大學醫(yī)學院附屬松江醫(yī)院揭牌�。12月28日上午,上海交通大學醫(yī)學院附屬松江醫(yī)院揭牌儀式舉行��。上海交通大學醫(yī)學院附屬松江醫(yī)院將充分發(fā)揮“區(qū)校共建���、院校融合”體制機制優(yōu)勢�,全面提升松江區(qū)醫(yī)療衛(wèi)生整體水平��,加快推進長三角一體化國家戰(zhàn)略����,為教育強國�����、科技強國�、人才強國、健康中國貢獻力量�����。
2.潘峰任首都醫(yī)科大學附屬北京地壇醫(yī)院黨委書記。據(jù)首都醫(yī)科大學附屬北京地壇醫(yī)院官網顯示��,潘峰已任地壇醫(yī)院黨委書記��。根據(jù)公開信息�����,潘峰�����,男�����,漢族��,1977年生��,中共黨員�����,碩士研究生�,副研究員����。此前�����,潘峰曾任北京市醫(yī)院管理局辦公室副主任�����、首都醫(yī)科大學附屬北京友誼醫(yī)院副院長�����、北京市醫(yī)院管理中心辦公室主任�。
3.浙江全省統(tǒng)一特殊病種目錄。近日�,浙江省醫(yī)保局下發(fā)《關于統(tǒng)一基本醫(yī)療保險門診特殊病種范圍的通知》�����,就統(tǒng)一特殊病種范圍有關事項做出安排��?��!锻ㄖ凤@示��,浙江將在省級層面統(tǒng)一病種范圍�����,在各統(tǒng)籌地區(qū)現(xiàn)有特殊病種范圍中�����,先行將惡性腫瘤等16種費用負擔較重����、適合在門診治療、比住院更經濟方便的特殊疾病���,納入第一批省特殊病種范圍��。自2024年1月20日起施行��。
評審動態(tài)
1. CDE新藥受理情況(12月30日)
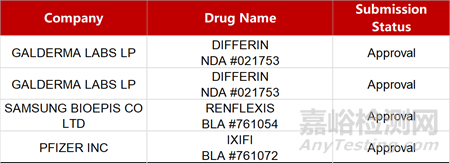
2. FDA新藥獲批情況(北美12月27日)