無(wú)菌藥品作為高風(fēng)險(xiǎn)產(chǎn)品��,生產(chǎn)過(guò)程和質(zhì)量控制具有復(fù)雜性和特殊性��,歐盟《人用和獸用藥品生產(chǎn)質(zhì)量管理規(guī)范指南》附錄1“無(wú)菌藥品生產(chǎn)”(歐盟GMP附錄1) 的發(fā)布對(duì)全球無(wú)菌藥品的質(zhì)量管理產(chǎn)生了巨大影響���。為了解國(guó)際無(wú)菌藥品生產(chǎn)質(zhì)量管理的最新發(fā)展趨勢(shì)與要求�����,把握我國(guó)無(wú)菌藥品質(zhì)量管理的現(xiàn)狀���,促進(jìn)我國(guó)無(wú)菌藥品質(zhì)量提升,本文對(duì)歐盟與我國(guó)《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)》附錄1“無(wú)菌藥品”(中國(guó)GMP附錄1) 的主要差異點(diǎn)進(jìn)行了分析和探討�����,為我國(guó)GMP 附錄1的修訂和無(wú)菌藥品生產(chǎn)企業(yè)質(zhì)量提升提供參考��。
歐盟《人用和獸用藥品生產(chǎn)質(zhì)量管理規(guī)范指南》附錄1“無(wú)菌藥品生產(chǎn)”(以下簡(jiǎn)稱“歐盟GMP附錄1”) 于2022年8月25日正式發(fā)布���,這是歐盟2015年發(fā)布對(duì)無(wú)菌藥品附錄修訂的概念文件草案后歷經(jīng)7年最終修訂完成的[1]�����。該附錄要求的最后實(shí)施期限是2023年8月25日���,需要指出的是,附錄中的第8.123條“凍干機(jī)和相關(guān)產(chǎn)品轉(zhuǎn)移和裝載/卸載區(qū)域應(yīng)經(jīng)過(guò)設(shè)計(jì)���,盡可能減少操作人員的干預(yù)”的最后實(shí)施期限為2024年8月25日�����。歐盟GMP附錄1首次頒布是在1971年��,之后經(jīng)過(guò)多次修訂��,上一次修訂是2008年�����,該版本是與我國(guó)現(xiàn)行《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂) 》的附錄1“無(wú)菌藥品”(以下簡(jiǎn)稱“中國(guó)GMP附錄1”) 內(nèi)容較為接近的版本[2-3]�����。
本次歐盟GMP附錄1修訂版從覆蓋范圍�����、章節(jié)以及內(nèi)容都有非常大的調(diào)整�����,為首次全面修訂���。該附錄規(guī)定了無(wú)菌藥品生產(chǎn)質(zhì)量控制的基本原則��,詳細(xì)說(shuō)明了對(duì)無(wú)菌藥品生產(chǎn)企業(yè)質(zhì)量體系的要求��,應(yīng)“確保所有活動(dòng)得到有效控制��,以盡可能減少無(wú)菌產(chǎn)品中的微生物��、微粒和內(nèi)毒素/熱原污染風(fēng)險(xiǎn)”���,明確了潔凈廠房、設(shè)備���、人員���、生產(chǎn)等方面的具體要求[4]。我國(guó)GMP附錄1自2010年至今已有13年未修訂��,難以滿足當(dāng)今無(wú)菌藥品GMP管理的要求��。
2022年版歐盟GMP附錄1是由世界衛(wèi)生組織(WHO) ���、歐洲藥品管理(EMA) 和國(guó)際藥品檢查合作組織(PIC/S) 聯(lián)合起草��,有利于全球標(biāo)準(zhǔn)的協(xié)調(diào)一致��,也將對(duì)我國(guó)制藥工業(yè)的發(fā)展產(chǎn)生積極而又深遠(yuǎn)的影響���。學(xué)習(xí)��、研究和有效轉(zhuǎn)化應(yīng)用這一附錄�����,將對(duì)我國(guó)制藥工業(yè)創(chuàng)新發(fā)展和建立國(guó)際化競(jìng)爭(zhēng)優(yōu)勢(shì)發(fā)揮重要促進(jìn)作用��。
為了解國(guó)際無(wú)菌藥品生產(chǎn)質(zhì)量管理的最新發(fā)展趨勢(shì)與要求��,把握我國(guó)無(wú)菌藥品質(zhì)量管理的現(xiàn)狀��,促進(jìn)我國(guó)無(wú)菌藥品質(zhì)量提升���,本文對(duì)比分析了歐盟與我國(guó)GMP附錄1的主要差異點(diǎn)���,以期為我國(guó)GMP附錄1的修訂和我國(guó)無(wú)菌藥品生產(chǎn)企業(yè)質(zhì)量提升提供參考���。
1��、整體性差異
2022年版歐盟GMP附錄1共11章���, 295條,包括范圍���、原則��、藥品質(zhì)量體系���、廠房、設(shè)備��、公用設(shè)施���、人員��、生產(chǎn)和具體技術(shù)��、環(huán)境監(jiān)測(cè)和工藝監(jiān)測(cè)���、質(zhì)量控制、術(shù)語(yǔ)等[5-6]��。中國(guó)GMP附錄1共15章,81條���,包括范圍�����、原則���、潔凈度級(jí)別及監(jiān)測(cè)、隔離操作技術(shù)�����、吹灌封技術(shù)��、人員�����、廠房�����、設(shè)備�����、消毒�����、生產(chǎn)管理�����、滅菌工藝���、滅菌方法���、無(wú)菌藥品的最終處理、質(zhì)量控制��、術(shù)語(yǔ)等�����。
2008年版歐盟GMP附錄1僅有17頁(yè)126條���,而2022年版則長(zhǎng)達(dá)59頁(yè)��。2022年版本引入了范圍���、藥品質(zhì)量體系(pharmaceutical quality system���,PQS) 、公用設(shè)施�����、環(huán)境和過(guò)程監(jiān)測(cè)���、術(shù)語(yǔ)表等新的章節(jié)���,同時(shí)加強(qiáng)了質(zhì)量風(fēng)險(xiǎn)管理、污染控制策略�����、新技術(shù)和新工藝等結(jié)構(gòu)化內(nèi)容的指導(dǎo)���,在內(nèi)容上有了大幅增加�����,各項(xiàng)規(guī)定更加翔實(shí)和具體���。2022年版文件還包含一些中國(guó)GMP附錄1沒(méi)有規(guī)定的內(nèi)容,如:污染控制策略�����、藥品質(zhì)量體系��、公用設(shè)施��、生產(chǎn)和具體技術(shù)(成型-灌裝-密封技術(shù)��、凍干��、密閉系統(tǒng)���、一次性系統(tǒng)) 等���。各版本無(wú)菌藥品附錄整體性差異對(duì)比詳見(jiàn)表1。
表1 歐盟與我國(guó)GMP無(wú)菌藥品附錄整體性差異對(duì)比
2��、差異分析
歐盟與中國(guó)GMP附錄1最主要的差異集中在歐盟附錄1的拓展了適用范圍,明確了新的概念(如質(zhì)量風(fēng)險(xiǎn)管理�����、污染控制策略��、藥品質(zhì)量體系等) ���,強(qiáng)調(diào)了新的技術(shù)(如屏障技術(shù)) ��,提高了部分技術(shù)標(biāo)準(zhǔn)(如氣流流型測(cè)試�����、過(guò)濾器完整性測(cè)試等)�����,本部分對(duì)兩者的主要差異點(diǎn)進(jìn)行分析��。
2.1 無(wú)菌藥品與無(wú)菌產(chǎn)品
2022年版歐盟GMP附錄1在范圍章節(jié)中規(guī)定“無(wú)菌產(chǎn)品的生產(chǎn)涵蓋多種無(wú)菌產(chǎn)品類型(原料藥���,輔料,內(nèi)包裝材料和成品制劑) �����,包裝規(guī)格(從單劑量到多劑量〉,工藝(從高度自動(dòng)化系統(tǒng)到手動(dòng)工藝) 和技術(shù)(如生物技術(shù)��,傳統(tǒng)小分子生產(chǎn)系統(tǒng)和密閉系統(tǒng)) ”���。中國(guó)GMP附錄1中規(guī)定“無(wú)菌藥品是指法定藥品標(biāo)準(zhǔn)中列有無(wú)菌檢查項(xiàng)目的制劑和原料藥,包括無(wú)菌制劑和無(wú)菌原料藥”���。歐盟GMP附錄1在適用范圍方面從無(wú)菌藥品拓展到無(wú)菌產(chǎn)品���,除適用于藥品外還適用于輔料、內(nèi)包裝材料等產(chǎn)品��。
2.2 質(zhì)量風(fēng)險(xiǎn)管理(QRM) 和污染控制策略(CCS)
2022年版歐盟GMP附錄1范圍和通則章節(jié)中提出了無(wú)菌產(chǎn)品生產(chǎn)中的質(zhì)量風(fēng)險(xiǎn)管理(quality risk management�����,QRM)和污染控制策略(contamination control strategy���,CCS) 這兩個(gè)在中國(guó)GMP 附錄1中沒(méi)有涉及的概念��。QRM的原則在第一章“范圍”和第二章“原則”中均有描述�����。QRM作為一種識(shí)別���、科學(xué)評(píng)估及控制質(zhì)量潛在風(fēng)險(xiǎn)的前瞻性方法�����,應(yīng)貫穿無(wú)菌藥品生產(chǎn)全過(guò)程���,包括設(shè)施、設(shè)備���、系統(tǒng)和規(guī)程的設(shè)計(jì)和控制的過(guò)程�����。CCS是指針對(duì)微生物�����、內(nèi)毒素/熱原和微粒的一系列有計(jì)劃的控制措施��,源于現(xiàn)有產(chǎn)品和工藝的理解并確保工藝性能和產(chǎn)品質(zhì)量���。CCS的控制措施可包括: 原料藥和制劑的物料和組分相關(guān)的參數(shù)和屬性��、廠房設(shè)施設(shè)備的操作條件��、中間過(guò)程控制��、成品質(zhì)量標(biāo)準(zhǔn)以及相關(guān)方法和監(jiān)控頻次等��。CCS是本次附錄修訂新提出的概念�����,在第二章“原則”中進(jìn)行了重點(diǎn)闡述,全文出現(xiàn)多次�����,明確需要在整個(gè)生產(chǎn)過(guò)程和所有關(guān)鍵控制點(diǎn)建立這一概念的原則���。從現(xiàn)狀來(lái)看���,藥品生產(chǎn)企業(yè)制訂的文件中已經(jīng)包含了許多CCS要素,但沒(méi)有形成系統(tǒng)化的文件���,歐盟GMP 附錄1 要求CCS應(yīng)為一個(gè)多元素�����、正式記錄的文件��。CCS概念的提出說(shuō)明對(duì)無(wú)菌產(chǎn)品生產(chǎn)污染的控制需要全生命周期的管理: 從項(xiàng)目的需求分析入手識(shí)別各維度污染風(fēng)險(xiǎn); 設(shè)計(jì)污染控制策略�����、配套控制措施來(lái)控制風(fēng)險(xiǎn)���;在生產(chǎn)過(guò)程中進(jìn)行污染的控制應(yīng)對(duì)及做好日常監(jiān)測(cè); 定期回顧評(píng)價(jià)污染控制策略的準(zhǔn)確性和適應(yīng)性�����,及時(shí)進(jìn)行動(dòng)態(tài)調(diào)整修正��。
2.3 藥品質(zhì)量體系(PQS)
2022年版歐盟GMP附錄1 使用一個(gè)章節(jié)的篇幅(第3章藥品質(zhì)量體系) 強(qiáng)調(diào)適用于無(wú)菌產(chǎn)品的PQS的具體要求�����。中國(guó)GMP在總則中規(guī)定企業(yè)應(yīng)當(dāng)建立藥品質(zhì)量管理體系��,在附錄1中未針對(duì)無(wú)菌藥品提出藥品質(zhì)量體系的具體要求��。歐盟GMP 附錄1強(qiáng)調(diào)了無(wú)菌藥品生產(chǎn)的PQS應(yīng)確保產(chǎn)品全生命周期的風(fēng)險(xiǎn)管理���,對(duì)生產(chǎn)商�����、高層管理人員��、負(fù)責(zé)無(wú)菌產(chǎn)品認(rèn)證/放行的人員提出了具體要求�����,要對(duì)失敗進(jìn)行根本原因分析�����、CCS的開(kāi)發(fā)和維護(hù)中施用風(fēng)險(xiǎn)管理,涉及的最終處理�����、貯存和運(yùn)輸相關(guān)過(guò)程不應(yīng)影響產(chǎn)品無(wú)菌��、應(yīng)在批次放行之前充分調(diào)查所有不合格等�����。
2.4 屏障技術(shù)
2022年版歐盟GMP附錄1第四章“廠房”的“屏障技術(shù)”介紹了隔離器(isolator) 和限制進(jìn)出隔離系統(tǒng)(restricted access barrier system,RABS) 兩種技術(shù)��,并明確兩者是不同的技術(shù)���。歐盟GMP規(guī)定隔離器“內(nèi)部工作區(qū)符合A級(jí)條件”��,中國(guó)GMP規(guī)定隔離操作器內(nèi)部環(huán)境為“B級(jí)(ISO 5級(jí)) 或更高潔凈度級(jí)別”��,兩者對(duì)內(nèi)部環(huán)境級(jí)別要求存在差異��。歐盟GMP附錄1明確RABS技術(shù)為“提供一個(gè)封閉但未完全密封��、符合規(guī)定的空氣質(zhì)量條件的環(huán)境(對(duì)于無(wú)菌工藝為A級(jí)) 并使用剛性外殼和一體式手套使內(nèi)部與周圍潔凈室環(huán)境隔開(kāi)的系統(tǒng)”���,中國(guó)GMP附錄1并未涉及RABS的相關(guān)規(guī)定。此外歐盟GMP附錄1對(duì)隔離器和RABS手套的滅菌��、完整性測(cè)試頻次進(jìn)行了明確的規(guī)定�����,要求更為嚴(yán)格���。隔離器和RABS技術(shù)在無(wú)菌藥品的生產(chǎn)中應(yīng)用廣泛���,歐盟GMP對(duì)屏障技術(shù)的規(guī)定有利于促進(jìn)屏障技術(shù)的規(guī)范應(yīng)用���,降低技術(shù)應(yīng)用中的無(wú)菌風(fēng)險(xiǎn)。
2.5 潔凈室環(huán)境確認(rèn)與監(jiān)測(cè)
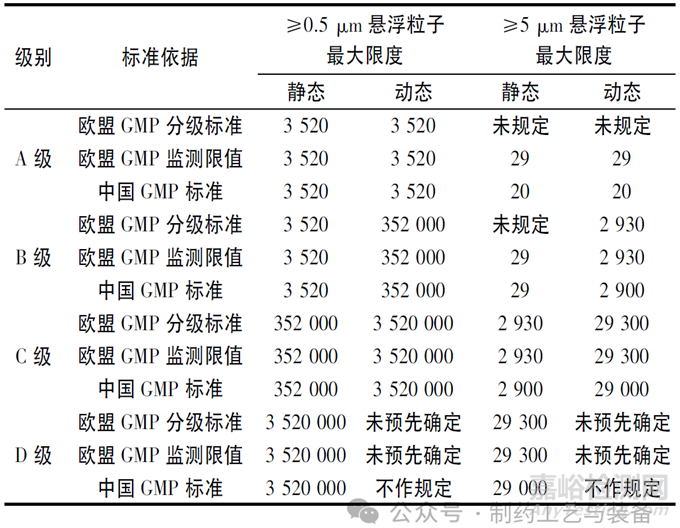
2022年版歐盟GMP附錄1將潔凈室確認(rèn)(包括分級(jí)) 與動(dòng)態(tài)環(huán)境監(jiān)測(cè)明確區(qū)別開(kāi)來(lái)���,潔凈室確認(rèn)標(biāo)準(zhǔn)在第四章“廠房”中進(jìn)行了規(guī)定���,環(huán)境監(jiān)測(cè)標(biāo)準(zhǔn)在第九章“環(huán)境監(jiān)測(cè)和工藝監(jiān)測(cè)”中進(jìn)行了規(guī)定。潔凈室確認(rèn)包含潔凈室分級(jí)��、微生物污染水平確認(rèn)等�����,潔凈室分級(jí)的主要依據(jù)是空氣懸浮粒子標(biāo)準(zhǔn)���。中國(guó)GMP附錄1未區(qū)分潔凈室確認(rèn)(分級(jí)) 標(biāo)準(zhǔn)和環(huán)境監(jiān)測(cè)標(biāo)準(zhǔn)[7]。
在空氣懸浮粒子方面���,歐盟GMP分級(jí)標(biāo)準(zhǔn)未規(guī)定≥5 μm懸浮粒子的A靜態(tài)和動(dòng)態(tài)標(biāo)準(zhǔn)以及B級(jí)靜態(tài)標(biāo)準(zhǔn)���,歐盟GMP環(huán)境監(jiān)測(cè)限值規(guī)定≥5 μm懸浮粒子的A靜態(tài)和動(dòng)態(tài)現(xiàn)值為29個(gè)/立方米���,中國(guó)GMP規(guī)定≥5 μm懸浮粒子的A靜態(tài)和動(dòng)態(tài)標(biāo)準(zhǔn)為20個(gè)/立方米,這一點(diǎn)比歐盟GMP更為嚴(yán)格��。D級(jí)環(huán)境的動(dòng)態(tài)懸浮粒子標(biāo)準(zhǔn)中國(guó)GMP為“不作規(guī)定”���,歐盟GMP為“未預(yù)先確定”���,要求生產(chǎn)商根據(jù)風(fēng)險(xiǎn)評(píng)估和適用的常規(guī)數(shù)據(jù)建立動(dòng)態(tài)限度,標(biāo)準(zhǔn)制定更加科學(xué)�����。歐盟與中國(guó)GMP各級(jí)別空氣懸浮粒子標(biāo)準(zhǔn)對(duì)比見(jiàn)表2��。
表2 歐盟與中國(guó)GMP各級(jí)別空氣懸浮粒子標(biāo)準(zhǔn)對(duì)比(單位: 每立方米)
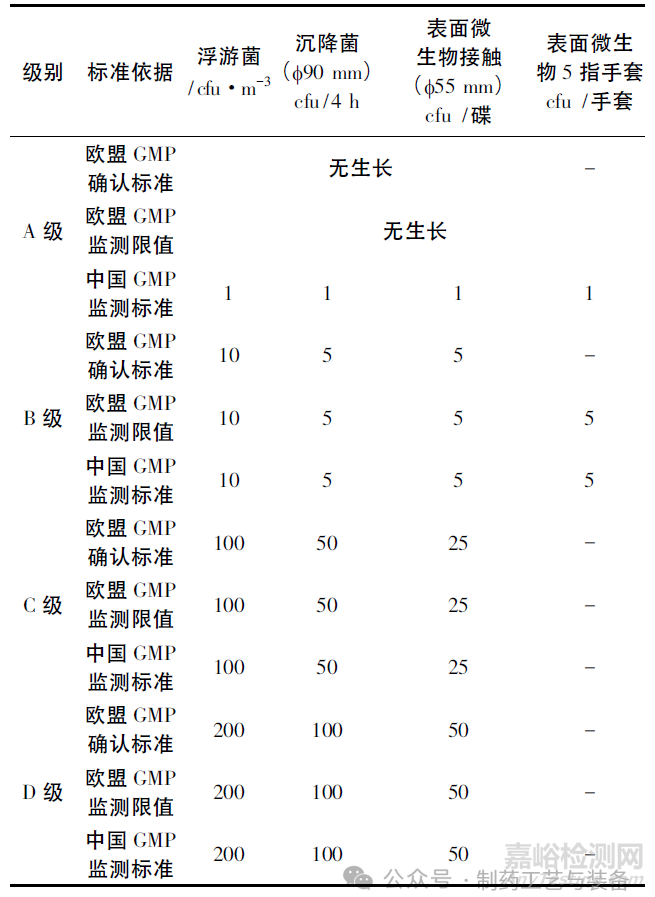
在微生物限度方面�����,在中國(guó)GMP 附錄1僅規(guī)定在動(dòng)態(tài)環(huán)境監(jiān)測(cè)中進(jìn)行微生物監(jiān)測(cè)���,歐盟GMP 附錄1要求在潔凈室確認(rèn)以及環(huán)境監(jiān)測(cè)中均需要進(jìn)行微生物監(jiān)測(cè)���。中國(guó)GMP規(guī)定A級(jí)的微生物監(jiān)測(cè)的標(biāo)準(zhǔn)為<1 cfu�����,此標(biāo)準(zhǔn)在執(zhí)行過(guò)程中存在如果環(huán)境監(jiān)測(cè)有微生物生產(chǎn)�����,但監(jiān)測(cè)結(jié)果的平均值<1 cfu�����,檢測(cè)結(jié)果是否符合要求的爭(zhēng)議; 歐盟GMP將A級(jí)微生物標(biāo)準(zhǔn)修訂為“無(wú)生產(chǎn)”��,消除了標(biāo)準(zhǔn)的異議��。歐盟與中國(guó)GMP各級(jí)別環(huán)境微生物限度標(biāo)準(zhǔn)對(duì)比見(jiàn)表3�����。
表3 歐盟與中國(guó)GMP各級(jí)別環(huán)境微生物標(biāo)準(zhǔn)對(duì)比
2.6 氣流流型測(cè)試
歐盟GMP 附錄1第四章對(duì)氣流流型提出了較高的要求�����,條款“4.4”規(guī)定“應(yīng)證明并確認(rèn)整個(gè)A級(jí)區(qū)的單向流維護(hù)狀態(tài)”�����,這就要求A級(jí)區(qū)域單向流的測(cè)試不能只測(cè)試某個(gè)位置�����,而應(yīng)該證明整個(gè)A級(jí)區(qū)域內(nèi)部的單向流是符合要求的�����。條款“4.15”規(guī)定“應(yīng)該對(duì)潔凈區(qū)和潔凈室的氣流流型進(jìn)行可視化研究�����,證明空氣沒(méi)有從較低級(jí)別區(qū)域進(jìn)入到較高級(jí)別區(qū)域��,并且空氣不會(huì)從不太潔凈的區(qū)域(例如地板) 或經(jīng)過(guò)可能轉(zhuǎn)移污染的操作員或設(shè)備跨越到較高級(jí)別的區(qū)域”���,這就要求氣流流型測(cè)試不限于A級(jí)區(qū)域,不同級(jí)別潔凈區(qū)域間均需要測(cè)試���,而且測(cè)試應(yīng)包含靜態(tài)和動(dòng)態(tài)條件���。中國(guó)GMP附錄1僅規(guī)定“應(yīng)當(dāng)能夠證明所用氣流方式不會(huì)導(dǎo)致污染風(fēng)險(xiǎn)并有記錄(如煙霧試驗(yàn)的錄像) ”���,對(duì)具體測(cè)試要求未進(jìn)行詳細(xì)規(guī)定。
2.7 液體過(guò)濾器的完整性測(cè)試
歐盟GMP附錄1條款8.87規(guī)定“應(yīng)在使用前通過(guò)完整性測(cè)試(preuse post sterilization integrity test���,PUPSIT) 確認(rèn)無(wú)菌過(guò)濾器組件的完整性�����,以檢查由于使用前過(guò)濾器準(zhǔn)備造成的損壞和完整性損失”“對(duì)液體進(jìn)行除菌的除菌級(jí)過(guò)濾器��,在使用后將濾器從殼體中取出之前應(yīng)進(jìn)行非破壞性的完整性測(cè)試”��。使用前滅菌后的完整性測(cè)試(PUPSIT) 要求非常高���,需要避免檢測(cè)時(shí)對(duì)已滅菌的過(guò)濾器系統(tǒng)造成二次污染。現(xiàn)行中國(guó)GMP 附錄1對(duì)于液體過(guò)濾器的完整性檢測(cè)要求為“除菌過(guò)濾器使用后��,必須采用適當(dāng)?shù)姆椒⒓磳?duì)其完整性進(jìn)行檢查并記錄”���,未對(duì)PUPSIT提出要求[8-9]�����。
3���、討論
修訂后的2022年版歐盟GMP 附錄1要求更加嚴(yán)格、內(nèi)容更加全面�����、條款描述更加細(xì)致��。
①適用范圍從“無(wú)菌藥品”放大到“無(wú)菌產(chǎn)品”�����,涵蓋了無(wú)菌原料��、輔料���、內(nèi)包裝材料以及最終成品制劑���,強(qiáng)調(diào)無(wú)菌產(chǎn)品管理的目標(biāo)不僅僅是微生物,還包括微粒和內(nèi)毒素/熱原污染;
②引入了CCS的新概念�����,強(qiáng)調(diào)了QMS、PQS 等理念;
③對(duì)無(wú)菌生產(chǎn)的具體技術(shù)�����,如屏障技術(shù)(包括隔離器和RABS) ���、FFS�����、密閉系統(tǒng)�����、SUS等���,進(jìn)行了詳細(xì)規(guī)定,同時(shí)引入了快速轉(zhuǎn)移系統(tǒng)��、機(jī)器人��、快速微生物測(cè)試等新技術(shù);
④將潔凈室確認(rèn)分級(jí)與動(dòng)態(tài)環(huán)境監(jiān)測(cè)區(qū)別開(kāi)來(lái)��,各級(jí)別懸浮粒子和微生物標(biāo)準(zhǔn)設(shè)定更加科學(xué);
⑤部分內(nèi)容要求比我國(guó)GMP更加嚴(yán)格�����,如氣流流型測(cè)試范圍、液體除菌過(guò)濾器強(qiáng)調(diào)使用前滅菌后完整性測(cè)試(PUPSIT) 等��。我國(guó)GMP 附錄1的基本涵蓋了無(wú)菌藥品生產(chǎn)的關(guān)鍵要素��,但尚未明確PQS�����、CCS等理念�����,缺乏對(duì)RABS���、FFS、SUS等無(wú)菌生產(chǎn)技術(shù)的規(guī)定��。從無(wú)菌藥品生產(chǎn)理念和無(wú)菌藥品生產(chǎn)技術(shù)進(jìn)步的角度來(lái)看���,我國(guó)GMP 附錄1的修訂有其必要性�����。2022年9月�����,PIC/S根據(jù)已經(jīng)發(fā)布的2022年版歐盟GMP附錄1發(fā)布了自己的GMP指南附錄1��,而中國(guó)已經(jīng)在2021年提出加入PIC/S的申請(qǐng)�����,可以預(yù)見(jiàn)歐盟GMP附錄1 對(duì)中國(guó)制藥行業(yè)的影響也會(huì)不斷增強(qiáng)[10-11]��。在國(guó)際無(wú)菌藥品法規(guī)相互協(xié)同一致的背景下��,我國(guó)監(jiān)管部門(mén)和無(wú)菌藥品生產(chǎn)企業(yè)要加快對(duì)歐盟GMP附錄1的研究和轉(zhuǎn)化�����,及時(shí)修訂我國(guó)GMP附錄1���,促進(jìn)我國(guó)無(wú)菌藥品質(zhì)量提升��,建立國(guó)際化競(jìng)爭(zhēng)優(yōu)勢(shì)���。
參考文獻(xiàn)
[1] EU.Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use��,Annex1: Manufacture of Sterile Medicinal Products[EB/OL].[2022- 08 - 25]. https: / /health. ec. europa. eu /system/files /2022-08 /20220825_gmp-an1_en_0.pdf
[2] EU.Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use�����,Annex1: Manufacture of Sterile Medicinal Products (corrected version) [EB/OL].[2008 - 12 - 15]. https: / /health. ec.europa.eu /system/files /2016-11 /2008_11_25_gmp-an1_en_0.pdf.
[3] 國(guó)家食品藥品監(jiān)督管理局.關(guān)于發(fā)布《藥品生產(chǎn)質(zhì)量管理規(guī)范( 2010 年修訂) 》無(wú)菌藥品等5個(gè)附錄的公告[EB/OL].[2011 - 02 - 24]. https: / /www. nmpa. gov.cn /xxgk /ggtg /qtggtg /20110224164501312.html
[4] 鄭金旺.2020 版歐盟GMP 附錄1 草案的主要變化解讀及對(duì)國(guó)內(nèi)無(wú)菌產(chǎn)品生產(chǎn)的影響分析[J].化工與醫(yī)藥工程�����,2020�����,41(2) : 65-70.
[5] 曹鴻雁,韓瑩�����,胡敬峰.山東省無(wú)菌制劑生產(chǎn)質(zhì)量風(fēng)險(xiǎn)分析與探討[J].中國(guó)藥事���,2018���,32(7) : 901-905.
[6] 國(guó)家食品藥品監(jiān)督管理局藥品認(rèn)證管理中心. 藥品GMP 指南: 無(wú)菌藥品[M]. 北京: 中國(guó)醫(yī)藥科技出版社,2011: 118-123.
[7] 任杏珠.醫(yī)藥潔凈廠房空調(diào)系統(tǒng)確認(rèn)和環(huán)境監(jiān)測(cè)取樣點(diǎn)選取探討[J].煤炭與化工���,2022��,45(1) : 144-150.
[8] 國(guó)家藥品監(jiān)督管理局.國(guó)家藥品監(jiān)督管理局關(guān)于發(fā)布除菌過(guò)濾技術(shù)及應(yīng)用指南等3個(gè)指南的通告[EB/OL].[2018 - 09 - 11]. https: / /www. nmpa. gov. cn /ylqx /ylqxggtg /ylqxqtgg /20180911170301439.html.
[9] 胡敬峰�����,許丹��,韓瑩.除菌過(guò)濾技術(shù)在藥品生產(chǎn)應(yīng)用中存在的問(wèn)題與對(duì)策[J].中國(guó)藥事��,2020��,34(12) : 1-5.
[10] PIC/S.Revised Annex 1 Manufacture of Sterile Medicinal Products[EB/OL].[2022- 09- 09]. https: / /picscheme.org /docview/4737.
[11] 國(guó)家藥品監(jiān)督管理局.國(guó)家藥監(jiān)局研究推進(jìn)加入PIC/S工作[EB/OL].[2022 - 06 - 29]. https: / /www. nmpa.gov.cn /yaopin /ypjgdt /20220629093952150.html.
Critical zone – A location within the aseptic processing area in which product and critical surfaces are exposed to the environment.
關(guān)鍵區(qū):位于無(wú)菌工藝區(qū)內(nèi)的�����、產(chǎn)品和關(guān)鍵表面暴露于其中的位置��。
Critical intervention – An intervention (corrective or inherent) into the critical zone.
關(guān)鍵干預(yù):對(duì)關(guān)鍵區(qū)的干預(yù) (糾正性或固有性干預(yù))�����。
D-value – The value of a parameter of sterilisation (duration or absorbed dose) required to reduce the number of viable organisms to 10 per cent of the original number.
D 值:將活性微生物數(shù)量減少至原始數(shù)量的 10%的滅菌參數(shù)值 (持續(xù)時(shí)間或吸收劑量)���。
Dead leg – Length of non-circulating pipe (where fluid may remain static) that is greater than 3 internal pipe diameters.
死角:長(zhǎng)度大于管道內(nèi)徑 3 倍的非循環(huán)管 (流體在此處可能保持靜止)�����。
Decommission – When a process, equipment or cleanroom are closed and they will not be used again.
停用:工藝�����、設(shè)備或潔凈室關(guān)閉并且將不再使用��。
Decontamination – The overall process of removal or reduction of any contaminants (chemical, waste,residue or microorganisms) from an area, object, or person. The method of decontamination used (e.g.cleaning, disinfection, sterilisation) should be chosen and validated to achieve a level of cleanliness appropriate to the intended use of the item decontaminated. See also Bio-decontamination.
凈化:消除或減少區(qū)域��、物體或人體的任何污染物 (化學(xué)物質(zhì),) 廢物,殘留物或微生物) 的綜合過(guò)程�����。所用凈化方法 (例如清潔,消毒,滅菌) 應(yīng)進(jìn)行選擇和驗(yàn)證,以達(dá)到適用于被凈化物品預(yù)期用途的潔凈水平另請(qǐng)參見(jiàn)生物凈化��。
Depyrogenation – A process designed to remove or inactivate pyrogenic material (e.g. endotoxin) to a specified minimum quantity.
除熱原:旨在將致熱物質(zhì) (例如內(nèi)毒素) 去除或滅活至規(guī)定最小量的過(guò)程�����。
Disinfection – The process by which the reduction of the number of microorganisms is achieved by the irreversible action of a product on their structure or metabolism, to a level deemed to be appropriate for a defined purpose.
消毒:通過(guò)產(chǎn)品結(jié)構(gòu)或代謝的不可逆作用,將微生物數(shù)量減少至被認(rèn)為適合某特定用途的水平的過(guò)程�����。
Endotoxin – A pyrogenic product (i.e. lipopolysaccharide) present in the Gram negative bacterial cell wall. Endotoxin can lead to reactions in patients receiving injections ranging from fever to death.
內(nèi)毒素:革蘭氏陰性細(xì)菌細(xì)胞壁中存在的致熱產(chǎn)物(即脂多糖)���。內(nèi)毒素能導(dǎo)致接受注射的患者發(fā)熱至死亡的反應(yīng)�����。
Equilibration time – Period which elapses between the attainment of the sterilisation temperature at the reference measurement point and the attainment of the sterilisation temperature at all points within the load.
平衡時(shí)間:從參考測(cè)量點(diǎn)達(dá)到滅菌溫度到負(fù)載內(nèi)所有點(diǎn)達(dá)到滅菌溫度之間的時(shí)間�����。
Extractables - Chemical entities that migrate from the surface of the process equipment, exposed to an appropriate solvent at extreme conditions, into the product or material being processed.
溶出物:當(dāng)在極端條件下暴露于適當(dāng)溶劑中��,從工藝設(shè)備表面遷移至被加工的產(chǎn)品或物料中的化學(xué)實(shí)體���。
First Air – Refers to filtered air that has not been interrupted prior to contacting exposed product and product contact surfaces with the potential to add contamination to the air prior to reaching the critical zone.
初始?xì)饬鳎褐冈诮佑|暴露的產(chǎn)品和產(chǎn)品接觸表面之前沒(méi)有被阻礙從而在到達(dá)關(guān)鍵區(qū)之前不太可能被污染的經(jīng)過(guò)過(guò)濾的氣流。
Filter Integrity test - A test to confirm that a filter (product, gas or HVAC filter) retain their retentive properties and have not been damaged during handling, installation or processing.
過(guò)濾器完整性測(cè)試:一種用以確認(rèn)過(guò)濾器(產(chǎn)品���,氣體或 HVAC 過(guò)濾器)保持其截留特性并且在處理��、安裝或加工過(guò)程中沒(méi)有被損壞的測(cè)試��。
本文作者胡敬峰�����、明奕���、王金子��、宋凱���、樊紅延、馮巧巧��,山東省食品藥品審評(píng)查驗(yàn)中心���、國(guó)家藥品監(jiān)督管理局高級(jí)研修學(xué)院�����,來(lái)源于藥學(xué)研究�����。