摘要
目的:為規(guī)范生物制品早期研發(fā)工作,提高早期研發(fā)質量管理水平提供建議��,提升生物制品的研發(fā)質量與效率。方法:匯總我國現(xiàn)行與生物制品研發(fā)質量管理相關的法規(guī)��,分析法規(guī)要求與生物制品研發(fā)現(xiàn)狀的契合度��,根據(jù)生物制品早期研發(fā)階段的特點���,概括早期研發(fā)過程中存在的研發(fā)質量管理問題���,提出解決問題的對策與建議。結果:現(xiàn)階段我國已頒布的與生物制品研發(fā)質量管理相關的法規(guī)主要涉及研發(fā)中后期����,對于早期階段的質量管理,缺少明確���、細致�、可執(zhí)行的法規(guī)文件�。生物制品早期研發(fā)過程中在組織架構/人員設置、職能劃分����、管理制度����、制度執(zhí)行與培訓����、研究資料�、物料和供應商管理以及樣品管理7個方面存在問題。結論:加強生物制品早期研發(fā)過程的研發(fā)質量管理應注意以下幾點內容:(1)建立權責明確的生物制品研發(fā)質量管理部門�;(2)建立層次分明的生物制品研發(fā)質量管理文件體系;(3)采取“縱橫交錯����、貼合實際”的原則來制定研發(fā)質量管理文件;(4)加強質量管理工具的應用����;(5)采用項目管理模式開展生物制品早期研發(fā)質量管理(6)建立與健全研發(fā)項目代碼編號管理制度,加強早期研發(fā)階段的樣品管理�;(7)建立與完善研發(fā)培訓體系。
引言
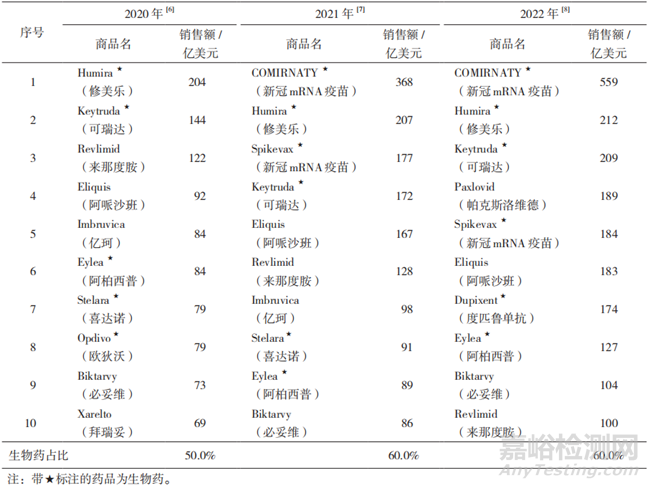
生物制品是指以微生物���、細胞����、動物或人源組織和體液等作為起始原材料����,采用生物學技術制備��,用于預防����、治療和診斷人類疾病的制劑�,如疫苗、細胞因子�、單克隆抗體、細胞與基因治療產品�����、抗毒素及抗血清等[1-3]�。與化學藥品相比,生物制品成分多樣�、結構復雜,研發(fā)難度大��,生產工藝條件要求高���,現(xiàn)有分析手段不能完全表征其分子結構與特征[4-5]�����。同時���,生物制品又具有給藥劑量低、靶向性強�����、起效迅速����、藥效顯著、安全性高��、可以通過協(xié)同或拮抗作用發(fā)揮多效性�����、半衰期短����、降解迅速等優(yōu)勢,這些優(yōu)勢都是化學藥品難以企及的�����。2020-2022年全球前十名暢銷藥品中生物制品的占比均在半數(shù)或半數(shù)以上,且排在前兩名的藥品均為生物制品(見表1)��。因此���,成功研發(fā)一款生物制品具有極大的社會與經(jīng)濟價值���。
▲表1-2020-2022 年全球暢銷藥品前十名匯總
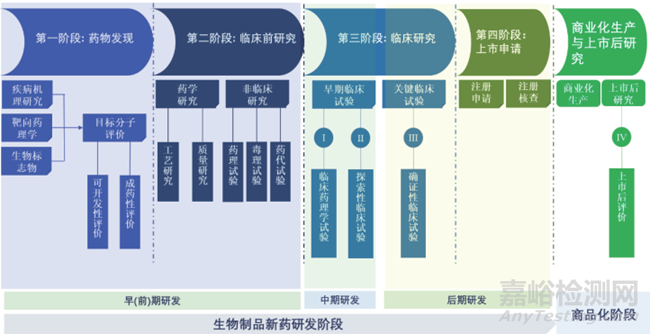
生物制品研發(fā)是一項周期長、投入大�、過程復雜、風險高�、專業(yè)技術性強的系統(tǒng)性工程,具有漸進性與不確定性的特點�。在整個研發(fā)過程中,研發(fā)機構或企業(yè)將面臨三重風險:技術性風險(早期研發(fā)失敗或臨床試驗失?��。?���、法規(guī)性風險(技術性風險與規(guī)范性問題疊加導致的注冊申請失?���。┮约靶б嫘燥L險(藥品上市后的市場回報率未達到預期)。如圖1所示����,一款新生物制品在實現(xiàn)商品化生產與銷售前���,要經(jīng)歷藥物發(fā)現(xiàn)��、臨床前研究(藥學與非臨床研究)���、臨床研究�、上市注冊申請4個階段����,其中由藥物發(fā)現(xiàn)與臨床前研究構成的早期研發(fā)結果直接決定了在研產品能否順利實現(xiàn)首例人體用藥,與安全性/有效性密切相關���,是生物制品研發(fā)的基石��。其中�,生物制品早期研發(fā)的科學性�����、創(chuàng)新性與合理性����,研究過程的真實性�、準確性���、完整性與可追溯性是藥品注冊申請的基礎�,是技術性風險與法規(guī)性風險的最直接體現(xiàn)�,與藥品研發(fā)質量管理工作密切相關。因此���,在當前我國藥品監(jiān)管日趨國際化的大環(huán)境下�����,如何建立一套既有助于推進生物制品研發(fā)進度����、提升研發(fā)效率����,又能幫助研發(fā)機構/企業(yè)降低風險、提高研發(fā)成功率的研發(fā)質量管理體系��,是生物制品研發(fā)機構/企業(yè)共同面臨的巨大挑戰(zhàn)[9-11]。
▲圖1-生物制品新藥研發(fā)流程圖 [12]
本文匯總了我國現(xiàn)行與藥品研發(fā)質量管理有關的法規(guī)�,分析了法規(guī)要求與生物制品研發(fā)現(xiàn)狀的契合度,根據(jù)生物制品早期研發(fā)階段的特點�����,概括了早期研發(fā)過程中常見的研發(fā)質量管理問題����,提出解決問題的對策與建議�,供生物制品研發(fā)人員和企業(yè)參考。
一���、 我國現(xiàn)行藥品研發(fā)質量管理相關的法規(guī)
近年來����,我國藥品監(jiān)管制度建設取得了巨大的成就����,藥品監(jiān)管機構制定與頒布了多項可供藥品研發(fā)質量管理參考的法規(guī)文件,相關的法規(guī)以及與研發(fā)質量管理有關的主要內容見表2�。
▲表2-我國現(xiàn)行與藥品研發(fā)質量管理相關的法規(guī)信息匯總
從表2可以看出,現(xiàn)階段我國已頒布的法規(guī)中關于藥品研發(fā)質量管理的規(guī)定主要涉及研發(fā)中后期階段�,對于研發(fā)早期階段的質量管理,尚缺少明確、細致�、可執(zhí)行的法規(guī)文件。對于生物制品早期研發(fā)過程質量管理�,機構與企業(yè)雖然可以參照上述現(xiàn)行規(guī)范與指南要求,如《藥品生產質量管理規(guī)范》臨床試驗用藥品附錄�,但這些法規(guī)文件的范圍與法規(guī)條款并不完全適用于生物制品早期研發(fā)階段,不能照抄�����、照搬�。ICH Q9和ICH Q10指導原則作為《藥品生產質量管理規(guī)范》的補充指南,闡述了質量風險管理理論�����,提出了貫穿藥品全生命周期的藥品質量管理體系����,但這2份指南同樣只是參考執(zhí)行,不是強制性要求���。
二���、 生物制品早期研發(fā)過程中的常見質量管理問題
由于缺少明確的法規(guī)指導,導致生物制品早期研發(fā)階段的研發(fā)質量管理水平參差不齊,出現(xiàn)了一些問題�。如表3所述,生物制品早期研發(fā)過程中的質量管理問題主要表現(xiàn)為組織架構/人員設置�、職能劃分、管理制度���、制度執(zhí)行與培訓�����、研究資料����、物料和供應商管理以及樣品管理7個方面的問題[13-22]�。
▲表3-生物制品早期研發(fā)過程中的常見質量管理問題
三����、 解決生物制品早期研發(fā)過程中常見質量管理問題的對策與建議
3.1 建立權責明確的生物制品研發(fā)質量管理部門
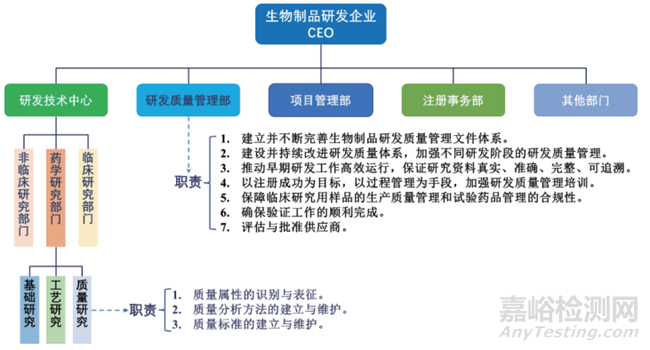
研發(fā)質量管理部門應獨立于研發(fā)技術部門與注冊部門(見圖2)并賦予明確的授權和職責[14, 23]��。
3.2 建立層次分明的生物制品研發(fā)質量管理文件體系
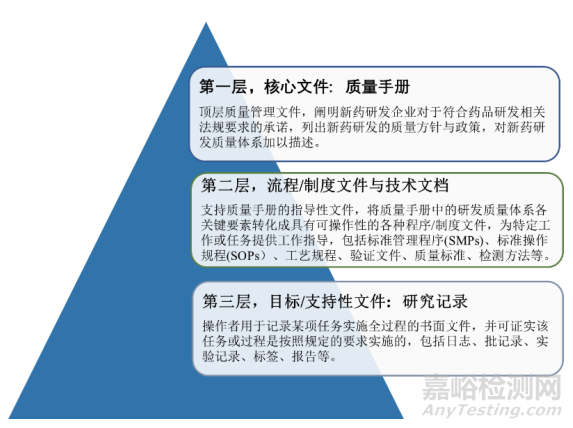
確保研發(fā)質量管理目標清晰����、對象明確�����、途徑清楚�。生物制品研發(fā)質量文件體系的架構可采取三級或四級架構����,以三級架構為例,其包含3個層次的文件(圖3):第一層為質量手冊��,第二層為流程/制度文件與技術文檔��,第三層為記錄類文件�。另外�,在制定制度文件時,應尤其注意幾點問題:①應明確研發(fā)質量管理配套制度的適用范圍為研發(fā)質量管理并采用專門的文件編號與版本號����;②配套制度的制定是循序漸進����、逐步完善的過程���,無法一步到位����;③應完整記錄并真實反映配套制度的完善過程;④配套制度的更新與升級審批流程應相對便捷��,避免流程冗余導致制度更新不及時���。如表4所述�,建立分類分層的研發(fā)質量管理文件體系,將使質量管理目標更加明確���,有助于強化生物制品研發(fā)過程中的研發(fā)質量管理[23-24]。
▲圖2-生物制品研發(fā)企業(yè)組織架構示意圖
▲圖3-生物制品研發(fā)質量文件體系架構圖
▲表4-生物制品研發(fā)企業(yè)研發(fā)質量管理文件匯總
3.3 研發(fā)質量管理文件的制定應采取“縱橫交錯、貼合實際”的原則
橫向管理可以將臨床前藥學研究的中試生產作為研發(fā)質量管理的分水嶺����,中試生產之前的研發(fā)過程以“確保清晰���、完整��、真實記錄研發(fā)過程���,推動研發(fā)進展”為宗旨,文件系統(tǒng)應與早期研發(fā)階段“漸進性��、多變性與靈活性”的特點相匹配��;中試生產開始后則應適當遵循GMP要求,例如:預先制定生產計劃��、批準質量標準�、建立合格供應商名單、物料入庫前執(zhí)行來料檢驗放行��、實施驗證的偏差與變更控制等���?����?v向管理則應根據(jù)不同階段的研發(fā)條件與影響因素,針對性地分析可能對產品質量屬性�、研究資料真實性與可溯源性等產生影響的因素�����,對于高風險環(huán)節(jié)則應建立全面的質量控制措施�。
3.4 加強質量管理工具的應用
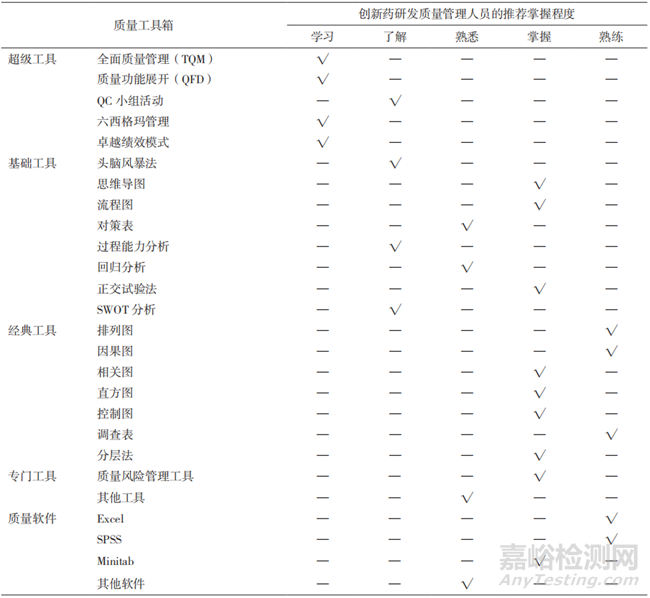
推進質量工具箱在生物制品研發(fā)質量管理中的應用����。生物制品研發(fā)企業(yè)的質量管理人員應樹立主動學習與掌握質量工具箱的意識�,特別是加強“經(jīng)典質量工具”在實際工作中的應用,熟練利用質量軟件匯總���、統(tǒng)計、分析研發(fā)質量管理數(shù)據(jù)��,用先進的手段來發(fā)現(xiàn)與解決問題�。表5中列出了生物制品研發(fā)質量管理人員推薦具備的質量工具箱使用技能要求[25]���。
▲表5-質量管理工具矩陣示例及推薦生物制品研發(fā)質量管理人員應具備的技能
3.5 采取合理的管理模式
相較于藥品生產管理模式高依從性�����、高重復性以及嚴格的變更控制�����,新藥研發(fā)項目管理模式具有“靈活�、漸進與可以不斷完善”的優(yōu)勢��,更符合生物制品早期研發(fā)階段的需求���。因此���,生物制品早期研發(fā)質量管理應采取新藥研發(fā)項目管理的模式,而非生產管理的模式����,提高研發(fā)質量管理的創(chuàng)造性、創(chuàng)新性����、靈活性與實用性(見表6)�����。
▲表6-藥品研發(fā)項目管理與生產管理特征匯總表
3.6 建立與健全研發(fā)項目代碼編號管理制度
制定并執(zhí)行統(tǒng)一的項目編碼規(guī)則���;加強早期研發(fā)階段的樣品管理���,建立研發(fā)樣品登記����、保存管理制度,保障樣品的可追溯性���,確保研發(fā)不同階段的樣品需求,特別是確保研發(fā)后一階段對前一階段樣品的復檢需求或補充檢定需求����。
3.7 建立與完善研發(fā)培訓體系
研發(fā)培訓應包含新員工入職培訓��、崗前培訓和在崗技能提升培訓����。實施持續(xù)培訓計劃����,包括法規(guī)更新培訓、SOP/SMP更新培訓���、調崗再培訓�����、知識技能提升培訓以及關鍵技術崗位的定期培訓等。建立考核制度���,考核培訓內容并評估培訓效果�,堅持培訓合格再上崗[14,26-27]�。
四����、 結語
百年藥企、研發(fā)先行���,創(chuàng)新是根���、質量為本�,生物制品研發(fā)是生物制藥企業(yè)長期發(fā)展的驅動力和核心競爭力��,合理����、完善的研發(fā)質量管理體系是保證生物制品研發(fā)與注冊成功的基礎。構建與運行藥品研發(fā)質量管理體系����,加強生物制品新藥早期研發(fā)階段的研發(fā)質量管理,降低企業(yè)在藥品注冊審評�、核查與審批過程中的質量與合規(guī)風險,提高生物制品研發(fā)的規(guī)范性���,將有助于生物制品的研發(fā)與上市����。在這個過程中�,研發(fā)企業(yè)要不斷提升研發(fā)早期質量管理的理念,持續(xù)貫徹����、改進���、提高研發(fā)質量管理體系的運行水平,生物制品研發(fā)質量管理人員應正確履行職責�����,研發(fā)技術人員應提高質量意識�,從而進一步激發(fā)生物制品研發(fā)企業(yè)的創(chuàng)造力與生命力���,推動生物制品行業(yè)高質量的創(chuàng)新發(fā)展�。
參考文獻
[1] 王冠杰�,邵明立. 從質量控制角度探索生物制品行業(yè)設備規(guī)范化管理[J]. 中國生物制品學雜志���,2022,35(5):637-640.
[2] 國家市場監(jiān)督管理總局. 生物制品批簽發(fā)管理辦法[S].2020.
[3] 顏若曦. 世界衛(wèi)生組織生物制品檢查要點與典型問題研究[J]. 中國醫(yī)藥工業(yè)雜志�,2022�����,53(7):1049-1055.
[4] 李敏���,郭秀俠,劉伯寧.關于生物制品工藝驗證的審評實踐與思考[J]. 中國生物制品學雜志�,2017,30(6):664-672.
[5] 李敏����,常衛(wèi)紅. 生物制品質量標準研究與建立一般原則的探討[J]. 中國新藥雜志�,2017,26(16):1887-1893.
[6] Sagonowsky E. The Top 20 Drugs by Worldwide Sales in2020 [EB/OL].(2021-05-03)[2022-05-03]. https://www.fiercepharma.com/special-report/top-20-drugs-by-2020-sales.
[7] Dunleavy K. The Top 20 Drugs by Worldwide Sales in2021 [EB/OL].(2021-05-03)[2023-05-31]. https://www.fiercepharma.com/special-reports/top-20-drugs-worldwide-sales-2021.
[8] Buntz B. The 50 Best-selling Pharmaceuticals of 2022:COVID-19 Vaccines Poised to Take a Step Back [EB/OL]. (2023-04-18)[2023-06-05]. https://www.drugdiscoverytrends.com/50-of-2022s-best- selling-pharmaceuticals/.
[9] 康建磊�����,王亞敏. 創(chuàng)新藥藥學研究的特點及技術考慮[J].藥物評價研究����,2016,39(4):664-667.
[10] 楊志敏�����,馮毅. 創(chuàng)新性藥物研發(fā)失敗原因的探討[J]. 中國新藥雜志���,2010�����,19(1):17-19.
[11] 徐春柳����,蔣琴南. 制藥企業(yè)藥品研發(fā)階段質量管理存在的問題及對策探討[J]. 化工管理,2020(6):43-44.
[12] Wagner J, Dahlem A, Hudson L, et al. Application of aDynamic Map for Learning, Communicating, Navigating,and Improving Therapeutic Development[J]. Clin TranslSci, 2018,11(2):166-174.
[13] 杜曉霞�����,邢花.制藥企業(yè)藥品研發(fā)階段質量管理存在的問題及對策探討[J]. 中國藥物評價����,2018���,35(3):230-232.
[14] 趙艷梅,韓昆�,由春娜,等. 完善制藥企業(yè)藥品研發(fā)質量管理體系的探討[J]. 中國藥事�,2019�����,33(8):896-903.
[15] 張瑩�,舒璐俊. 制藥企業(yè)藥品研發(fā)階段質量管理存在的問題及對策探討[J]. 臨床醫(yī)藥文獻電子雜志���,2019����,6(78):194.
[16] 葛旭. 制藥企業(yè)藥品研發(fā)階段質量管理存在的問題及對策[J]. 醫(yī)藥化工����,2021,47(1):165-166.
[17] 祝翠紅����,邢靚. 制藥企業(yè)藥品研發(fā)階段質量管理研究[J]. 醫(yī)藥化工,2020���,46(1):219.
[18] 胡小娟��,曹軼. 化學藥品藥學研制現(xiàn)場核查常見問題分析[J]. 中國新藥雜志�����,2023��,32(8):783-786.
[19] 杜婧,高勝男. 藥品注冊核查中對技術轉移方面的探討[J]. 中國新藥雜志���,2022,31(17):1684-1688.
[20] 顏若曦����,曹軼,董江萍. 藥品注冊核查中對數(shù)據(jù)管理要求的研究[J]. 中國新藥雜志���,2022���,31(2):160-164.
[21] 汪麗�����,胡春麗��,沈文娟. 藥品注冊研制現(xiàn)場檢查中的問題及對策建議[J]. 中國藥業(yè)���,2018�,27(24):100-104.
[22] 周莉婷���, 白玉. 中國生物制品實施ICH M4Q指導原則的思考[J]. 中國生物制品學雜志��,2020����,33(9):1083-1087.
[23] 程英����,汪飛,劉超���,等. 藥物研發(fā)全過程質量管理體系的構建和運行[J]. 中國藥事��,2021���,35(6):631-640.
[24] 李孫華,王士義����,李麗潔���,等. 生物制品研發(fā)機構質量管理體系的構建策略[J]. 中國當代醫(yī)藥,2015���,22(21):137-139.
[25] Nancy R. Tague. 質量工具箱[M]. 第二版 何楨���,施亮星,譯. 北京:中國標準出版社��,2007.
[26] 伊娜. 藥品研發(fā)質量管理體系分析和應對方法[J]. 黑龍江醫(yī)藥�, 2021, 34 (3):561-563.
[27] 馬麗媛. 放射性藥品研發(fā)質量管理體系建設思考[J]. 現(xiàn)代企業(yè)文化�����,2022(10):49-51.