國內(nèi)自2020年開展醫(yī)療器械帶量采購以來�����,企業(yè)陸續(xù)瞄準(zhǔn)海外市場���,醫(yī)療器械急需出海。海外CE認(rèn)證正處在MDR過渡末期�,將影響已出海的醫(yī)療器械合法合規(guī)銷售,同時(shí)MDR法規(guī)更加重視數(shù)據(jù)的透明度和可追溯性,且上市后監(jiān)管更加嚴(yán)格���。
在此背景下�,真實(shí)世界數(shù)據(jù)支持醫(yī)療器械出海的優(yōu)勢日益凸顯���。真實(shí)世界研究(Real-World Study���,RWS)是在真實(shí)世界環(huán)境中進(jìn)行的研究。RWS通常使用現(xiàn)有的醫(yī)療記錄�����、病歷等���,以便更好地了解醫(yī)療干預(yù)的效果和安全性�。
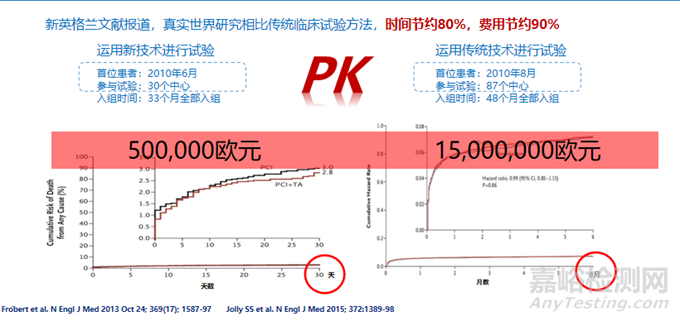
相比RCT�,RWS可以提供更廣泛的參與者、更長的跟蹤時(shí)間�、更真實(shí)的結(jié)果,并且可以更好地反映真實(shí)世界中的醫(yī)療實(shí)踐���。同時(shí)�����,有研究表明RWS也更能節(jié)省周期和費(fèi)用���,在全球經(jīng)濟(jì)下行的當(dāng)下���,可幫助醫(yī)療器械企業(yè)大幅降低成本!有研究表明���,RWS相比RCT可節(jié)省時(shí)間約80%�,費(fèi)用約90%�。
以下出海場景,建議優(yōu)先考慮真實(shí)世界研究進(jìn)行醫(yī)療器械臨床評價(jià):
1���、首次CE認(rèn)證
2�����、MDD換MDR證
3、PMCF
4�、FDA認(rèn)證
注1:目標(biāo)醫(yī)療器械需已在國內(nèi)獲證,已有國內(nèi)臨床使用數(shù)據(jù)或即將在國內(nèi)臨床使用�。一次研究,長久獲益。首次打通醫(yī)院數(shù)據(jù)���,即可長期采集�,實(shí)時(shí)更新數(shù)據(jù)�����,有利于長期做PMCF���。
注2:除出海外�����,國內(nèi)附條件上市后臨床評價(jià)�,也更適合采用真實(shí)世界研究�����,會有專門介紹�����,此文中不做重點(diǎn)討論�����。
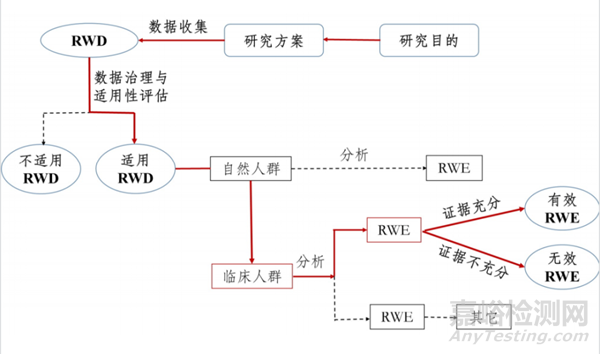
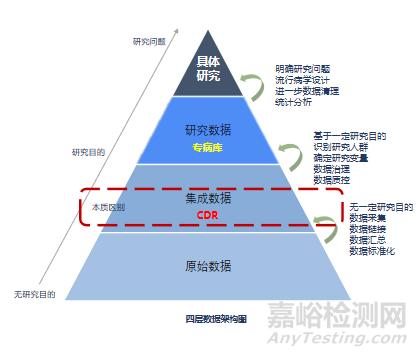
并非所有的臨床數(shù)據(jù)都可以作為臨床評價(jià)的證據(jù)。真實(shí)世界數(shù)據(jù)的產(chǎn)生源于對接醫(yī)院系統(tǒng)獲取到的原始數(shù)據(jù)���,經(jīng)過數(shù)據(jù)采集�����、數(shù)據(jù)鏈接�、數(shù)據(jù)匯總�、數(shù)據(jù)標(biāo)準(zhǔn)化,形成集成數(shù)據(jù)���。集成數(shù)據(jù)基于一定研究目的識別研究人群���、確定研究變量、數(shù)據(jù)治理�����、數(shù)據(jù)質(zhì)控�,形成研究數(shù)據(jù)即專病庫���。明確研究問題�、流行病學(xué)設(shè)計(jì)、進(jìn)一步數(shù)據(jù)清理�、統(tǒng)計(jì)分析形成具體研究。過上述數(shù)據(jù)處理過程�,真實(shí)世界數(shù)據(jù)才能形成真實(shí)世界證據(jù)。
同時(shí)醫(yī)學(xué)術(shù)語集的建立也非常重要�����,術(shù)語集的建立經(jīng)過專家組反復(fù)討論�����、真實(shí)世界評估驗(yàn)證���、修訂形成終稿�����。持續(xù)迭代更新�����,確保數(shù)據(jù)元和數(shù)據(jù)集既符合臨床實(shí)踐���,又符合國際標(biāo)準(zhǔn)�,有利于醫(yī)療器械國內(nèi)形成的臨床證據(jù)受國際認(rèn)可���,便于用于海外上市認(rèn)證�����!