室性心律失常是美國心臟性猝死的主要原因����。目前的起搏方式不足以預(yù)防或治療這些瘢痕或其他病變心肌導(dǎo)致的心臟組織電傳導(dǎo)減慢。隨之而來的空間和時間異質(zhì)性會導(dǎo)致斷波�����、再入����、混亂的心臟活動和顫動��。目前的治療方法主要是聯(lián)合使用抗心律失常藥物--所有這些藥物都有很高的毒性--和/或?qū)Σ∽儏^(qū)域鄰近或附近的組織進(jìn)行消融和破壞����。抗心律失常藥物的作用是進(jìn)一步減慢傳導(dǎo)速度�����,以徹底消除這種傳導(dǎo)�����。這也正是它們助長心律失常的原因:降低傳導(dǎo)速度是再入室誘發(fā)和維持再入室的必要條件��。盡管消融策略被廣泛采用����,但其失敗率很高����,18%-40% 的病例會出現(xiàn)復(fù)發(fā)性心律失常����。最重要的是,這些技術(shù)都不能糾正再入的基本機(jī)制:延遲傳導(dǎo)��。對許多患者來說��,目前唯一的選擇是植入式心臟除顫器�����,它使用高能量電擊來撲滅再入電信號�����。這些沖擊遠(yuǎn)遠(yuǎn)超過了疼痛閾值��,對生活質(zhì)量的負(fù)面影響也十分明顯�����,包括創(chuàng)傷后應(yīng)激障礙和抑郁癥。針對再入路的潛在病理生理學(xué)的預(yù)防性治療方案仍然遙遙無期����。室性心律失常是導(dǎo)致心臟性猝死的主要原因,臨床上迫切需要一種能從根本上解決室性心律失常病理生理學(xué)問題的治療方案��。
來自美國德克薩斯心臟研究所和美國貝勒醫(yī)學(xué)院的Mehdi Razavi團(tuán)隊與來自美國得克薩斯大學(xué)奧斯汀分校的Elizabeth Cosgriff-Hernandez(Materials Advances副主編)合作開發(fā)了可注射水凝膠電極技術(shù)以及在豬模型中的成功應(yīng)用�����,其接入方式比目前任何起搏方式都要精細(xì)得多��。除了成功的心臟捕獲和起搏外��,對表面心電圖描記和三維電解剖圖的分析表明��,QRS 形態(tài)與原生竇性心律相當(dāng)�����,這強(qiáng)烈表明水凝膠電極捕獲了deep septal bundle branches和浦肯野纖維����。在消融模型中��,電解剖繪圖數(shù)據(jù)表明,水凝膠的激活波前到達(dá)心肌中層和心內(nèi)膜的時間比目前的單點起搏模式要早得多����。這種對大片組織的均勻激活可最大限度地減少異質(zhì)組織的心肌傳導(dǎo)延遲,而這種延遲正是再入路的基礎(chǔ)�����?����?傊?����,本研究證明了一種新起搏模式的可行性��,這種模式最接近于原生傳導(dǎo)����,有可能消除致命性再入性心律失常,并提供無痛除顫�����。相關(guān)工作以題為“Injectable hydrogel electrodes as conduction highways to restore native pacing”的文章發(fā)表在2024年1月2日的國際頂級期刊《Nature Communications》。
1. 創(chuàng)新型研究內(nèi)容
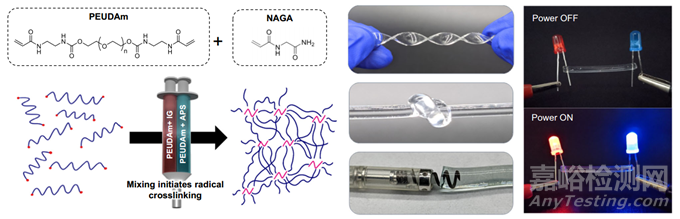
本研究開發(fā)了一種可注射的水凝膠電極����,它能填充心外膜冠狀靜脈和支流,將其轉(zhuǎn)化為柔性電極����,最終到達(dá)迄今為止無法到達(dá)的心肌中層。這種方法利用了微創(chuàng)導(dǎo)管輸送和標(biāo)準(zhǔn)起搏器技術(shù)的優(yōu)勢����,可融入臨床工作流程并確保被采用��。除了增加進(jìn)入心肌中層的機(jī)會外��,這種水凝膠電極還能沿電極長度從多個部位同時起搏�����,而不是單點刺激��。本研究假設(shè)��,由此產(chǎn)生的來自電極長度的平面波傳播將刺激心室組織的廣泛區(qū)域����,否則這些區(qū)域?qū)⑹艿窖舆t激活的影響��。這將使作為再入基礎(chǔ)的延遲激活區(qū)域正?����;⑾?���。為此��,本研究開發(fā)了一種水凝膠系統(tǒng)�����,它具有必要的導(dǎo)電性�����、生物穩(wěn)定性和快速原位固化��,可通過經(jīng)靜脈導(dǎo)管輸送��。
【具有快速原位固化和離子導(dǎo)電性的可注射水凝膠】
目前還沒有一種水凝膠能滿足心臟電極向心肌中層進(jìn)行血管內(nèi)輸送的多方面需求:可注射性��、導(dǎo)電性和生物穩(wěn)定性。聚乙二醇(PEG)水凝膠具有公認(rèn)的生物相容性和高度可調(diào)的軟組織特性��,是一種很受歡迎的選擇����;但是,傳統(tǒng)的丙烯酸酯衍生 PEG 水凝膠容易因水解而在體內(nèi)緩慢降解��。為了生成適合長期植入應(yīng)用的 PEG 基水凝膠�����,本研究合成了一種兼具生物穩(wěn)定性����、柔韌性和耐久性的水凝膠化學(xué)成分��。聚醚聚氨酯二丙烯酰胺(PEUDAm)含有聚氨酯和酰胺基團(tuán)����,在生理條件下可抗水解(圖 1)。H1 NMR 證實了成功的轉(zhuǎn)化率(>95%)��。除了生物穩(wěn)定的 PEG 大分子外�����,本研究還合成了 N-丙烯酰基甘氨酰胺(NAGA)��,這是一種具有雙叉氫鍵的小分子交聯(lián)劑�����。本研究提出的設(shè)計還要求在沒有外部刺激(如紫外線)的情況下快速原位固化水凝膠�����。本研究團(tuán)隊的實驗室以前曾利用過硫酸銨(APS)和葡萄糖酸鐵(IG)這對氧化還原劑展示過可調(diào)凝膠��。本研究使用帶混合頭的雙管注射器輸送前體溶液��,作為將來從雙腔導(dǎo)管輸送的類似物��。迭代測試確定了小于 1 分鐘的目標(biāo)固化速度��,在小于 2 分鐘的時間內(nèi)完全形成網(wǎng)絡(luò)�����,這相當(dāng)于 APS 濃度≥0.75 mM����。離子 PEUDAm 水凝膠依靠溶解在前驅(qū)體溶液中的鹽作為電荷載體����,在連接到電源時產(chǎn)生電流��。
圖1 設(shè)計可注射水凝膠電極
【注射式水凝膠電極在豬模型中的成功應(yīng)用和安全性】
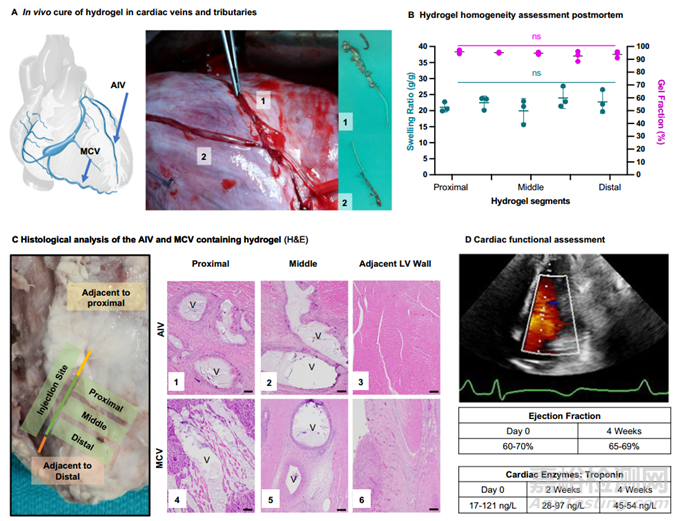
為了模擬臨床上在跳動和灌注心臟中的應(yīng)用����,本研究使用豬模型將前體溶液注入前靜脈,并對靜脈和支流中的體內(nèi)凝膠形成和保留進(jìn)行了表征(圖 2A)����。取出的水凝膠在整個水凝膠長度上(近端到遠(yuǎn)端)顯示出極好的節(jié)段均勻性,平衡膨脹比和凝膠分?jǐn)?shù)的差異極小��。需要注意的是�����,計算出的凝膠分?jǐn)?shù)并沒有考慮從注射到外植之間凝膠的任何潛在浸出�����。平衡溶脹比可以衡量水凝膠網(wǎng)絡(luò)結(jié)構(gòu)����,并表明凝膠的形成在整個靜脈長度上是均勻的(圖 2B)。一旦將水凝膠注入靜脈并連接到起搏裝置�����,它將在患者的有生之年留在該位置�����。
本研究進(jìn)行了初步的安全性評估�����,以確認(rèn)靜脈閉塞不會對動物造成急性不良影響����,并評估宿主對凝膠的反應(yīng)。與動脈介入不同����,以靜脈血管為目標(biāo)具有幾個優(yōu)勢:1)閉塞的臨床耐受性良好,不會發(fā)生缺血事件��;2)血管沒有重塑,可以穩(wěn)定放置�����;3)靜脈壓力低(舒張期<10 mmHg��,收縮期<30 mmHg)�����,不太可能使水凝膠脫落�����,這一點已在本研究中得到證實。在臨床環(huán)境中�����,水凝膠將通過導(dǎo)管輸送到靜脈��;但是��,在這項初步可行性研究中,為了進(jìn)入靜脈并輸送水凝膠,需要進(jìn)行心外膜切口����。在這種特殊情況下����,水凝膠被注入前室內(nèi)靜脈(AIV)并保留四周(n = 3),注入心臟中靜脈(MCV)并保留兩周(n = 1)�����。分別在兩周和四周(圖 2C)后切除并分析注射部位近端����、鄰近和遠(yuǎn)端的組織切片�����,以評估心臟損傷和炎癥的程度��。組織病理學(xué)上沒有心肌壞死的證據(jù)��,也沒有左心室心肌損傷的證據(jù)。所有部位都觀察到輕度血管周圍和間質(zhì)纖維化,慢性心外膜炎更靠近切口/注射部位(圖 2C)��。
圖2 豬模型冠狀靜脈注射電極的體內(nèi)評估
【水凝膠電極通過捕捉心肌中層組織模擬生理傳導(dǎo)】
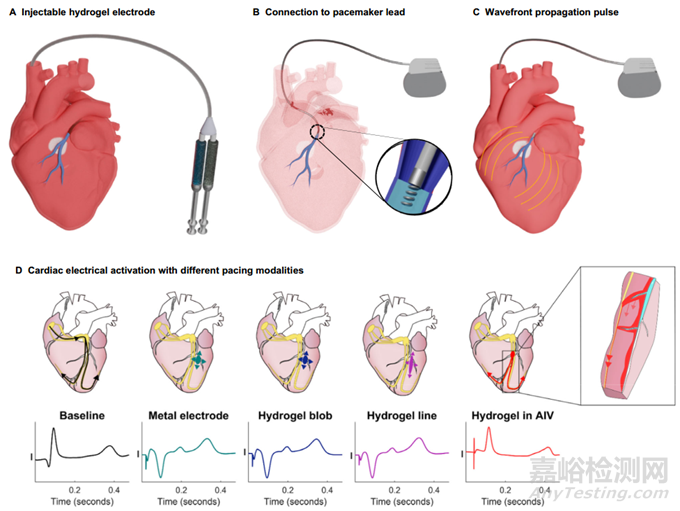
開發(fā)可注射水凝膠電極的基本假設(shè)是����,它應(yīng)能從心臟靜脈進(jìn)行心臟起搏����。本研究設(shè)計的水凝膠電極的臨床工作流程包括:使用雙腔導(dǎo)管輸送水凝膠前體溶液����,填充冠狀靜脈和支流,這些靜脈和支流橫跨瘢痕組織附近的心肌��,氧化還原引發(fā)的交聯(lián)使離子水凝膠快速固化(圖 3A)��;隨后將起搏器導(dǎo)線連接到離子水凝膠電極��,增加了整個心肌的組織接觸(圖 3B)����;沿著水凝膠電極的心肌波前激活減少了除顫所需的能量(圖 3C)��。本研究在豬模型中測試了注射式水凝膠電極��,以模擬臨床應(yīng)用。在脈沖寬度為 5 毫秒時�����,測得金屬電極的單極起搏閾值為 2.2 ± 1.2 毫安����,2.3 ± 0.6 毫安����,心外膜水凝膠點源(0.8 厘米圓盤)為 1.5 ± 1.28 毫安,心外膜水凝膠為 1.5 ± 1.3 毫安�����,AIV 中的水凝膠為 2.7 ± 1.8 毫安。在 5 毫秒和 10 毫秒脈寬時�����,不同電極配置的捕獲閾值沒有明顯差異。在其他脈寬下測量的起搏閾值詳見�����。雙向方差分析顯示,只有脈寬小于或等于 1 毫秒時的捕獲閾值存在顯著差異��。使用金屬電極�����、水凝膠點或水凝膠線進(jìn)行心外膜起搏會產(chǎn)生倒置的 QRS 形態(tài)��,表明偏離正常傳導(dǎo)(圖 3D)。
圖3 可注射水凝膠系統(tǒng)示意圖:將冠狀靜脈轉(zhuǎn)化為可捕捉無法觸及的心臟組織的柔性電極
【通過水凝膠電極起搏可使異質(zhì)心肌的組織激活正?���;?/span>
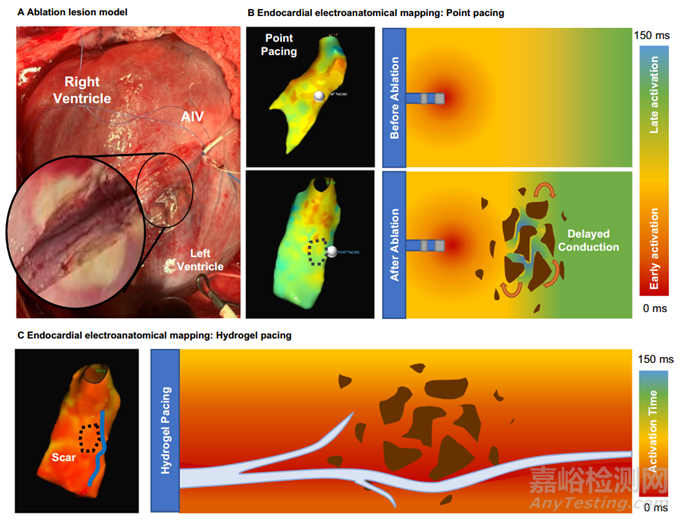
本研究利用豬消融模型脈沖傳播的電解剖圖研究了點源起搏和水凝膠電極對異質(zhì)組織傳導(dǎo)的影響����。簡言之��,在豬心靠近AIV的心外膜上進(jìn)行消融��,以破壞原生傳導(dǎo)并模擬瘢痕心肌的情況����。圖 4A 利用尸體解剖顯示消融后瘢痕形成的深度。點起搏顯示消融后出現(xiàn)延遲和異質(zhì)(局灶)激活波前,這歸因于消融病灶的形成(圖 4B)��。如上所述�����,在 AIV 中注入并固化了水凝膠����,隨后的電壓繪圖證實水凝膠電極增加了組織激活面積(圖 4C)����。此外��,電解剖圖首次表明�����,在消融模型中,水凝膠的激活波前到達(dá)心肌中層和心內(nèi)膜的時間比點起搏要早得多����。第二個關(guān)鍵觀察結(jié)果是����,在 AIV 水凝膠起搏中����,心肌中層和心內(nèi)膜觀察到了廣泛的早期激活。
圖4 豬消融模型中的心臟電解剖圖研究
2. 總結(jié)與展望
在大型動物模型中使用這些可注射水凝膠電極進(jìn)行的心臟起搏研究證明了這種方法的有效性�����。雖然本研究沒有評估這種起搏在病變心肌中的效果����,但本研究證明了利用當(dāng)前的商業(yè)技術(shù)直接對這些過去無法接近的心臟區(qū)域進(jìn)行起搏的能力����。支持這一點的證據(jù)是,起搏后的表面心電圖形態(tài)與原始心電圖形態(tài)幾乎完全相同��。在室間隔深度起搏的臨床報告中也觀察到類似的 QRS 向量正?����;Ч?���。
此外,起搏刺激與表面心電圖啟動之間存在明顯的延遲��。這是因為起搏輸出在進(jìn)入心肌組織之前����,至少有一部分是通過本地傳導(dǎo)系統(tǒng)捕獲和傳導(dǎo)的�����。因此�����,起搏刺激與心電圖信號開始之間存在延遲�����。這些特征都是可重復(fù)觀察到的,強(qiáng)烈暗示了直接捕獲心肌中層組織�����,而這在技術(shù)上一直是個難題��,據(jù)本研究團(tuán)隊所知也從未有過報道�����。
繼這一令人振奮的發(fā)現(xiàn)之后����,本研究又測試了本研究的核心假設(shè)����,即同時刺激大面積的心室組織可減少組織異質(zhì)性(如瘢痕)的影響,而組織異質(zhì)性會導(dǎo)致心電傳導(dǎo)延遲�����。目前正在開發(fā)一種室性心律失常發(fā)病率較高的豬心肌梗塞模型����,以全面評估擬議技術(shù)的臨床益處�����。為了對組織異質(zhì)性對傳導(dǎo)的影響進(jìn)行概念驗證評估,本研究在普遍接受的消融模型中比較了點電極起搏和水凝膠電極起搏�����。電解剖圖清楚地顯示了點起搏消融后的傳導(dǎo)延遲,水凝膠電極顯著增加了激活面積��,從而解決了傳導(dǎo)延遲問題����。雖然該模型并不能完全復(fù)制心肌梗死后瘢痕的影響,但它確實證明了水凝膠電極能顯示出更快的傳導(dǎo)速度��,并至少在有限的心肌損傷區(qū)域?qū)⒔M織異質(zhì)性對傳導(dǎo)速度的影響降至最低��。鑒于組織異質(zhì)性與室性心律失常之間的基本聯(lián)系已得到證實����,水凝膠電極已證明有可能終止遠(yuǎn)低于疼痛閾值的再入����。無痛除顫和潛在的心律失常預(yù)防方法將徹底改變心律管理方式�����。
文章來源:
https://doi.org/10.1038/s41467-023-44419-0
https://www.163.com/dy/article/I25O7VHV0552GRMJ.html