糖尿病的全球發(fā)病人數(shù)高達(dá)4.25億人��,其日益加重的疾病負(fù)擔(dān)是一個重大的挑戰(zhàn)��,解決該問題對患者��、護理人員��、醫(yī)療系統(tǒng)和經(jīng)濟都有多方面的要求��。在糖尿病患者中��,7500 萬人依賴胰島素治療。這些嚴(yán)重的胰島素缺乏和胰島素抵抗亞型患者需要通過注射或輸注胰島素��、生活方式干預(yù)和持續(xù)血糖監(jiān)測等綜合措施嚴(yán)格控制血糖��,以降低急性不良事件(高血糖和低血糖)的發(fā)生率以及心血管疾病或腎病��、神經(jīng)病和視網(wǎng)膜病變等長期并發(fā)癥的發(fā)生率��。雖然當(dāng)前的注射胰島素是一種廣泛使用的療法��,但是依然有可能發(fā)生危及生命的低血糖事件��。
來自澳大利亞悉尼大學(xué)的Nicholas J. Hunt和Victoria C. Cogger團隊利用胰島素共軛硫化銀量子點與殼聚糖/葡萄糖聚合物的涂層��,開發(fā)出一種反應(yīng)靈敏的口服胰島素納米制劑。這種制劑對 pH 值有反應(yīng)��,在酸性環(huán)境中不溶解��,在中性 pH 值下,人體十二指腸外植體和秀麗隱桿線蟲(Caenorhabditis elegans)的吸收率增加。該制劑對葡萄糖苷酶敏感��,可觸發(fā)胰島素釋放��。研究發(fā)現(xiàn),該制劑口服后會分布到小鼠和大鼠的肝臟��,并促進血糖的劑量依賴性降低��,而不會導(dǎo)致患有糖尿病嚙齒動物出現(xiàn)低血糖或體重增加��。非糖尿病狒狒的血糖降低也呈劑量依賴性。在小鼠��、大鼠和非人靈長類動物中未觀察到生化或血液學(xué)毒性或不良事件��。該制劑顯示了口服控制血糖而不引起低血糖發(fā)作的潛力。相關(guān)工作以題為“Oral nanotherapeutic formulation of insulin with reduced episodes of hypoglycaemia”的文章發(fā)表在2024年1月2日的國際頂級期刊《Nature Nanotechnology》��。
1. 創(chuàng)新型研究內(nèi)容
口服胰島素被認(rèn)為可以模擬胰島素的內(nèi)源性釋放��,因此為這些挑戰(zhàn)提供了解決方案。胰腺分泌的胰島素大部分作用于肝臟,只有一小部分可避免肝臟清除而作用于全身��。同樣��,在口服后,口服胰島素首先通過門靜脈循環(huán)輸送到肝臟��。然而��,以往的口服胰島素臨床試驗表明,口服胰島素對降低低血糖發(fā)生率的作用微乎其微��?�?诜葝u素在長期堅持用藥和藥物可接受性方面也有一些優(yōu)勢��,因為胰島素注射對于兒童��、老年人和新確診的胰島素依賴型 2 型糖尿病患者來說尤其具有挑戰(zhàn)性��,會導(dǎo)致他們回避、猶豫或延遲胰島素治療。此外��,注射胰島素在新的治療領(lǐng)域(如認(rèn)知障礙和阿爾茨海默?�。┎⒉槐徽J(rèn)為是一種可行的治療方法��,而在這些領(lǐng)域��,注射胰島素可能具有臨床療效��。此前��,本研究團隊已證明硫化銀(Ag2S)量子點(QDs)具有口服生物利用度,并能提高二甲雙胍和煙酰胺單核苷酸的吸收率��、口服生物利用度和肝細(xì)胞靶向性��。這些藥物本來就具有口服生物利用度,但與 QDs 共軛后��,藥效提高了 100-10,000 倍��,并克服了與年齡相關(guān)的藥效受損問題��。本研究將這一納米技術(shù)平臺與 pH 值和酶敏感性封裝聚合物結(jié)合應(yīng)用于胰島素。
【納米載體對 pH 值敏感】
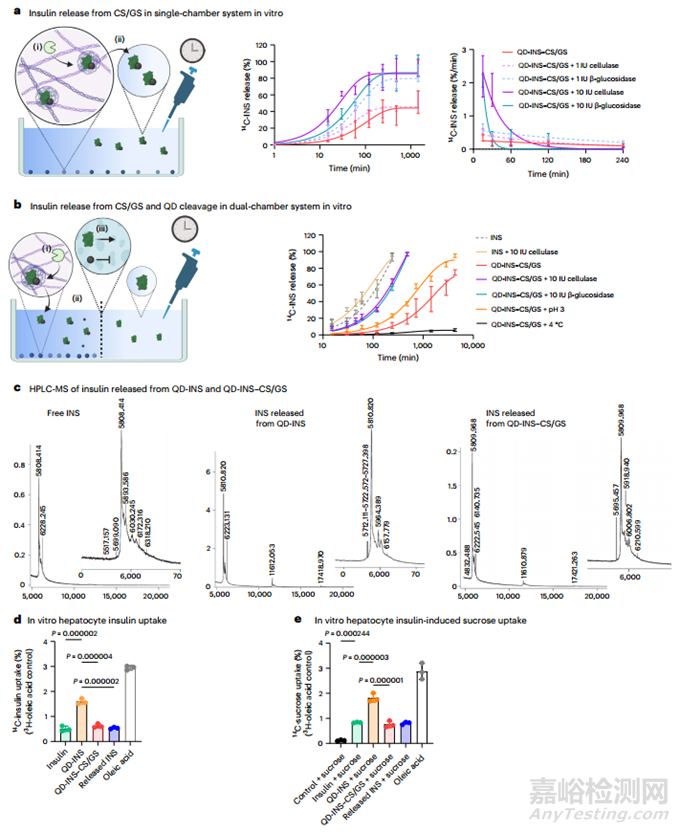
胰島素口服給藥最初面臨的挑戰(zhàn)是其在低 pH 值下的高溶解度和降解��。本研究發(fā)現(xiàn)與單獨使用胰島素或 QDs 相比,將胰島素附著在 Ag2S QDs 上可降低 QD 胰島素(QD-INS)在低 pH 環(huán)境中的溶解度��。利用 N-(3-二甲基氨基丙基)-N′-乙基碳二亞胺鹽酸鹽(EDC)和磺基-N-羥基琥珀酰亞胺(NHS)化學(xué)交聯(lián)法��,將可溶性胰島素(pH 值為 3)結(jié)合到用 3-巰基丙酸(3-MPA)封端的 Ag2S QDs [直徑為 6.5 ± 1.2 nm(通過透射電子顯微鏡(TEM)測量)]表面(圖 1a)。胰島素的附著是在 pH 值為 9 的條件下進行的��,生成的是可溶的 QD-INS 溶液。透析后��,可溶性 QD-INS 溶液的 pH 值為 7��。傅立葉變換紅外光譜(FTIR)顯示��,在透析過程中去除游離胰島素后��,QD-INS 具有與單獨胰島素相似的峰值��,表明其附著��。CS/GS 的化學(xué)結(jié)構(gòu)是通過一維 1H 和二維 [1H,1H] 核奧弗霍塞爾效應(yīng)光譜(NOESY)��、核磁共振和傅立葉變換紅外光譜確定的(圖 1b)��。在傅立葉變換紅外光譜中��,β-1,4 糖苷鍵非常突出��,這是因為使用了脫乙?�;瘹ぞ厶牵ㄆ咸前穯误w)��,它們通過這些 β-1,4 糖苷鍵聚合��。葡萄糖單體在形成糖原或淀粉時通常會形成 α-1,4 或 α-1,6 糖苷鍵��;但在長鏈中,它們也可以形成 β-1,4 糖苷鍵��,從而形成纖維素。CS/GS 似乎同時含有 α 和 β 糖苷鍵��,因此在設(shè)計時就考慮到了這種降解形式��,其分解會導(dǎo)致胰島素的釋放。
在 pH 值為 7 時��,由于 QD-INS 的負(fù)ζ電位和 CS/GS 的正ζ電位��,QD-INS 和陽離子共聚物通過靜電吸引將 CS/GS 包覆在 QD-INS 上��。在 α 和 β 鏈的 C 端,特別是 B21��、25-27 和 30��,可能促進了氫鍵的形成(圖 1b)��。將這些溶液混合后��,形成了 20.0 ± 1.7 nm 的 CS/GS 納米粒子,在 TEM 下可觀察到其中同時含有 Ag2S QDs 和胰島素(圖 1c)��。添加 CS/GS 增加了 QD-INS-CS/GS 的動態(tài)光散射測量的流體動力(HD)直徑,而ζ電位的變化可以忽略不計(圖 1d)��。在具有 -OH 功能基團和胺基團的 QD-INS-CS/GS 的傅立葉變換紅外光譜和核磁共振光譜中��,CS/GS 涂層消除了胰島素的指紋標(biāo)記。將 QD-INS-CS/GS 在 37 ℃ 的 pH 值為 3 的溶液中培養(yǎng)以促進聚合物降解��,這種效應(yīng)是可逆的��。不同濃度的胰島素在 QDs 上的負(fù)載能力表明��,胰島素的最大保留率為 80%��,根據(jù)摩爾比��,每個 QD 上有 1-2 個胰島素分子(圖 1e)��。
圖1 口服胰島素(QD-INS-CS/GS)的配制和表征
【胰島素的釋放是由 CS/GS 的酶裂解介導(dǎo)的】
為了檢查胰島素有效載荷的釋放情況��,本研究在肝細(xì)胞培養(yǎng)物中與各種水解酶��、低 pH 值和溫度共孵育��,測量了 QD-INS-CS/GS 的碳 14 (14C) 胰島素 (14C-INS) 釋放情況��。與纖維素酶或β-葡萄糖苷酶共孵育明顯提高了釋放速度��,在單室中 0.5 小時內(nèi)釋放了 50%(圖 2a)��。隨后,本研究使用了一個由 10 kDa 透析管隔開的雙室系統(tǒng)��,只允許在第二個室中檢測游離的(非 QD 連接的)胰島素。與纖維素酶或β-葡萄糖苷酶共孵育會導(dǎo)致胰島素在 1 小時內(nèi)釋放 50%(圖 2b)��。釋放率隨溫度和 pH 值的降低而增加(圖 2b)��,這表明 CS/GS 對酶降解��,尤其是對β-葡萄糖苷酶的降解非常敏感。通過質(zhì)譜分析��,釋放的胰島素主要是單體(87.5%)��,少量存在二聚體(11.5%)和三聚體(<1.0%)(圖 2c)��。在 QD-INS 和 QD-INS-CS/GS 與單獨的胰島素之間觀察到了類似的光譜峰(圖 2c)��。
本研究還在肝細(xì)胞培養(yǎng)物中評估了胰島素和蔗糖的吸收��。當(dāng)與 QDs 共軛時��,14C-INS 的攝取量增加了一倍��,而與 QD-INS-CS/GS 共軛的制劑則逆轉(zhuǎn)了這種效應(yīng)(圖 2d),這表明 CS/GS 與受體激活關(guān)鍵的 β 鏈 C 末端發(fā)生了相互作用��。用 QD-INS-CS/GS 或 QD-INS-CS/GS 釋放的胰島素預(yù)處理肝細(xì)胞,突出表明 CS/GS 必須在胰島素作用前降解,并顯示 QD-INS 具有生理活性(圖 2e)��。
圖2 QD-INS-CS/GS 的胰島素釋放量
【納米載體提高人體腸道外植體的吸收率】
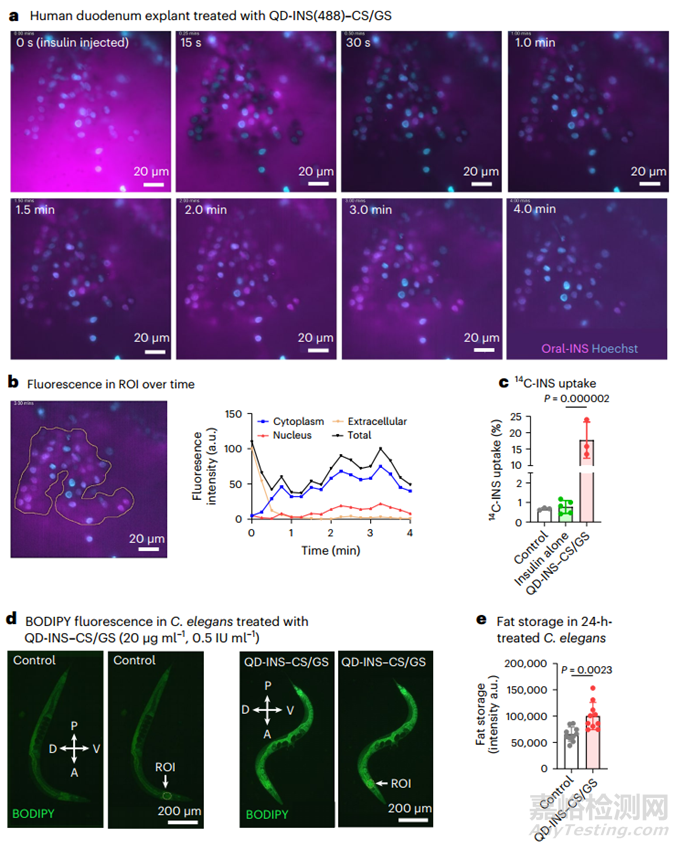
本研究使用人十二指腸外植體研究了腸道攝取情況��,這與本研究團隊之前在小鼠體內(nèi)的研究類似��。人十二指腸外植體細(xì)胞攝取的實時成像(圖 3a)顯示��,2-4 分鐘內(nèi)的活體攝取主要集中在細(xì)胞質(zhì)中(70%)(圖 3b)��。8 分鐘后觀察到內(nèi)泡形成和外排。用 QD-INS-CS/GS 配制后��,人十二指腸外植體對 14C-INS 的吸收率提高了 40 倍(圖 3c)。
【胰島素納米載體促進秀麗隱桿線蟲的脂肪儲存】
本研究還在秀麗隱桿線蟲(C. elegans)中對腸道吸收進行了驗證��。由于其腸道屏障和對胰島素的生理反應(yīng)��,該模型可用于口服給藥納米技術(shù)的初步篩選。過量的胰島素會抑制體內(nèi)儲存脂肪的釋放和能量利用��,促進脂肪儲存��。本研究觀察到��,與對照組相比��,20 µg ml-1 QD-INS-CS/GS 與 OP50 大腸桿菌(大腸桿菌)以 1:1 的比例混合 24 小時的高劑量會增加前部脂肪儲存(圖 3d,e)。
圖3 十二指腸外植體對 QD-INS(488)-CS/GS 的吸收率
【納米載體提高了小鼠的生物利用度和療效】
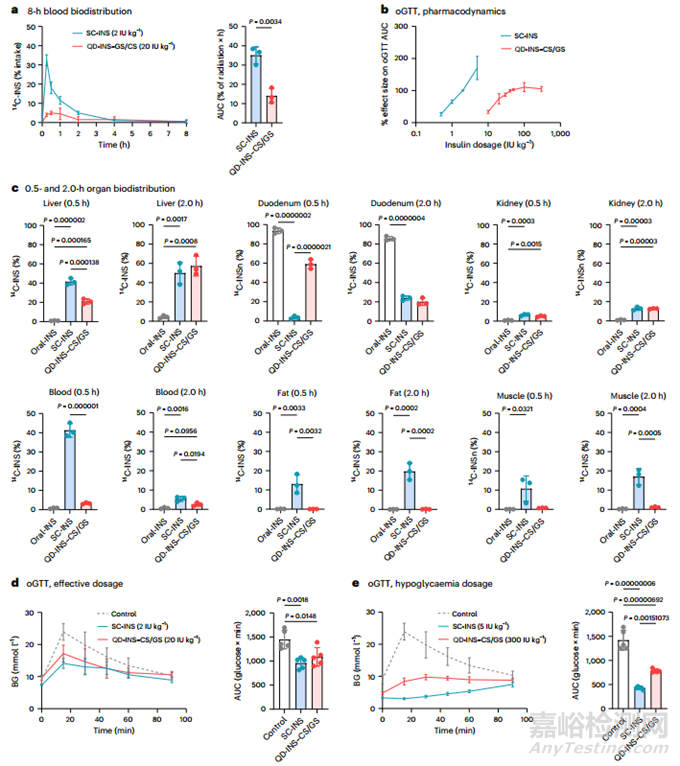
使用 14C-INS 評估了皮下注射胰島素(SC-INS)和口服 QD-INS-CS/GS (20 IU kg-1)的生物分布。在 C57BL/6J 小鼠體內(nèi)��,QD-INS-CS/GS 的 Cmax 值為 0.06 IU ml-1��,Tmax 值為 0.5 小時��,T½ 值為 0.5 小時��;相比之下��,SC-INS(2 IU kg-1)的 Cmax 值為 0.1 IU ml-1��,Tmax 值為 0.25 小時��,T½ 值為 0.25 小時。根據(jù)血藥濃度計算��,口服 QD-INS-CS/GS 的生物利用度為 4%(圖 4a)��。
本研究還關(guān)注了 SC-INS��、QD-INS-CS/GS 和不含納米技術(shù)的口服胰島素(Oral-INS)在全血、肝臟��、肌肉��、脂肪、十二指腸��、腎臟和脾臟中的分布情況��。0.5 小時后��,SC-INS 在血液��、肝臟和肌肉/脂肪中的分布比例分別為 40%��、40% 和 20%(圖 4b)。相比之下��,QD-INS-CS/GS 在肝臟的分布比例為 20%��,在腸道的分布比例為 60%(圖 4c)。2 小時后��,SC-INS 和 QD-INS-CS/GS 在肝臟��、小腸和腎臟的分布比例分別為 50%��、20% 和 10%��。SC-INS在肌肉和脂肪中的分布更多��,而QD-INS-CS/GS則只針對肝臟��?�?诜?INS 仍留在小腸中��。
通過口服葡萄糖耐量試驗(oGTT)和口服葡萄糖前 15 分鐘用 SC-INS 和口服 QD-INS-CS/GS 進行預(yù)處理,本研究關(guān)注了 C57BL/6J 小鼠的藥效學(xué)效應(yīng)��。SC-INS(2 IU kg-1)和口服 QD-INS-CS/GS(20 IU kg-1)對 oGTT 曲線下面積(AUC)的降低作用相似(圖 4d)��。注射和口服胰島素都出現(xiàn)了劑量依賴性效應(yīng)(圖 4b)��。高劑量(5 IU kg-1)SC-INS 會引起低血糖(血糖 < 3.0 mmol l-1),而口服胰島素即使在 300 IU kg-1 的劑量下也不會引起低血糖(圖 4e)��。QD-INS-CS/GS 的單個成分(QD��,0.6 µg;胰島素��,20 IU kg-1;CS/GS��,10 µg)也通過 oGTT 進行了檢測��。沒有觀察到單個材料或單獨口服胰島素(100 IU kg-1)對 AUC 有任何影響��。
圖4 單劑量 SC-INS、QD-INS-CS/GS 和單獨口服胰島素的藥代動力學(xué)和藥效學(xué)研究
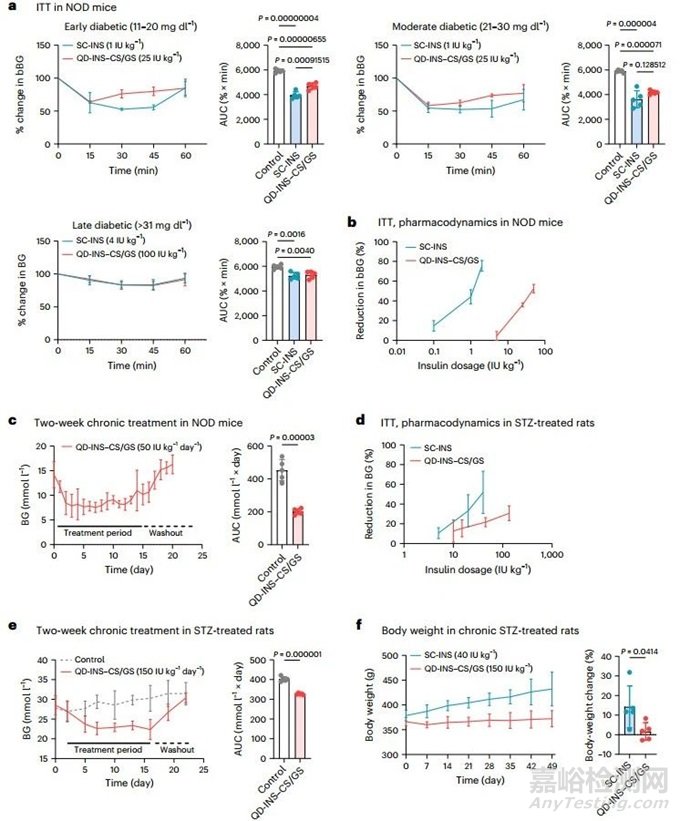
【胰島素納米載體在 T1D 動物模型中發(fā)揮療效】
本研究在以下 T1D 動物模型中比較了 SC-INS 和 QD-INS-CS/GS 單劑量和/或慢性治療的藥理作用:非肥胖糖尿?�。∟OD)小鼠(自身免疫誘導(dǎo)的 T1D)和接受鏈脲佐菌素(STZ)(單劑量 65 mg kg-1)治療的大鼠(毒素誘導(dǎo)的 T1D)。在 NOD 小鼠中��,SC-INS(1 IU kg-1)和 QD-INS-CS/GS(25 IU kg-1)都能在 15 分鐘內(nèi)降低血糖��,并使 ITT AUC 降低 40%(圖 5a)。隨著劑量的增加��,這兩種藥物的血糖降低也呈現(xiàn)劑量依賴性(圖 5b)��。慢性 2 周 SC-INS 給藥或在飲用水中自由給藥 QD-INS-CS/GS 表明��,QD-INS-CS/GS 可在治療期間維持血糖小于 11.1 mmol l-1��。這種效應(yīng)在 7 天的沖洗期后逆轉(zhuǎn)(圖 5c)��。經(jīng) SC-INS 治療的小鼠在治療后 1 小時血糖下降,隨后在治療后 8 小時恢復(fù)到基線水平��。在重度糖尿病 STZ 大鼠(血糖 > 30 mmol l-1)中��,注射胰島素和口服胰島素對血糖的降低具有相似的劑量依賴性(圖 5d)��。慢性用藥是通過使用 SC-INS 或在飲用水中自由給藥 QD-INS-CS/GS 進行為期 2 周的治療��。在治療期間��,QD-INS-CS/GS 可將血糖維持在 15-25 mmol l-1 的較低水平��,而在 3 天的沖洗期后��,這種效應(yīng)消失(圖 5e)��。持續(xù) 6 周的治療表明,SC-INS 大鼠的體重增加了 30%��,而接受 QD-INS-CS/GS 治療的小鼠體重沒有變化(圖 5f)��。這些大鼠的血清生化或血脂也沒有變化。
圖5 在 NOD 小鼠和 STZ 治療大鼠中使用 SC-INS 和 QD-INS-CS/GS(口服胰島素)進行單劑量和 2 周每日治療的藥效學(xué)研究
【胰島素納米載體在非人靈長類動物中發(fā)揮療效】
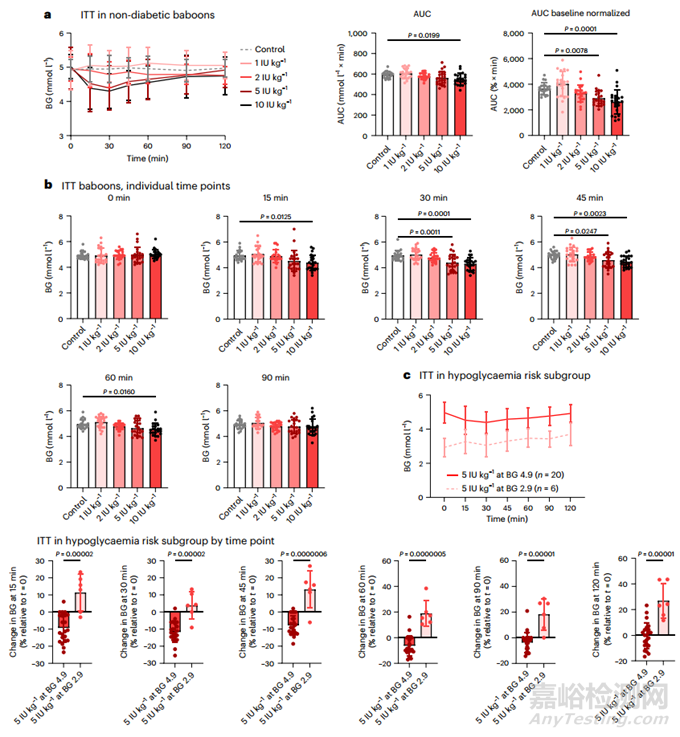
為了檢驗 QD-INS-CS/GS 在臨床應(yīng)用中的有效性和準(zhǔn)備情況,本研究對來自美國國家狒狒群落的非糖尿病狒狒進行了研究,BG 和毒性數(shù)據(jù)收集工作均獨立進行��。每只狒狒都在一夜禁食后進行了 ITT��;在基線和口服 1-10 IU kg-1 胰島素后收集數(shù)據(jù)(圖 6a)��。使用 5 和 10 IU kg-1 的 QD-INS-CS/GS 治療可使血糖分別下降 10% 和 13%��,在 15-30 分鐘內(nèi)即可觀察到效果(圖 6a)��。即使在初始血糖為 2.9 mmol l-1 的狒狒子群中��,單次劑量為 5 IU kg-1 的 QD-INS-CS/GS 也不會導(dǎo)致任何狒狒出現(xiàn)低血糖。對血糖為 4.9 mmol l-1 的狒狒施用相同劑量可使血糖降低 10%(圖 6c)。試驗后進行的血液生化��、血脂和血液學(xué)評估顯示��,沒有超出參考范圍的變化��。此外,未報告任何不良事件,包括任何低血糖發(fā)作��。
圖6 非糖尿病狒狒的 ITT
2. 總結(jié)與展望
總之��,胰島素與帶有 CS/GS 聚合物涂層的 Ag2S QDs 共軛過程在 CSIRO 的生產(chǎn)過程簡單且具有可重復(fù)性��。該產(chǎn)品促進了胰島素的口服吸收和肝臟靶向性��。在小鼠、大鼠和狒狒身上��,該產(chǎn)品顯示出劑量依賴性效應(yīng)��,低血糖發(fā)生率降低��,且無毒性��。這些研究為在人體中評估這種制劑��、正在進行的毒性和臨床研究奠定了基礎(chǔ)。這項技術(shù)旨在成為口服多肽給藥的平臺��。它適用于作用于肝臟(如干擾素-α)或其他器官(如胰腺的胰高血糖素樣肽-1 促效劑(利拉魯肽))的多肽和蛋白質(zhì)��。
文章來源:https://www.nature.com/articles/s41565-023-01565-2