摘 要 / Abstract
隨著現(xiàn)代生物技術(shù)的快速發(fā)展及其在制藥領(lǐng)域的應(yīng)用�����,生物制品在藥物研發(fā)中的地位日益突顯�����。目前�,為滿足更多的臨床需求,除傳統(tǒng)的生物制品外���,應(yīng)用新技術(shù)的生物制品也在開發(fā)和探索階段���。本文綜述了生物制品的發(fā)展現(xiàn)狀,并以抗體類藥物���、疫苗類產(chǎn)品�、血液制品及細(xì)胞和基因治療產(chǎn)品為例���,結(jié)合我國監(jiān)管科學(xué)的發(fā)展���,概述了相關(guān)類別生物制品的國內(nèi)外研發(fā)現(xiàn)狀及發(fā)展趨勢,并對開發(fā)相關(guān)產(chǎn)品的優(yōu)勢和挑戰(zhàn)進(jìn)行了剖析�。
With the rapid development of modern biotechnology and its increasing application in the pharmaceutical field, the significance of biologics in drug research and development has become more pronounced. At present, in order to meet expanding clinical demands, there is ongoing development and exploration of biologics using new technologies, in addition to traditional biologics. This paper provides an overview of the development status of biologics, focusing on categories such as antibody drugs, vaccine products, blood products, cell and gene therapy products. It combines the progress in regulatory science in China, summarizing the research and development status and trends of related biologics at home and abroad was summarized. The paper also analyzes the advantages and challenges of developing these products.
關(guān) 鍵 詞 / Key words
生物制品; 研發(fā)現(xiàn)狀; 發(fā)展趨勢;抗體類藥物�;疫苗
biologics; research and development; status and trend; antibody agents; vaccine
1�、生物制品發(fā)展現(xiàn)狀
(一)全球生物制品市場發(fā)展規(guī)模
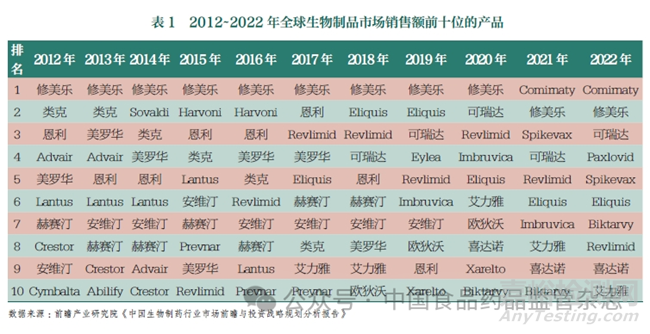
隨著生物制藥技術(shù)尤其是重組技術(shù)等新技術(shù)的發(fā)展���,生物制品的市場規(guī)模在全球范圍內(nèi)均呈現(xiàn)持續(xù)增長的趨勢�����。據(jù)統(tǒng)計�,2022 年全球醫(yī)藥產(chǎn)品市場規(guī)模超過1.4 萬億美元�����,其中生物制品產(chǎn)業(yè)占比逐年增長���,從2016年的2202 億美元上升至2022年的3654 億美元�,在全球醫(yī)藥市場的占比超過20%���,復(fù)合年增長率達(dá)7.3%。據(jù)相關(guān)醫(yī)藥數(shù)據(jù)平臺整理的2021 年全球藥品銷售情況�, 在排名前100 位的藥品中生物制品占55 個,銷售額占比高達(dá)64%���。本文列舉了2012~2022 年全球生物制品市場銷售額前十位的產(chǎn)品�����,見表1���。
(二)我國生物制品發(fā)展現(xiàn)狀
1. 國家大力支持鼓勵生物制藥發(fā)展
近年來�����,我國高度重視生物醫(yī)藥的發(fā)展���,制定并出臺了多項政策予以扶持。2021 年12 月工業(yè)和信息化部等九部門聯(lián)合印發(fā)的《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》提出�����,要重點提升新型生物藥生產(chǎn)技術(shù)�����、提高疫苗應(yīng)急研發(fā)生產(chǎn)能力�。2022 年5 月,國家發(fā)展改革委印發(fā)我國首部生物經(jīng)濟五年規(guī)劃《“十四五”生物經(jīng)濟發(fā)展規(guī)劃》���,確立了到2025 年生物經(jīng)濟規(guī)?����?偭窟~上新臺階的發(fā)展目標(biāo)�����。2022 年10 月�����,黨的二十大報告提出了推進(jìn)健康中國建設(shè)�����,深化醫(yī)藥衛(wèi)生體制改革的要求�。2023年《政府工作報告》中再次提出,要推進(jìn)疫苗迭代升級和新藥研制���。各相關(guān)部門結(jié)合自身職能�����,制定了鼓勵生物制品產(chǎn)業(yè)發(fā)展的具體政策和措施。在多項利好政策的助力下�,我國生物制品發(fā)展規(guī)??焖僭鲩L���,2022 年我國生物制品市場規(guī)模已經(jīng)達(dá)到4493 億元�����,中商產(chǎn)業(yè)研究院預(yù)計到2023 年將達(dá)到5347 億元�����。
2015 年《國務(wù)院關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》發(fā)布���,其鼓勵藥品研發(fā)創(chuàng)新,促進(jìn)藥品高質(zhì)量發(fā)展���。自2015 年以來藥品審評審批制度具體改革措施包括:完善藥品注冊法規(guī)�����,推進(jìn)《疫苗管理法》出臺及《藥品管理法》制修訂�����;優(yōu)化注冊審批流程�,完善《藥品注冊管理辦法》及配套文件,建立突破性治療���、優(yōu)先審評審批程序���、附條件批準(zhǔn)程序、特別審批程序等加快藥品上市的制度���;加強全過程溝通交流���,建立多維度溝通交流機制;加強受理�����、審評�、核查、檢驗等各環(huán)節(jié)協(xié)調(diào)�����,提高審評質(zhì)量和效率���;推進(jìn)監(jiān)管科學(xué)研究�,包括針對新的研發(fā)生態(tài)轉(zhuǎn)化為“新工具�����、新標(biāo)準(zhǔn)�、新方法”等,頒布通用型技術(shù)指南和個藥技術(shù)指南數(shù)百份���;促進(jìn)境內(nèi)外產(chǎn)品同步研發(fā)和申報���,推動監(jiān)管標(biāo)準(zhǔn)與國際接軌。
2. 生物制品研發(fā)申報情況
根據(jù)近3 年國家藥品監(jiān)督管理局藥品審評中心公開的審評報告�,2019~2021 年我國生物制品申請受理量呈上升趨勢,年均增長約26% �����;2021 年需技術(shù)審評的生物制品受理量約為2019年的2 倍�;生物制品建議批準(zhǔn)量每年呈上升趨勢,年均增長約29% �;2021 年的建議批準(zhǔn)量約為2019 年的2.16 倍。根據(jù)《藥品附條件批準(zhǔn)上市申請審評審批工作程序(試行)》���,截至2022年9 月30 日�����,已附條件批準(zhǔn)68個品種�,其中生物制品附條件批準(zhǔn)25 個品種,涉及38 個適應(yīng)癥���。本文匯總了2022 年我國批準(zhǔn)的生物制品創(chuàng)新藥�,見表2���。
2�、生物制品的研發(fā)情況
近年來�����,隨著生物制品技術(shù)不斷升級�,以抗體類藥物、核酸藥物���、細(xì)胞和基因治療產(chǎn)品為代表的新一代生物技術(shù)產(chǎn)品逐步成熟�����。據(jù)統(tǒng)計�����, 目前全球有超過1000 個新的生物制品在開展臨床研究�,適應(yīng)癥主要集中在腫瘤���、免疫���、感染、心血管等疾病領(lǐng)域�。
(一)抗體類藥物
抗體類藥物是目前全球生物制品市場中規(guī)模最大的類別,因其能夠特異性結(jié)合相關(guān)抗原���,靶向性強�����、臨床療效確切�、不良反應(yīng)小���,因此發(fā)展十分迅速�。抗體類藥物通常分為單克隆抗體(單抗)�����、雙特異性抗體(雙抗)���、基因工程抗體片段[ 如納米抗體�、單鏈可變區(qū)片段(single-chain variable fragment�,scFvs)等]。此外�����,有的抗體還可與小分子偶聯(lián)�����,制備成兼具靶向性和細(xì)胞毒性的抗體偶聯(lián)藥物(antibody drug conjugate�����,ADC)���, 抗體按照人源化程度的不同�,又可分為鼠源性單克隆抗體、嵌合性單克隆抗體�����、人源化單克隆抗體和全人源單克隆抗體�。隨著近年來抗體藥物制備技術(shù)的迅速發(fā)展,單抗�����、雙抗�����、ADC 等技術(shù)的突破為抗體藥物開拓了更寬廣的發(fā)展空間���。
據(jù)《2024-2029 年中國生物制藥產(chǎn)業(yè)前景預(yù)測及投資研究報告》,在近8 年間�����,全球抗體藥物市場均保持著10% 以上的增速�����,并在2021 年首次突破2000 億美元, 與2020 年相比增長16.5%���, 其中有23 個品種銷售額超30 億美元�。自1986 年首個治療性抗體莫羅單抗CD3(muromonab-CD3)被批準(zhǔn)上市以來[1]�,美國食品藥品監(jiān)督管理局(Food and Drug Administration,F(xiàn)DA) 累計批準(zhǔn)了121 個抗體藥物�����,包括12 個ADC 藥物�、4 個雙抗藥物和105個單抗藥物,主要集中在腫瘤和自身免疫疾病領(lǐng)域���,并延伸至神經(jīng)系統(tǒng)���、眼科、心血管疾病等領(lǐng)域�����。
1. 單克隆抗體藥物的發(fā)展態(tài)勢
我國抗體產(chǎn)業(yè)起步較晚���,但自1999 年我國首個單抗藥物注射用抗人T 細(xì)胞CD3 鼠單抗獲批上市[2]�,距今已發(fā)展20 多年,目前已進(jìn)入快速發(fā)展的成長期�。
隨著抗體藥物臨床研究不斷推進(jìn)、產(chǎn)品商業(yè)化策略不斷完善���,截至目前�����,我國已批準(zhǔn)上市60 個國產(chǎn)抗體藥物(其中25 個創(chuàng)新藥)���,58 個進(jìn)口抗體藥物�����。隨著眾多單抗生物類似藥的上市�,生物類似藥市場將迎來爆發(fā)式增長。
2. 雙特異性抗體藥物的發(fā)展態(tài)勢
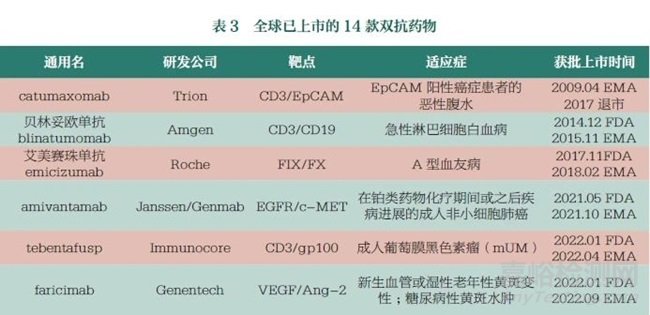
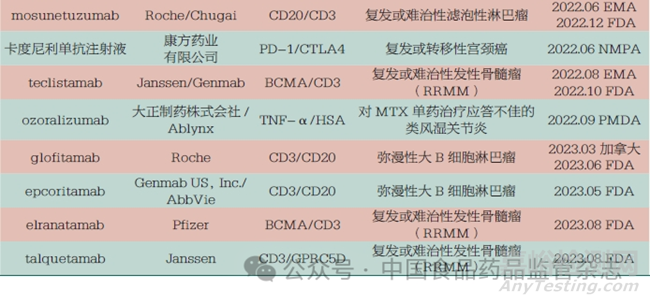
2022 年���,全球雙抗藥物的獲批數(shù)量顯著增長���,共有6 款雙抗藥物獲批上市;截至2023 年9 月���,共計14 款雙特異性抗體藥物獲批上市���,其中包含1 款國產(chǎn)雙抗�,即康方藥業(yè)有限公司的卡度尼利單抗注射液(商品名:開坦尼)�����,見表3�����。經(jīng)過60 多年的發(fā)展���,雙特異性抗體具備了一定的市場規(guī)模���,近幾年雙抗藥物已成為國內(nèi)外制藥企業(yè)的重要研發(fā)管線,熱度持續(xù)攀升�����。
目前�����,全球有超過10 款雙抗藥物處于上市申請及Ⅲ期臨床試驗階段,我國至少有3 款雙抗產(chǎn)品處于Ⅲ期臨床試驗階段�����。此外���,三抗�����、四抗藥物的研發(fā)也已在路上�,參與研發(fā)的公司包括境外的賽諾菲���、強生�、Harpoon 等�,以及我國的浙江道爾生物科技有限公司�、嘉和生物藥業(yè)有限公司等多家制藥企業(yè),四川百利藥業(yè)集團(tuán)甚至已經(jīng)開展五抗藥物的研發(fā)�����。
3. ADC 的發(fā)展態(tài)勢
據(jù)Grand View 研究機構(gòu)的數(shù)據(jù),2015~2020 年全球ADC市場規(guī)模的年復(fù)合增長率為32.9%���,2021~2025 年的年復(fù)合增長率將達(dá)到53.0%�����。隨著ADC 技術(shù)的變革�,抗體精準(zhǔn)靶向�����,連接子(linker)定點偶聯(lián)技術(shù)進(jìn)一步優(yōu)化�,未來該類產(chǎn)品的滲透率將進(jìn)一步增加,市場規(guī)模還會持續(xù)增長���,2020 年ADC 產(chǎn)品全球市場規(guī)模約25 億美元�����,2025年預(yù)計將增至211 億美元�����。
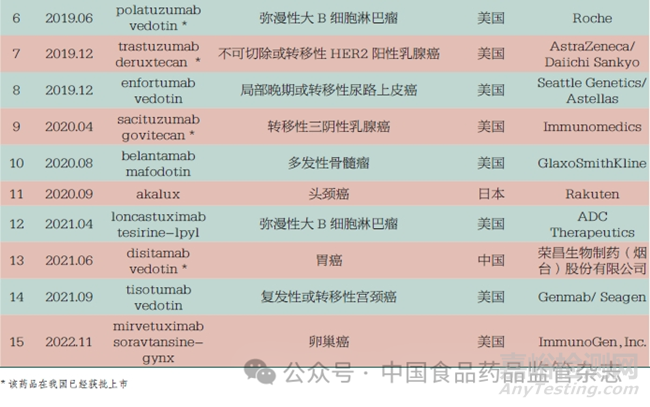
截至2022 年底���,全球已有15 款A(yù)DC 獲批上市�����,治療領(lǐng)域集中在實體瘤和血液瘤�����,如乳腺癌�����、宮頸癌���、彌漫性大B 細(xì)胞淋巴瘤。2020 年至今���,我國共計7款A(yù)DC 獲批上市�����,其中榮昌生物制藥(煙臺)股份有限公司的注射用維迪西妥單抗( 商品名: 愛地希) 是我國自主研發(fā)的一款靶向HER2 的抗體偶聯(lián)藥物,見表4�。
4. 抗體類藥物靶點分布
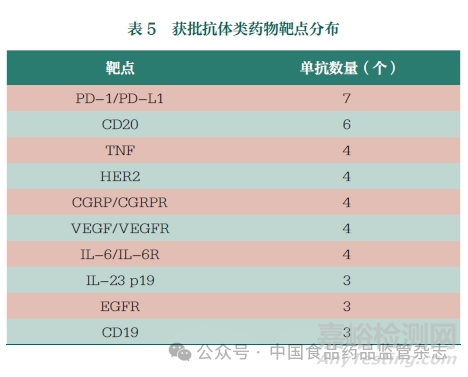
截至2022 年6 月30 日,全球已批準(zhǔn)和上市的抗體藥物共162 種,使用抗體療法的優(yōu)勢源于其高選擇性和優(yōu)秀的抗原結(jié)合親和力[2]�。相比于其他疾病的治療靶點,癌癥和免疫相關(guān)疾病的治療靶點�����, 如PD-1/PD-L1���、CD20�、腫瘤壞死因子(TNF)-α�����、HER2 和CD3 等將更多地被投入研究[3]���。目前�����,已批準(zhǔn)的抗體療法主要是為治療癌癥和免疫相關(guān)疾病適應(yīng)癥而開發(fā)�����。本文列舉了已經(jīng)獲批抗體類藥物的主要靶點分布情況�,見表5。
目前�����,我國抗體藥物研發(fā)也主要集中在抗腫瘤和免疫調(diào)節(jié)兩個領(lǐng)域�, 抗體藥物研究的熱門靶點主要包括PD-1/PD -L1、TNF-α�、血管內(nèi)皮生長因子(VEGF)、HER2�、CD20 和表皮生長因子受體(EGFR) 等,均已有多家藥品企業(yè)的相關(guān)抗體藥物上市或處于上市審批中�����,我國已逐漸成為抗體藥物在研數(shù)量最多的國家和地區(qū)之一�。
5. 抗體類藥物的未來研發(fā)方向
雖然在國家政策的支持下,我國治療性抗體藥物產(chǎn)業(yè)迅猛發(fā)展���,抗體藥物品種和市場規(guī)模持續(xù)增長���,但是抗體藥物的研發(fā)依然存在著研究扎堆、創(chuàng)新不足等問題[4]�����。因此���,建議我國治療性抗體藥物企業(yè)���,首先應(yīng)著眼于對疾病的發(fā)病機制和抗體作用機制的深入了解,從而選擇合適的藥物靶點�,研制具有自主知識產(chǎn)權(quán)的創(chuàng)新型抗體藥物。其次�,抗體藥物的免疫原性與臨床療效密切相關(guān)。免疫原性較強的抗體藥物���,尤其是采用動物來源制備的抗體藥物(如早期采用鼠腹水制備的等)容易引起嚴(yán)重的不良反應(yīng)���,包括過敏性反應(yīng)、輸液反應(yīng)�、內(nèi)源性免疫球蛋白交叉反應(yīng)、藥物不良事件和藥動學(xué)改變等[5]�。因此,完善抗體技術(shù)�,提高基因工程來源的抗體藥物比例是較為有效的解決方案,通過規(guī)范流程���,可使藥物的生產(chǎn)易于標(biāo)準(zhǔn)化���、規(guī)?��;τ诨蚬こ炭贵w藥物�����,也需在開發(fā)過程中考慮對目的序列�、生產(chǎn)工藝進(jìn)行優(yōu)化,明確序列選擇及工藝等對產(chǎn)品質(zhì)量產(chǎn)生的影響�,合理控制可能導(dǎo)致免疫原性的關(guān)鍵質(zhì)量屬性,以提高工藝的批間一致性�����。
抗體藥物的穩(wěn)定性和溶解度�,同樣也是抗體藥物研發(fā)的方向。高濃度劑型可以減少給藥頻率���、延長藥物作用時間�、降低患者用藥負(fù)擔(dān)�,但開發(fā)高濃度劑型需要解決抗體藥物的穩(wěn)定性和溶解度等問題。例如諾華公司研發(fā)的靶向VEGF 的人源化單鏈抗體片段brolucizumab�, 其通過阻止VEGF 與VEGFR 的結(jié)合���,抑制眼底血管生成,能夠用于治療年齡相關(guān)性黃斑變性(age-related macular degeneration �����,AMD)�。得益于brolucizumab高達(dá)120mg/ml 的溶解度�,其治療摩爾劑量約為同類產(chǎn)品的22倍,減少藥物眼內(nèi)注射頻率�����,提高了患者的依從性[6]�。
多特異性抗體,由于其能夠覆蓋更多的抗原表位���,從而避免位點突變逃逸�����,以減少不良反應(yīng)�����,具有更為廣闊的前景[7]���。但多特異性抗體可能由于具有非天然結(jié)構(gòu)���,導(dǎo)致其穩(wěn)定性降低。此外�����,由于多個位點引入�,可能導(dǎo)致分子量較大,因此對實體瘤的治療效果可能產(chǎn)生影響�����,需要在給藥途徑���、給藥方案或制劑處方等方面針對上述挑戰(zhàn)做出更多探索性和確證性研究�����。
(二)疫苗
1. 國外疫苗市場和研發(fā)情況
據(jù)Evaluate Pharma 的分析�����,國際疫苗市場上GSK�����、默沙東�、輝瑞和賽諾菲4 家企業(yè)憑借產(chǎn)品優(yōu)勢占據(jù)了疫苗市場90% 的份額。從2021 年的銷售額來看�����,除新冠疫苗外�����,銷售前三位的為默沙東的人乳頭瘤病毒(HPV)疫苗���,輝瑞的13 價肺炎球菌多糖結(jié)合疫苗以及賽諾菲巴斯德的流感疫苗。
截至2022 年12 月底���, 全球正在研發(fā)的候選疫苗達(dá)966種���, 主要集中在美國、中國和西歐。研發(fā)品種集中在:新冠病毒(246 種�,25%);流感病毒(104 種���,11%)�;艾滋病病毒( 84種�,9%)。另外�,猴痘疫苗、呼吸道合胞病毒(RSV)疫苗���、埃博拉疫苗�、肺炎疫苗�、帶狀皰疹疫苗等也是研究比較集中的幾類疫苗。從技術(shù)路線看�,歐盟和美國以核酸疫苗和病毒載體疫苗為主;我國以滅活疫苗較多���,核酸疫苗和病毒載體疫苗相對較少�����;以mRNA 疫苗為代表的第三代核酸疫苗新技術(shù)的成功應(yīng)用及產(chǎn)業(yè)化成為疫苗研發(fā)史上的里程碑事件[8]�。
2. 我國疫苗市場和研發(fā)情況
近年來疫苗在我國醫(yī)藥市場的占比呈穩(wěn)步上升趨勢,尤其是在新冠疫情的暴發(fā)���、疫苗技術(shù)創(chuàng)新的推動下�����,據(jù)《中國疫苗行業(yè)市場前景及投資機會研究報告》���,我國疫苗市場由2016 年的240億元增加至2021 年的760 億元(新冠疫苗除外)。隨著高附加值的疫苗國產(chǎn)大品種包括13 價肺炎球菌多糖結(jié)合疫苗�����、HPV 疫苗等的逐步上市以及在公眾疫苗接種意識提高�����、國家免疫規(guī)劃擴大等因素的驅(qū)動下���,未來我國疫苗產(chǎn)業(yè)規(guī)模還將持續(xù)增加,疫苗研發(fā)更多地轉(zhuǎn)向成人疫苗�。
政策利好釋放, 創(chuàng)新疫苗申報量及批準(zhǔn)量不斷加大���。2020~2022 年���,國家藥監(jiān)局批準(zhǔn)疫苗產(chǎn)品上市(以藥品批準(zhǔn)文號計)數(shù)目為7~15 個���。2023 年僅1~9 月就批準(zhǔn)上市疫苗13 個。另外�,值得關(guān)注的是,2021~2023年9 月�,國家藥監(jiān)局共批準(zhǔn)74個產(chǎn)品的臨床試驗申請(含不同規(guī)格),其中九價腸外致病性大腸埃希菌疫苗�����、MVA-BN-RSV疫苗���、重組RSV 疫苗(AS01E佐劑系統(tǒng))�、二價腸道病毒滅活疫苗(Vero 細(xì)胞)���、凍干人用CpG佐劑狂犬病疫苗(Vero 細(xì)胞)等均是采用全新技術(shù)的創(chuàng)新疫苗�����。
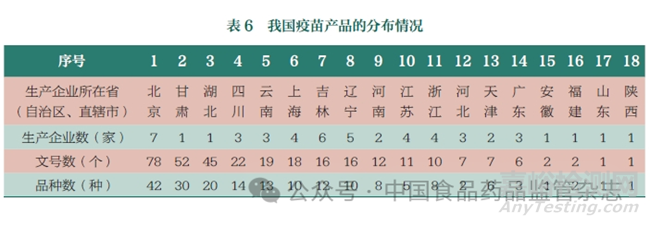
從疫苗產(chǎn)品的地域分布情況來看���,疫苗生產(chǎn)主要涉及18個?。ㄗ灾螀^(qū)�、直轄市),其中有52 家生產(chǎn)企業(yè)投入疫苗的生產(chǎn)�,北京、吉林�、遼寧生產(chǎn)企業(yè)數(shù)量最多,分別為7 家���、6 家�、5家�;北京、甘肅�、湖北的生產(chǎn)企業(yè)生產(chǎn)疫苗品種數(shù)較多,見表6�����。
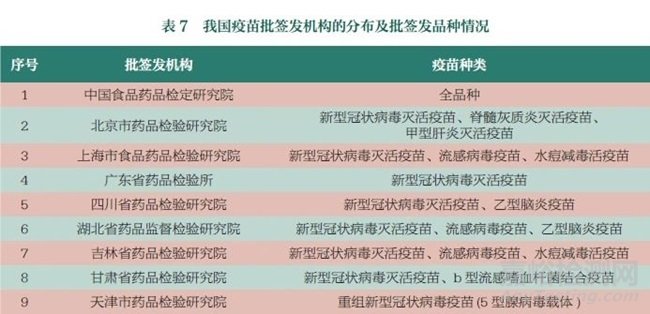
2018~2022 年我國疫苗批簽發(fā)品種和數(shù)量均保持穩(wěn)中有升態(tài)勢�����,批簽發(fā)數(shù)量在5000~6300 批���、5.37 億劑~6.35 億劑�。2022 年�����,各級機構(gòu)共計批簽發(fā)57 個疫苗品種�。隨著投入疫苗生產(chǎn)的企業(yè)增加,疫苗批簽發(fā)機構(gòu)授權(quán)范圍也逐步擴大�,目前已授權(quán)中國食品藥品檢定研究院和北京、上海���、四川等18 家省級檢驗機構(gòu)承擔(dān)指定品種的疫苗批簽發(fā)工作���,見表7?��!?/span>
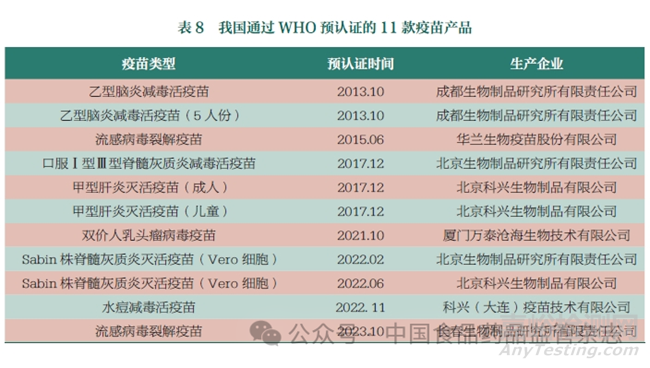
2022 年8 月23 日���, 世界衛(wèi)生組織(World Health Organization,WHO) 宣布我國再次通過疫苗國家監(jiān)管體系(National Regulatory Authority���,NRA)評估�。這彰顯了我國疫苗監(jiān)管體系已經(jīng)能夠?qū)?biāo)國際前沿標(biāo)準(zhǔn)���,疫苗產(chǎn)品的安全性�����、有效性得到保障且質(zhì)量可控���,為我國疫苗產(chǎn)品出口奠定了基礎(chǔ)。從2013 年開始�,我國共計7 家企業(yè)11 款產(chǎn)品通過WHO的疫苗預(yù)認(rèn)證(表8),標(biāo)志著我國疫苗產(chǎn)品的監(jiān)管�、研制和生產(chǎn)體系以及產(chǎn)品質(zhì)量獲得了國際認(rèn)可,極大地推動了我國疫苗企業(yè)國際化進(jìn)程�。
3. 新冠疫情與新冠疫苗對傳統(tǒng)疫苗的影響和改變
根據(jù)WHO 公布的數(shù)據(jù),截至2023 年3 月�����,全球在研的新冠疫苗共計382 個�����, 其中183個進(jìn)入臨床研究�,53 個被批準(zhǔn)上市或緊急使用;疫苗類型包括mRNA 疫苗�����、滅活疫苗�、腺病毒載體疫苗和重組亞單位疫苗等。全球針對一種病原體�����、由多個國家和地區(qū)第一時間啟動多條技術(shù)路線開展疫苗研發(fā)尚屬歷史首次�。
在新冠疫情的影響下,我國疫苗研發(fā)格局發(fā)生了巨大變化�����。首先���,從技術(shù)層面來看,我國疫苗研發(fā)已呈現(xiàn)由跟隨性向原創(chuàng)性轉(zhuǎn)變���,傳統(tǒng)滅活疫苗技術(shù)處于國際領(lǐng)先水平�,重組蛋白和病毒載體疫苗領(lǐng)域?qū)崿F(xiàn)了與國際并跑,mRNA 技術(shù)�、新型佐劑疫苗等雖與國際水平還存在一定差距,但已初步具備產(chǎn)業(yè)化能力�����。其次�,從疫苗產(chǎn)業(yè)層面來看���,我國疫苗產(chǎn)業(yè)效率、產(chǎn)能���、配套均得到全方位提升;多家傳統(tǒng)生物制品企業(yè)及新創(chuàng)企業(yè)進(jìn)入疫苗領(lǐng)域�����;疫苗企業(yè)生產(chǎn)趨向大規(guī)模�����、高質(zhì)量�,且產(chǎn)能大幅提高;疫苗產(chǎn)業(yè)配套政策等得到全方位提升�,原輔料及設(shè)備國產(chǎn)化提速,批簽發(fā)及冷鏈能力建設(shè)提升�����。第三�����,我國疫苗的國際化整體進(jìn)程加快�,相關(guān)企業(yè)積極參與到全球突發(fā)公共衛(wèi)生事件防控及市場競爭中�。3 家企業(yè)的疫苗被納入WHO 應(yīng)急使用清單。截至2022 年5 月�����,我國累計向153 個國家和地區(qū)以及15 個國際組織提供了22 億劑新冠疫苗[9] ���;通過在境外建設(shè)疫苗工廠�����,推動了我國疫苗企業(yè)走向國際化�����;通過在境外開展臨床試驗�,推動了我國疫苗評價標(biāo)準(zhǔn)與國際標(biāo)準(zhǔn)的融合。
在保障企業(yè)快速發(fā)展成長的過程中���,國家藥品監(jiān)管部門堅持以推動疫苗的快速研發(fā)為導(dǎo)向���,建立了科學(xué)高效的監(jiān)管科學(xué)體系,有力助推了新冠疫苗的快速研發(fā)�����,監(jiān)管能力和水平得到有力提升并經(jīng)受了實踐考驗�����。我國自2005年出臺《國家食品藥品監(jiān)督管理局藥品特別審批程序》以來���,在甲型流感疫苗、脊髓灰質(zhì)炎滅活疫苗中多次啟動���,在應(yīng)對全球流感大流行�、全球消滅脊髓灰質(zhì)炎行動( global polio eradication initiative,GPEI) 等突發(fā)公共衛(wèi)生事件中發(fā)揮了重要作用�,相關(guān)經(jīng)驗還納入到了《疫苗管理法》框架中。此次�����,針對新冠疫情等全球應(yīng)急狀態(tài)下疫苗及治療用生物制品的研發(fā)�����,我國按照統(tǒng)一指揮�����、早期介入�、快速高效���、科學(xué)審批的原則�����,對突發(fā)公共衛(wèi)生事件應(yīng)急處理所需藥品進(jìn)行特別審批�����。技術(shù)標(biāo)準(zhǔn)先行���,檢驗�����、核查�����、審評并行�����,申報資料滾動提交�,臨床試驗無縫設(shè)計�����,接受境外數(shù)據(jù)�����,實現(xiàn)遠(yuǎn)程核查���,采用附條件批準(zhǔn)上市���,并將加快程序運行至包括上市后變更的全生命周期監(jiān)管中�����,以滿足短期內(nèi)公眾的接種需求�。
4. 未來疫苗的發(fā)展方向
目前�,病毒載體技術(shù)、新型佐劑�、mRNA 技術(shù)�����、反向遺傳學(xué)等疫苗新技術(shù)的應(yīng)用已拓展至許多大品種�,包括RSV 疫苗、登革熱疫苗�����,尚未攻克的艾滋?��。℉IV)疫苗���、巨細(xì)胞病毒疫苗�����、諾如病毒疫苗�����,以及許多治療性疫苗和腫瘤疫苗等���。
經(jīng)歷多次疫苗技術(shù)革命,我國疫苗產(chǎn)業(yè)的未來發(fā)展將更聚焦臨床急需�,加強疫苗開發(fā)的規(guī)范化、創(chuàng)新化���、規(guī)?����;?����、集約化和國際化�,具體表現(xiàn)為:①我國將加速聯(lián)合疫苗的研發(fā)上市,包括境外已上市的以百白破三聯(lián)疫苗(DTaP)���、麻腮風(fēng)三聯(lián)疫苗(MMR)等為基礎(chǔ)的聯(lián)合疫苗�, 及其他可能提高臨床適用性���、依從性的新型聯(lián)合疫苗的研發(fā)�����,鼓勵倡導(dǎo)研制及使用多聯(lián)疫苗產(chǎn)品�����。②對標(biāo)國際先進(jìn)技術(shù)和標(biāo)準(zhǔn),加快疫苗已上市產(chǎn)品的升級換代�����,例如多糖蛋白結(jié)合疫苗�、病毒樣顆粒疫苗等,進(jìn)一步提升疫苗的安全性和有效性�。③結(jié)合我國傳染病特點,布局創(chuàng)新疫苗品種及技術(shù)路線�,并進(jìn)行國內(nèi)傳染病���、醫(yī)院感染及耐藥菌疫苗等研發(fā);根據(jù)WHO 等機構(gòu)對廣譜疫苗的定義更新及人工智能(AI)技術(shù)的發(fā)展�����,加強通用疫苗靶抗原篩選和廣譜疫苗的開發(fā)���。④布局更多的技術(shù)路線�,推動新型蛋白疫苗���、載體疫苗�����、新佐劑疫苗�����、核酸疫苗等技術(shù)路線的研發(fā)���,推動新的制劑技術(shù)、遞呈系統(tǒng)、納米材料���、給藥裝置的平臺�����、AI 藥物設(shè)計等技術(shù)發(fā)展�����;加強平臺技術(shù)發(fā)展及模型株疫苗開發(fā)�,實現(xiàn)新發(fā)突發(fā)傳染病平臺開發(fā)及儲備���;加強黏膜免疫疫苗及新型給藥途徑疫苗的開發(fā)���。⑤以境外進(jìn)入臨床研究或已上市的治療性疫苗為參考,重點關(guān)注腫瘤疫苗�����、慢性病疫苗�����、過敏性疾病疫苗等研發(fā)�。
(三)血液制品
1.國內(nèi)外血液制品市場情況
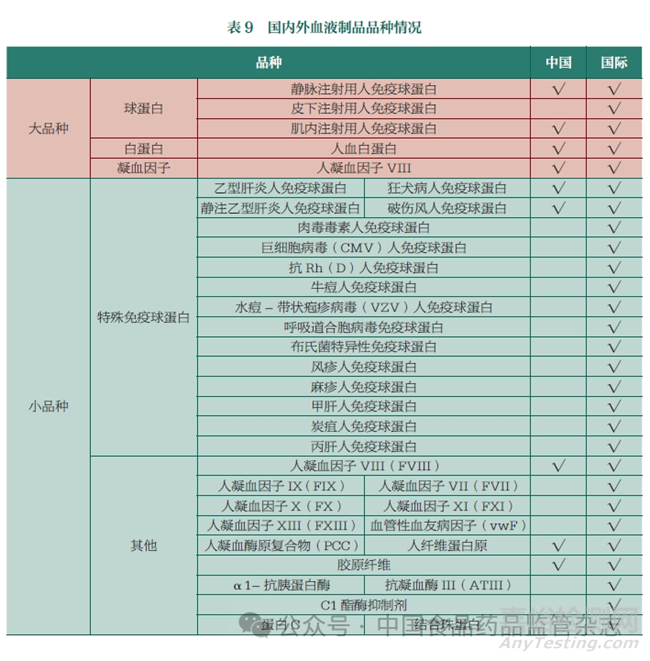
目前,全球已上市的血液制品有36 種���,主要以免疫球蛋白和凝血因子類產(chǎn)品為主�。免疫球蛋白�、凝血因子和白蛋白約占70%的市場份額,其中免疫球蛋白(含特異性免疫球蛋白)約占50%的市場份額���。據(jù)《2022-2027年免疫球蛋白行業(yè)市場深度分析及發(fā)展規(guī)劃咨詢綜合研究報告》���,2022 年全球靜脈注射用人免疫球蛋白市場規(guī)模達(dá)1107.65 億元(人民幣),我國靜脈注射用人免疫球蛋白市場在全球市場約占14.54%�。
目前,我國批準(zhǔn)上市的血液制品共有16 種���,市場上以人血白蛋白和靜脈注射用人免疫球蛋白為主���,人血白蛋白市場份額占據(jù)市場總份額約60% 以上,其中進(jìn)口白蛋白占市場供應(yīng)量的60%�����。目前,市場對于血源制品仍然存在較大需求�����,但血液資源利用率低���。本文總結(jié)了國內(nèi)外血液制品品種的情況(表9)�。
2. 我國血液制品生產(chǎn)情況
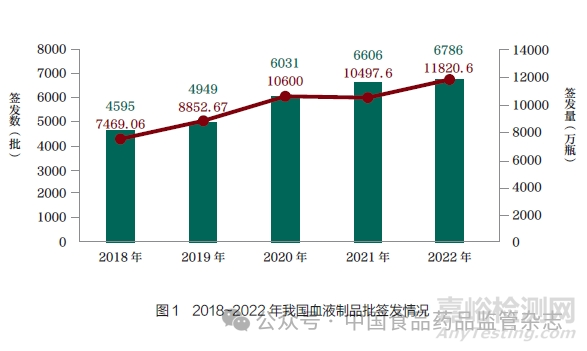
自2007 年6 月1 日起���, 我國開始對人免疫球蛋白產(chǎn)品實施批簽發(fā)���, 至2008 年1 月1 日,所有上市銷售的血液制品均實施批簽發(fā)�����。近5 年�����,每年申請批簽發(fā)種類大概有12~15 種���,血液制品批簽發(fā)數(shù)量也逐年增加�,如圖1所示���。
根據(jù)國家藥監(jiān)局授權(quán)�, 中國食品藥品檢定研究院和9 個?。ㄗ灾螀^(qū)、直轄市)的藥品檢驗機構(gòu)承擔(dān)指定區(qū)域內(nèi)企業(yè)生產(chǎn)的血液制品批簽發(fā)工作���。目前���,我國共有26 家血液制品生產(chǎn)企業(yè), 生產(chǎn)文號達(dá)到204 個���, 見表10�。
3. 我國血液制品未來發(fā)展趨勢
隨著我國醫(yī)療水平的不斷提升���,對血液制品臨床應(yīng)用認(rèn)識的持續(xù)提高�����,以及我國醫(yī)療保障系統(tǒng)不斷完善���,血液制品消費結(jié)構(gòu)將得到優(yōu)化���,其中白蛋白占比將繼續(xù)下降,靜脈注射用人丙免疫球蛋白及特異性免疫球蛋白等產(chǎn)品的投入產(chǎn)出比將得到提升���。蛋白質(zhì)分離純化�、病毒去除/ 滅活工藝�、基因工程等技術(shù)研發(fā)的強化和血漿綜合利用的提高將成為未來技術(shù)發(fā)展的趨勢。我國重組血液制品僅有注射用重組人凝血因子Ⅷ于2023 年9 月獲批上市�,目前尚多依賴于國外進(jìn)口,具有廣闊的研發(fā)前景�。
(四)細(xì)胞和基因治療產(chǎn)品
1.細(xì)胞和基因治療產(chǎn)品的國內(nèi)外市場情況
細(xì)胞和基因治療(cellular and gene therapy, CGT) 是指將確定的遺傳物質(zhì)轉(zhuǎn)移至患者的特定靶細(xì)胞內(nèi)���,通過基因添加�、基因修正���、基因沉默等方式修飾個體基因的表達(dá)或修復(fù)異?;?����,以達(dá)到治愈疾病目的的過程[10]�����。其優(yōu)勢表現(xiàn)為:①個體化治療優(yōu)勢。相比傳統(tǒng)生物制品���,CGT 產(chǎn)品可實現(xiàn)個體化治療,可基于患者個體和病因差異進(jìn)行個體化設(shè)計���。②療效持久�����。細(xì)胞產(chǎn)品在人體內(nèi)可具有一定的擴增和存續(xù)時間�����,基因治療可針對致病機制實現(xiàn)長時間或永久的基因替代�����、補償�����、阻斷和修正療效���。③可實現(xiàn)遺傳病的治愈���。CGT 可在基因水平實現(xiàn)遺傳病的治愈,尤其是單基因遺傳病的治愈的可能�����。④不良反應(yīng)較少�����。與手術(shù)及放療�、化療方法相比,部分CGT 產(chǎn)品的治療周期較短�����,不良反應(yīng)類型少���,程度相對較輕���。全球已經(jīng)批準(zhǔn)30 余款CGT 產(chǎn)品,主要集中在美國和歐洲等國家和地區(qū)���。據(jù)pharmaprojects 數(shù)據(jù)庫�,目前,有近4000 種CGT 產(chǎn)品處于臨床前至上市申請階段���,其中54%的產(chǎn)品為基因治療產(chǎn)品�����,22% 的產(chǎn)品為非基因修飾的細(xì)胞治療產(chǎn)品。在基因治療產(chǎn)品中���,體內(nèi)基因的治療產(chǎn)品占30%�。而在體外基因治療中�,CAR-T 治療產(chǎn)品占據(jù)主導(dǎo)地位,約為46%�����,其中95% 的CAR-T 細(xì)胞藥物的適應(yīng)癥為腫瘤�,其他適應(yīng)癥還包括硬皮病、艾滋病以及自身免疫性疾病等�。本文匯總了當(dāng)前國內(nèi)外已獲批上市的細(xì)胞治療產(chǎn)品,見表11���。
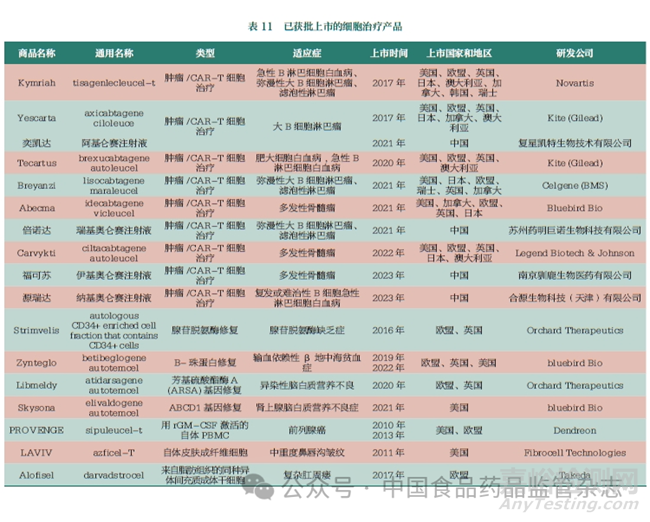
隨著我國細(xì)胞治療產(chǎn)業(yè)政策支持的不斷加強,陸續(xù)發(fā)布了各類細(xì)胞治療相關(guān)的政策法規(guī)�����、技術(shù)規(guī)范和指導(dǎo)原則���,細(xì)胞治療領(lǐng)域迅速發(fā)展�����。對于免疫細(xì)胞治療的發(fā)展�����,從早期以自然殺傷細(xì)胞(natural killer cell,NK) [11]�����、樹突狀細(xì)胞(dendritic cell�����,DC)等研究為主�����,到CAR-T 細(xì)胞療法[12] 成為當(dāng)前的研究熱點�����,全球已批準(zhǔn)15 種免疫細(xì)胞產(chǎn)品上市���,其中10 個為CAR-T 產(chǎn)品�����, 我國已批準(zhǔn)上市4 個�����。
隨著人們在細(xì)胞領(lǐng)域的不斷探索與發(fā)現(xiàn)�����,干細(xì)胞療法逐漸成為再生醫(yī)學(xué)以及慢性病的新療法之一�。根據(jù)市場研究組織Fact.MR 的預(yù)測, 到2023 年�, 全球干細(xì)胞治療市場將達(dá)到389.1億美元�����, 并呈現(xiàn)逐年增長的趨勢。據(jù)ClinicalTrials 統(tǒng)計�����, 截至2023 年10 月�����,全球共開展了7805 項干細(xì)胞臨床研究�����,涉及200 多種適應(yīng)癥�����。目前�����,國際上已批準(zhǔn)21 個干細(xì)胞產(chǎn)品上市���,主要用于治療骨損傷�、心肌梗死等���;我國已批準(zhǔn)23 個干細(xì)胞產(chǎn)品進(jìn)入臨床試驗,但尚無產(chǎn)品獲批上市�。
2. 細(xì)胞和基因治療的研究方向及面臨的挑戰(zhàn)
CGT 已成為全球生物技術(shù)領(lǐng)域最受關(guān)注的新興領(lǐng)域之一,在市場���、政策等因素的驅(qū)動下,我國CGT 產(chǎn)業(yè)發(fā)展勢頭迅猛�����,市場規(guī)模呈指數(shù)級的增長�。然而,與傳統(tǒng)生物制品相比�,CGT 產(chǎn)品�����,尤其是細(xì)胞治療產(chǎn)品在產(chǎn)品生產(chǎn)和臨床使用方面仍面臨較多新的挑戰(zhàn)�����,包括:①部分細(xì)胞治療產(chǎn)品個體化差異明顯�,細(xì)胞來源和產(chǎn)量較為有限,對生產(chǎn)和質(zhì)量控制要求較高�����。②部分細(xì)胞治療產(chǎn)品為新鮮細(xì)胞制劑�,產(chǎn)品效期較短�,對產(chǎn)品質(zhì)控、保存�、運輸和臨床使用要求較高�。③細(xì)胞治療產(chǎn)品作用機制復(fù)雜�����,體外生物學(xué)活性與臨床療效的相關(guān)性較差���,無法良好預(yù)測產(chǎn)品的臨床療效�����。④ CGT 產(chǎn)品相關(guān)的不良反應(yīng)���,如細(xì)胞因子風(fēng)暴、神經(jīng)毒性、基因脫靶風(fēng)險等仍需要進(jìn)一步通過產(chǎn)品設(shè)計和臨床應(yīng)用降低風(fēng)險���。⑤各類CGT 產(chǎn)品的體內(nèi)存續(xù)或療效持續(xù)時間差異較大�����,各類疾病的復(fù)發(fā)風(fēng)險仍有待進(jìn)一步考察���。⑥患者身體條件、疾病進(jìn)展等原因�,可能無法滿足個體化細(xì)胞治療產(chǎn)品的生產(chǎn)和使用條件等。從產(chǎn)能提升和患者可及性的角度考慮���,著眼于研發(fā)通用型細(xì)胞療法,解決生產(chǎn)耗時過長�����、工藝難以規(guī)范、產(chǎn)能難以提高及生產(chǎn)成本昂貴等問題�����,是未來提高細(xì)胞療法的可及性的重要發(fā)展方向。
CGT 產(chǎn)品在分析方法和質(zhì)量控制策略方面也面臨較多挑戰(zhàn)。例如�����,來源和產(chǎn)量較為有限的細(xì)胞治療產(chǎn)品和產(chǎn)量較為有限的罕見病基因治療產(chǎn)品等�,其產(chǎn)量可能無法滿足或支持傳統(tǒng)的質(zhì)控策略和分析方法。另外�,部分與臨床安全性和有效性直接相關(guān)的質(zhì)量屬性尚未完全確定;產(chǎn)品質(zhì)量表征和控制的方法有限���,缺少新的分析技術(shù)等���。針對以上問題,未來可能需要相關(guān)研究人員制定和發(fā)布更具有適用性的�、具體的、標(biāo)準(zhǔn)化的分析方法技術(shù)要求和指南���。
此外���,對于一些個體化產(chǎn)品,考慮到其本身的特殊性�,需要對每批次細(xì)胞治療產(chǎn)品的質(zhì)量屬性與臨床療效進(jìn)行相關(guān)性分析�����。基于有限研究結(jié)果分析�����,筆者認(rèn)為此類產(chǎn)品的臨床療效除了與產(chǎn)品的生產(chǎn)工藝相關(guān)外���,一定程度上還取決于患者自身的細(xì)胞狀態(tài)�。因此�,個體化產(chǎn)品的質(zhì)量控制策略的制定一直以來也是該類產(chǎn)品研發(fā)過程中所面臨的挑戰(zhàn)�����。
3���、結(jié) 語
生物醫(yī)藥是面向21 世紀(jì)的高技術(shù)產(chǎn)業(yè)���,也是我國的戰(zhàn)略性新興產(chǎn)業(yè)。生物制品主要包括疫苗�����、血液制品、治療用重組蛋白�����、基因和細(xì)胞治療產(chǎn)品等�����,在疾病的預(yù)防和治療中發(fā)揮著越來越重要的作用���。疫苗的接種被認(rèn)為是防控傳染病最經(jīng)濟且有效的手段���,為維護(hù)公眾健康和國家安全發(fā)揮了關(guān)鍵作用�。隨著重組DNA 等技術(shù)的進(jìn)步,各種治療用重組蛋白不斷涌現(xiàn)���,在許多重大疾病的治療中發(fā)揮了不可替代的作用�,單抗類藥物異軍突起���,作為一種具有獨特優(yōu)勢的生物靶向治療藥物�����,以其高特異性�、有效性和安全性的特點,已成為近年來全球藥物研發(fā)的熱點�。以基因治療、基因編輯�����、溶瘤病毒���、干細(xì)胞和CAR-T 療法為代表的創(chuàng)新技術(shù)和產(chǎn)品不斷取得革命性的突破���,為生物醫(yī)藥產(chǎn)業(yè)的發(fā)展帶來了新的增長點,也對藥品監(jiān)管科學(xué)的發(fā)展提出了更高的要求�����。
我國生物制品產(chǎn)業(yè)在國家政策的支持下取得了長足發(fā)展�,目前正處于創(chuàng)新產(chǎn)品開發(fā)和產(chǎn)業(yè)高速發(fā)展的重要戰(zhàn)略機遇期���。在相關(guān)政策和科技專項的支持下���,生物制品研發(fā)關(guān)鍵環(huán)節(jié)的總體能力顯著提升、產(chǎn)業(yè)化鏈條不斷完善���,在新藥創(chuàng)制基礎(chǔ)條件及品種產(chǎn)出方面均取得了顯著的進(jìn)步,目前已有相當(dāng)數(shù)量的創(chuàng)新藥進(jìn)入臨床研究階段�,一批創(chuàng)新藥品獲準(zhǔn)上市,眾多國產(chǎn)新藥開始走向國際市場���?����?梢灶A(yù)測�����,在“十四五”期間我國仍將有多種生物制品獲批上市���,可進(jìn)一步提升公眾對高質(zhì)量生物制品的用藥可及性���。未來我國生物制品的發(fā)展仍將以滿足臨床需求為導(dǎo)向,聚焦重大疾病�����,推動原始創(chuàng)新�����,進(jìn)一步突破和提升生物制品研發(fā)和產(chǎn)業(yè)化全鏈條關(guān)鍵技術(shù)���,保障生物制品的安全性�����、有效性和質(zhì)量可控性�,推動生物制品產(chǎn)業(yè)成為有影響力的戰(zhàn)略新興產(chǎn)業(yè)和支柱產(chǎn)業(yè),推動我國由制藥大國向制藥強國轉(zhuǎn)變�����。
引用本文
李敏,郭志鑫,付志浩,張輝*.生物制品的研發(fā)現(xiàn)狀和發(fā)展趨勢[J].中國食品藥品監(jiān)管,2023(12):18-33.