在剛剛過(guò)去的2023年,美國(guó)FDA發(fā)布多份檢查類文件�����,包括1月發(fā)布CPGM 7356.843“批準(zhǔn)后檢查”���,4月發(fā)布更新后的CPGM 7356.002“藥品生產(chǎn)檢查”,6月發(fā)布MAPP 5014.1 Rev.1“了解 CDER 基于風(fēng)險(xiǎn)的場(chǎng)地選擇模型”���,10月發(fā)布“藥品生產(chǎn)和生物研究監(jiān)測(cè)設(shè)施的遠(yuǎn)程交互式評(píng)估”等�����,從內(nèi)部工作規(guī)范到外部指南,闡述FDA的檢查要點(diǎn)和整體考量���。
FDA在2023財(cái)年藥品檢查次數(shù),國(guó)內(nèi)819次���,國(guó)外654次���,其中有483缺陷的總計(jì)510次���。生物制品檢查次數(shù),國(guó)內(nèi)1125次���,國(guó)外50次�����,其中有483缺陷的總計(jì)45次�����。醫(yī)療器械檢查次數(shù),國(guó)內(nèi)1042次�,國(guó)外345次,其中有483缺陷的總計(jì)720次�。此外,F(xiàn)DA在2023年共發(fā)出80封藥品cGMP相關(guān)的警告信�����。
本文將按照時(shí)間線順序���,對(duì)2023年10大FDA熱門檢查事件進(jìn)行年度盤點(diǎn)總結(jié)�����。
1. FDA 發(fā)布 36 頁(yè)長(zhǎng) 483 詳述印度工廠數(shù)據(jù)可靠性劣跡
FDA于 2023 年 1 月 18 日公布在檢查了位于印度古吉拉特邦I(lǐng)ntas工廠之后發(fā)出的長(zhǎng)達(dá)36頁(yè)的483報(bào)告,Intas 藥業(yè)多次違反GMP�����,存在的問(wèn)題包括數(shù)據(jù)可靠性�����、SOP實(shí)踐�����、準(zhǔn)確性�、產(chǎn)品檢測(cè)方法以及旨在防止微生物污染的程序問(wèn)題�。其中最值得注意的一條觀察項(xiàng)是,F(xiàn)DA 檢查員“發(fā)現(xiàn)一輛卡車上裝滿了裝有碎文件的透明塑料袋和黑色塑料袋�,其中大部分文件被人手隨機(jī)撕成碎片并與其它廢料混合在一起�。這輛卡車被發(fā)現(xiàn)時(shí)距工廠約 150 米���,正在等待清除廢料的許可�。”這份483也直接導(dǎo)致了FDA隨后對(duì)Intas工廠發(fā)布的進(jìn)口禁令。
值得一提的是���,在FDA 2018 年發(fā)給Intas的483中,數(shù)據(jù)可靠性問(wèn)題也是占據(jù)了主導(dǎo)地位���,這類問(wèn)題在印度企業(yè)的檢查缺陷中早已屢見不鮮�����,對(duì)于我國(guó)藥企也同樣是一直以來(lái)的熱點(diǎn)問(wèn)題���。
圖1. 數(shù)據(jù)可靠性評(píng)估報(bào)告(部分展示)
2. FDA猛查印度藥企:狼可能要來(lái)了
PDA 2023 年會(huì)于 2023 年 2 月在印度舉行,此次會(huì)議特點(diǎn)有三:一是講者中美國(guó)FDA人員占比大�����;二是講者中無(wú)一人來(lái)自印度藥監(jiān)局,當(dāng)時(shí)在印度有近20位FDA檢查員對(duì)出口美國(guó)的藥企做全面檢查�;三是會(huì)議還安排了數(shù)據(jù)可靠性特別講座,講者就是當(dāng)年因在印度查出大量數(shù)據(jù)可靠性問(wèn)題而出名的Peter Baker先生�����。
我國(guó)藥企應(yīng)該趁FDA把精力花在印度的時(shí)候���,抓緊排除數(shù)據(jù)可靠性問(wèn)題。一旦FDA移師我國(guó)���,都能順利過(guò)關(guān)���,從而借助FDA的檢查,向全球展示我國(guó)的藥品質(zhì)量可靠�,至少是比印度的可靠。果不其然�,自2023年4月以來(lái),F(xiàn)DA開始對(duì)中國(guó)藥企做大規(guī)模檢查�,并且不經(jīng)通知的飛行檢查比例明顯上升。
3. 印度 Lupin 工廠再收 FDA 483���,十項(xiàng)主要違規(guī)行為
FDA 于 2023 年 4 月公布了一封發(fā)給印度 Lupin 公司的 483,陳述了多項(xiàng) GMP 違規(guī)行為�����。
主要缺陷包括以下幾點(diǎn):(1)未能充分調(diào)查設(shè)備故障���,從 2019 年 1 月到 2023 年 3 月�����,Lupin 記錄了 1695 份故障通知,但僅調(diào)查了 41 份���。(2)未能保證受計(jì)算機(jī)故障影響的計(jì)算機(jī)系統(tǒng)中數(shù)據(jù)的可靠性���,企業(yè)記錄了 16 次故障通知,但只對(duì)一次故障進(jìn)行了調(diào)查�����。(3)對(duì)于一名目檢人員在 2020 年 10 月 20 日的目視檢查中發(fā)現(xiàn)的一枚外來(lái)空膠囊的來(lái)源也沒(méi)有開展調(diào)查���。(4)未能調(diào)查投訴并對(duì)投訴進(jìn)行跟進(jìn)�����,包括采取措施來(lái)防止再次發(fā)生。(5)員工缺乏履行指定職能所需的必要培訓(xùn)���,且未能向外包人員提供持續(xù)的 GMP 培訓(xùn)。
4. 滴眼液企業(yè)表示“不知道眼科藥品必須是無(wú)菌的”
FDA 于 2023 年 5 月 16 日公布了簽發(fā)給 Pharmedica USA 公司的警告信���。2023 年3 月,Pharmedica 因非處方眼藥水污染問(wèn)題將產(chǎn)品召回�����,使用這些被污染的非無(wú)菌滴眼液可能導(dǎo)致眼部感染�,重則失明�����。
警告信中表示���,本應(yīng)無(wú)菌的產(chǎn)品正在不衛(wèi)生的條件下制備或貯存,并且可能已經(jīng)“被污染或?qū)】涤泻?rdquo;���。檢查員還指出���,廠房設(shè)施“年久失修”,沒(méi)有用于存放無(wú)菌產(chǎn)品的區(qū)域�。“在檢查期間,企業(yè)告訴我們不知道眼科藥品必須是無(wú)菌的�����,并且承認(rèn)廠房設(shè)施沒(méi)有適當(dāng)?shù)卦O(shè)計(jì)控制和裝備來(lái)處理或生產(chǎn)無(wú)菌藥品�。”
Pharmedica 也未能對(duì)藥品中使用的物料進(jìn)行適當(dāng)檢測(cè)���,“在沒(méi)有確定供應(yīng)商檢測(cè)分析的可靠性的情況下”就接收了原輔料,并且沒(méi)有獲得或?qū)徍怂性o料的分析報(bào)告單(COA)�。Pharmedica 也沒(méi)有設(shè)立質(zhì)量部門來(lái)監(jiān)督產(chǎn)品生產(chǎn)。
5. FDA修訂基于風(fēng)險(xiǎn)的檢查場(chǎng)地選擇模型指南
FDA 藥品質(zhì)量辦公室(OPQ)于 2023 年 6 月 26 日發(fā)布了政策和程序手冊(cè)(MAPP)5014.1“了解 CDER 基于風(fēng)險(xiǎn)的場(chǎng)地選擇模型”第一版修訂稿���,解釋了 FDA 檢查員必須使用的確定 GMP 監(jiān)督檢查優(yōu)先順序的風(fēng)險(xiǎn)因素。
該指南增加了一個(gè)與場(chǎng)地設(shè)施所在國(guó)家或地區(qū)的合規(guī)歷史相關(guān)的風(fēng)險(xiǎn)因素�����,包括與該國(guó)家或地區(qū)出口的產(chǎn)品相關(guān)的違規(guī)歷史�����。也就是以后 FDA 在審查檢查風(fēng)險(xiǎn)因素時(shí)不僅要看企業(yè)的合規(guī)歷史���,還要看企業(yè)所在國(guó)家的合規(guī)歷史,例如�,印度經(jīng)常出現(xiàn)數(shù)據(jù)可靠性不合規(guī)情況(483 或警告信)�����,那么今后印度企業(yè)在這一項(xiàng)中的檢查場(chǎng)地選擇風(fēng)險(xiǎn)得分就會(huì)相應(yīng)增加���。雖然在 MAPP 中 FDA 并沒(méi)有提具體國(guó)家或地區(qū),但可以想像今后印度和中國(guó)的企業(yè)將受到重點(diǎn)關(guān)注�����。
6. Catalent 工廠 483���,導(dǎo)致再生元重磅藥 Eylea 被拒主因
FDA 于 2023 年 7 月 14 日公布了簽發(fā)給 Catalent 印第安納工廠的 483�����, 列舉了三大觀察項(xiàng)���。這些檢查缺陷導(dǎo)致再生元(Regeneron)重磅藥物 Eylea(aflibercept)新版本的上市申請(qǐng)?jiān)饩堋?/span>
在檢查過(guò)程中�,F(xiàn)DA 表示,Catalent 印第安納工廠沒(méi)有遵循書面程序���,設(shè)備重新驗(yàn)證不充分�����,設(shè)施及其設(shè)備沒(méi)有得到充分清潔或維護(hù)。檢查員記錄了工廠某個(gè)區(qū)域“缺乏良好的無(wú)菌技術(shù)”以及“手套”未消毒���。檢查員發(fā)現(xiàn)了一個(gè)“有凹痕的過(guò)濾器”�,并表示一個(gè)生產(chǎn)車間處于“年久失修的狀態(tài)”���,膠帶從墻壁上剝落���、過(guò)濾器變色以及推車輪子生銹。通往物料接收平臺(tái)的門“門框密封不充分”�����。
Catalent 對(duì) FDA 的處罰并不陌生�����。該印第安納工廠去年也收到了一封長(zhǎng)達(dá) 19 頁(yè)的 483,導(dǎo)致 Moderna 新冠疫苗分發(fā)的推遲 ���。
7. 眾議員22問(wèn)FDA在印度和中國(guó)藥品檢查方面的進(jìn)展
美國(guó)眾議院三名共和黨高層議員于 2023 年 7 月 18 日致信 FDA 局長(zhǎng) Robert Califf,質(zhì)疑 FDA 在解決印度和中國(guó)藥品和原料藥生產(chǎn)工廠問(wèn)題方面的進(jìn)展�����。信中共向 FDA 提出了 22 個(gè)問(wèn)題���,包括一般性檢查問(wèn)題、針對(duì)印度檢查的問(wèn)題�����,以及針對(duì)中國(guó)檢查的問(wèn)題。
信中表示�����,在中國(guó)“面臨比印度更危險(xiǎn)的情況”�,尤其是在 2020 至 2022 財(cái)年期間���,F(xiàn)DA 僅在中國(guó)進(jìn)行了 40 次檢查,相比之下���,2019 年為 131 次�。信中指出�,直到 2023 年 4 月�,F(xiàn)DA 才重新啟動(dòng)了對(duì)中國(guó)的疫情后檢查。
信中還重點(diǎn)關(guān)注了中國(guó)國(guó)家安全法可能對(duì)檢查造成的影響�����。對(duì)于在中國(guó)的檢查�,議員們同樣詢問(wèn)了 FDA 是否有在中國(guó)啟動(dòng)飛行檢查的計(jì)劃。另外對(duì)于在過(guò)去十年中收到警告信的中國(guó)企業(yè)�����,要求 FDA 提供清單說(shuō)明在向這些企業(yè)發(fā)布警告信之后是否執(zhí)行了現(xiàn)場(chǎng)檢查���、遠(yuǎn)程檢查還是沒(méi)有進(jìn)行檢查。
另外���,信中還要求 FDA 提供從 2020 年 1 月到現(xiàn)在與中國(guó)政府部門就藥品生產(chǎn)工廠現(xiàn)場(chǎng)檢查進(jìn)行的所有溝通的復(fù)印件���。
8. 印度無(wú)菌制劑483中一系列令人震驚的操作
FDA于 2023 年 10 月 12 日至 10 月 20 日期間�,對(duì)位于印度的Kilitch Healthcare工廠進(jìn)行了現(xiàn)場(chǎng)檢查���,發(fā)布了長(zhǎng)達(dá)20頁(yè)的483表格,涉及多條缺陷項(xiàng)���,包括許多無(wú)菌操作和微生物監(jiān)測(cè)相關(guān)的嚴(yán)重問(wèn)題�。并且在483發(fā)布的3天后就對(duì)該企業(yè)發(fā)布了進(jìn)口禁令�����。
第1條缺陷項(xiàng)�����,觀察到了多達(dá)16條無(wú)菌灌裝的高風(fēng)險(xiǎn)操作�,涉及到的嚴(yán)重問(wèn)題,包括:操作人員皮膚暴露在A級(jí)區(qū)域���;俯身在灌裝線上和打開無(wú)菌瓶,俯身在裝有無(wú)菌瓶的袋子上�,將戴著手套的手伸入裝有無(wú)菌瓶的袋子;穿著非無(wú)菌潔凈服的前臂和肘部觸碰到無(wú)菌潔凈區(qū)內(nèi)部�����;俯身在灌裝線上開放的無(wú)菌瓶上���,頭部和軀干在A級(jí)灌裝區(qū)域內(nèi)���;允許從B級(jí)區(qū)域到擴(kuò)展LAF的A級(jí)區(qū)域的自由空氣通過(guò);操作員赤腳在C級(jí)區(qū)傳遞物料至B級(jí)灌裝區(qū)�����;操作員在層流罩內(nèi)脫下帽子并梳理頭發(fā)�����。
第2條缺陷項(xiàng)���,生產(chǎn)期間微生物監(jiān)測(cè)結(jié)果長(zhǎng)期造假���。具體來(lái)說(shuō)�����,對(duì)于未采集的樣品���,報(bào)告的實(shí)驗(yàn)室記錄中仍記錄了低于警戒限值的結(jié)果,并且結(jié)果在之前的數(shù)據(jù)趨勢(shì)范圍內(nèi)�����。不收集所有樣品�,但仍報(bào)告合格結(jié)果的做法已經(jīng)發(fā)生了至少一年。在過(guò)去的五年中�����,微生物實(shí)驗(yàn)室報(bào)告了環(huán)境監(jiān)測(cè)和人員監(jiān)測(cè)的結(jié)果���,沒(méi)有超出行動(dòng)限的結(jié)果和四個(gè)超出警戒限的結(jié)果,但在2023年10月16日至18日的檢查中�����,讀取從與批次相關(guān)的無(wú)菌灌裝區(qū)收集到的樣品結(jié)果時(shí)�����,有39次偏離���。這包括15個(gè)A級(jí)超出行動(dòng)限的結(jié)果、1個(gè)B級(jí)超出行動(dòng)限的結(jié)果�����、13個(gè)人員監(jiān)測(cè)超出行動(dòng)限的結(jié)果���,以及5個(gè)人員監(jiān)測(cè)超出警戒線的結(jié)果���。
第3條缺陷項(xiàng),涉及兩方面問(wèn)題�,其一是煙霧試驗(yàn)結(jié)果顯示灌裝區(qū)內(nèi)部存在湍流和非單向氣流,并且煙霧試驗(yàn)未包括相關(guān)的設(shè)置活動(dòng)或干預(yù)措施�����;其二是列舉了在無(wú)菌工藝模擬研究期間進(jìn)行的干預(yù)類型及其持續(xù)時(shí)間與在商業(yè)化生產(chǎn)過(guò)程中觀察到的干預(yù)措施相比發(fā)現(xiàn)的差異���。
9. CAR-T“致癌風(fēng)險(xiǎn)”警告�����,F(xiàn)DA宣布安全性審查
FDA 于 2023 年 11 月 28 日發(fā)布公告表示���,正在調(diào)查 CAR-T 療法是否會(huì)在極少數(shù)情況下導(dǎo)致淋巴瘤(一種血癌)。繼對(duì) CAR-T 療法發(fā)起調(diào)查后�,F(xiàn)DA 對(duì) CAR-T產(chǎn)品的監(jiān)管更加嚴(yán)格�����,并相繼采取了一系列措施。
FDA 于 2023 年 12 月 5 日公布了一封 8 月份發(fā)給諾華的無(wú)標(biāo)題信�����,信中概述了 FDA 檢查人員在諾華新澤西 Morris Plains 工廠發(fā)現(xiàn)的 Kymriah(tisagenlecleucel)生產(chǎn)過(guò)程中與 CGMP 要求的重大偏離�����。FDA 在信中指出�����,“從 2018 年 12 月到檢查之日�,企業(yè)發(fā)現(xiàn)大約 100 批 Kymriah 受到外源顆粒物質(zhì)的污染(例如�,木材�、纖維素、銅和鋼)���。2020 年 11 月企業(yè)得出結(jié)論�����,冷凍袋(Cryobags)是最可能的根本原因�����。盡管企業(yè)對(duì)收到的冷凍袋實(shí)施了加強(qiáng)的目檢�����,但企業(yè)仍繼續(xù)在 Kymriah 成品批次中發(fā)現(xiàn)顆粒物�����。企業(yè)最近一次在 2022 年 10 月 8 日將顆粒物歸因于冷凍袋。”
2023年12月12日�,科濟(jì)藥業(yè)發(fā)布公告,其美國(guó)子公司CARsgen Therapeutics Corporation收到FDA的通知�,因?yàn)镃MC問(wèn)題暫停三項(xiàng)臨床試驗(yàn),其中包括其進(jìn)度最快的CLDN18.2 CAR-T�,等待對(duì)位于北卡羅來(lái)納州達(dá)勒姆的生產(chǎn)基地進(jìn)行檢查后得出的結(jié)論�。
FDA于 2023 年 12 月下旬對(duì)強(qiáng)生和傳奇生物的 CAR-T 治療藥 Carvykti 添加了黑框警告。傳奇生物在 12 月 21 日提交的一份證券文件中表示���,Carvykti 的黑框警告包括針對(duì)“繼發(fā)性血液惡性腫瘤,包括骨髓增生異常綜合癥(MDS)和急性髓系白血?��。ˋML)”的警告�。
10. 請(qǐng)幫我分析這位FDA檢查員
前面已經(jīng)提到�,F(xiàn)DA受到各方面的壓力,自 2023 年 4 月以來(lái)�����,開始對(duì)中國(guó)藥企做大規(guī)?����,F(xiàn)場(chǎng)檢查�����。與一些印度藥企的擺爛姿態(tài)不同�����,我國(guó)藥企多數(shù)還是積極采取各方面的迎檢措施�,在眾多迎檢準(zhǔn)備中�,業(yè)界非常看中的一點(diǎn)�����,就是對(duì)即將到來(lái)的這位檢查員檢查特點(diǎn)的分析�����。
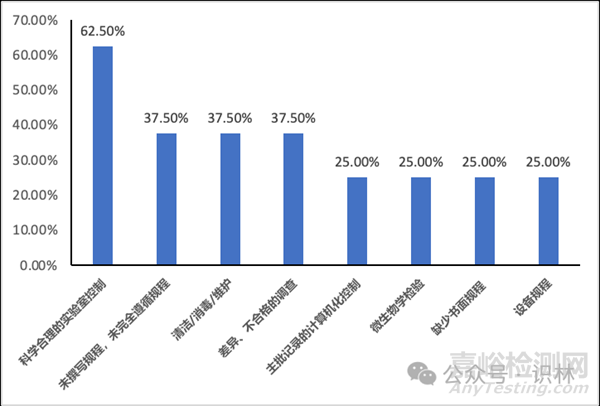
以下是部分分析圖表的簡(jiǎn)單示例�����,希望我國(guó)藥企在這一輪的風(fēng)口浪尖中都能乘風(fēng)破浪���,順利通過(guò)FDA檢查。
圖2. Lisa L. Flores所發(fā)布的主要缺陷項(xiàng)出現(xiàn)頻率(舉例)
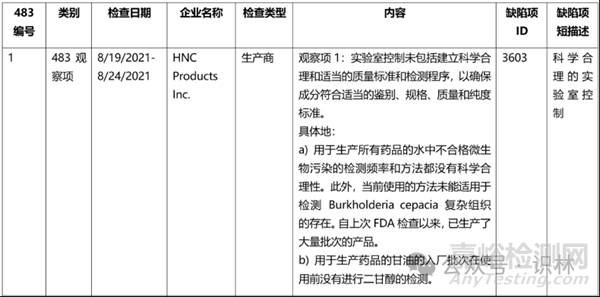
表1. 近兩年Lisa L. Flores所發(fā)的483基本情況和缺陷項(xiàng)梳理(部分展示)