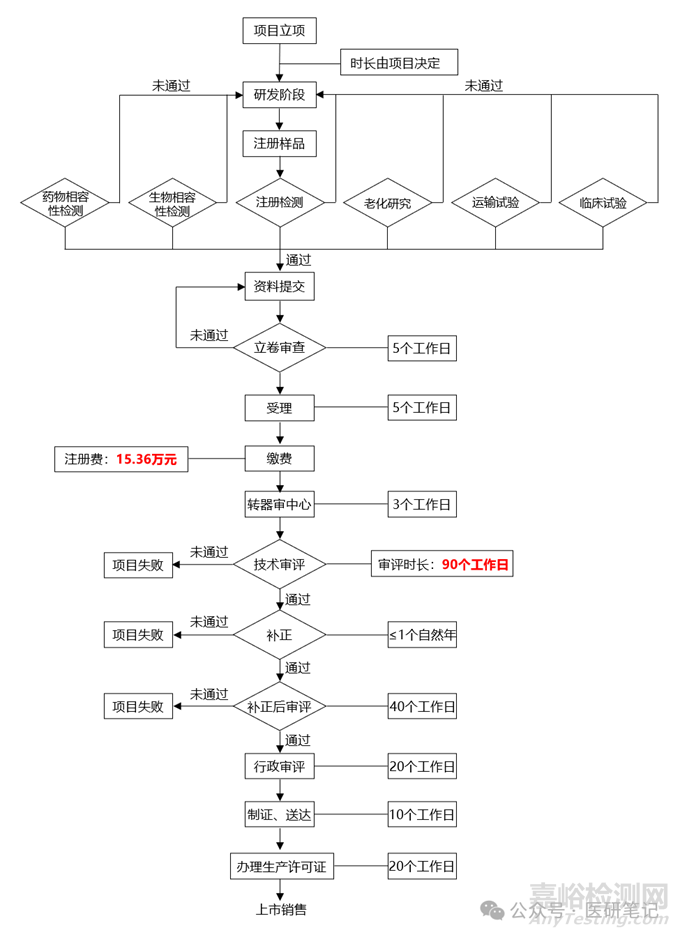
1. 項目立項
市場和費用由公司內(nèi)部決定�����,基本上很快�����,費用忽略���。
2. 項目研發(fā)
由項目本身的難易程度以及公司配備的資源決定�����,國內(nèi)大部分都是仿制再研發(fā)相結(jié)合的方式���,時間和費用會大大小于原研首創(chuàng)的項目。
3. 試制注冊檢樣品
研發(fā)工藝穩(wěn)定成熟后�����,需要進行少批量的試制�����,以備后續(xù)的性能確認用,數(shù)量需要前期規(guī)劃好�����,后續(xù)很多項目的檢測和臨床試驗都要求是同一批產(chǎn)品���。
4. 性能研究測試階段
這部分的工作�����,大多是委托第三方檢測機構(gòu)代為完成���。時間和費用,由檢測項目決定�,由第三方檢測機構(gòu)決定�����,無法通過自己的加班加點實現(xiàn)�,大部分時間都是等待期。
本部分大致分為以下幾個檢測類別�����。
1)注冊檢測:按照產(chǎn)品的技術(shù)要求送至第三方檢測,送檢樣品需要有典型性�����。
2) 生物相容性:按照GB/T 16886.1進行生物相容性研究�����,然后送至第三方機構(gòu)檢測�����。
3) 藥物相容性:如果器械與藥液接觸���,或者臨床使用過程需要儲存藥液等情況���,需要研究器械的藥物相容性,分為:藥物相容性和可瀝濾物測試�����。
4) 老化性能研究:根據(jù)標準《YY/T 0681.1-2018無菌醫(yī)療器械包裝試驗方法 第1 部分:加速老化試驗指南》�,研究加速老化性能,以驗證產(chǎn)品的有效期���。
5) 運輸性能研究:根據(jù)標準《YY/T 0681.15-2019無菌醫(yī)療包裝試驗方法 第15部分:運輸容器和系統(tǒng)的性能試驗》���,研究產(chǎn)品的運輸貯存性能�����,以確定產(chǎn)品在流通過程的穩(wěn)定性���。
5. 臨床試驗階段
如果不在免于臨床試驗?zāi)夸浝铮蛘咭矡o法通過同品種臨床評價���,則需要按照《醫(yī)療器械注冊申報臨床評價報告技術(shù)指導原則》進行臨床試驗�。這一階段的時長和費用也無法確定�����,根據(jù)具體的項目具體計算�。
6. 注冊申報
完成所有研究和獲得相對應(yīng)的性能測試工作���,整理好注冊資料���,按照eRPS系統(tǒng)要求提交注冊資料。這一階段的費用為15.36萬元���,審查時間為90個工作日�����。
7. 現(xiàn)場體系核查
提交注冊資料的1個月左右�����,省局會安排老師至生產(chǎn)現(xiàn)場為期2-3天的現(xiàn)場核查�。
8. 補正資料
資料審評后�,會出具補正通知書,根據(jù)補正通知�����,在進行性能研究補充�,注意補正的時間為1年以內(nèi),切勿超過時間�。提交后,補正資料審查的時間為40個工作日���。
9. 獲得注冊證
審評結(jié)束后���,會出具審核通過或不通過的結(jié)果�,及時關(guān)注中國器審中心和國家藥監(jiān)局網(wǎng)���。
10.辦理生產(chǎn)許可證
獲得注冊證后���,可以正式向省局申請生產(chǎn)許可�����。
以上是三類醫(yī)療器械研發(fā)注冊的共性問題�����。二類器械與各個省局政策有關(guān)系�����。