Vertex Pharmaceuticals今日宣布��,其和CRISPR Therapeutics聯(lián)合開(kāi)發(fā)的CRISPR/Cas9基因編輯療法Casgevy(exagamglogene autotemcel��,exa-cel)獲美國(guó)FDA批準(zhǔn)�����,用于治療12歲及以上輸血依賴性β地中海貧血(TDT)患者��。這項(xiàng)批準(zhǔn)較FDA預(yù)定的PDUFA日期提早了約一個(gè)半月���。Casgevy在2023年12月獲美國(guó)FDA批準(zhǔn)上市,用于治療12歲及以上鐮刀型細(xì)胞貧血?����。⊿CD)患者���。
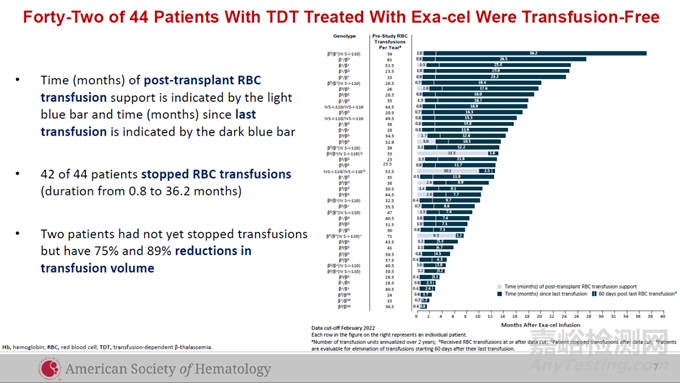
在Casgevy用以治療TDT患者的全球臨床試驗(yàn)中���,試驗(yàn)達(dá)到主要終點(diǎn)�����,即患者至少連續(xù)12個(gè)月不需進(jìn)行輸血�����,顯示Casgevy具有一次治療��,提供功能性治愈的潛力��。此前公布的試驗(yàn)結(jié)果顯示��,在接受治療的44名TDT患者中��,42名在隨訪時(shí)間為1.2-37.2個(gè)月時(shí)��,不再需要接受輸血��,剩余兩名患者接受的輸血水平分別降低75%和89%��。
▲接受Casgevy治療的TDT患者的臨床試驗(yàn)數(shù)據(jù)(圖片來(lái)源:CRISPR Therapeutics公司官網(wǎng))
在這些正在進(jìn)行的研究中���,迄今為止接受Casgevy治療的97例患者的安全性特征與白消安清髓性預(yù)處理和造血干細(xì)胞移植基本一致�����。
▲接受Casgevy治療患者的安全性試驗(yàn)數(shù)據(jù)(圖片來(lái)源:CRISPR Therapeutics公司官網(wǎng))
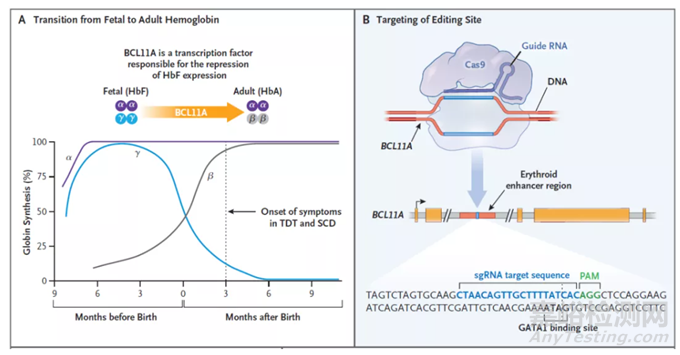
Casgevy是一款非病毒���、自體細(xì)胞療法,它利用CRISPR/Cas9基因編輯系統(tǒng)�����,在體外對(duì)來(lái)自患者的造血干細(xì)胞進(jìn)行編輯�����,使血紅細(xì)胞生產(chǎn)高水平的胎兒血紅蛋白(HbF)��。HbF是攜帶氧氣的血紅蛋白的一種形式���,在出生時(shí)自然存在,隨著嬰兒的長(zhǎng)大�����,血液中的血紅蛋白轉(zhuǎn)換為成人形式的血紅蛋白。通過(guò)Casgevy治療��,可以提高HbF水平��,有可能緩解輸血依賴性β地中海貧血患者的輸血需求��,并減少鐮刀型細(xì)胞貧血病患者的疼痛和使人衰弱的血管閉塞性危象��。
2023年11月��,Casgevy獲英國(guó)藥品和健康產(chǎn)品管理局(MHRA)有條件上市許可���,用于治療12歲及以上SCD與TDT患者�����,成為全世界首款獲批上市的CRISPR基因編輯療法���。
▲Casgevy的作用機(jī)制:A,BCL11A是下調(diào)胎兒血紅蛋白表達(dá)的轉(zhuǎn)錄因子���;B��,Casgevy通過(guò)對(duì)BCL11A進(jìn)行基因編輯�����,上調(diào)胎兒血紅蛋白的表達(dá)(圖片來(lái)源:參考資料[2])
2015年���,Vertex公司和CRISPR Therapeutics達(dá)成戰(zhàn)略研究合作��,專注于利用CRISPR/Cas9發(fā)現(xiàn)和開(kāi)發(fā)針對(duì)人類疾病潛在遺傳原因的潛在新治療方法��。根據(jù)修訂后的合作協(xié)議�����,Vertex公司正領(lǐng)導(dǎo)Casgevy的全球開(kāi)發(fā)��、制造和商業(yè)化。
參考資料:
[1] Vertex Announces US FDA Approval of CASGEVY™ (exagamglogene autotemcel) for the Treatment of Transfusion-Dependent Beta Thalassemia. Retrieved January 16, 2024 from https://news.vrtx.com/news-releases/news-release-details/vertex-announces-us-fda-approval-casgevytm-exagamglogene
[3] Frangoul et al., (2020). CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. NEJM, DOI: 10.1056/NEJMoa2031054.