今日頭條
通化東寶URAT1抑制劑IIa期臨床積極�。通化東寶1類新藥URAT1抑制劑THDBH130片治療高尿酸血癥伴或不伴痛風患者的IIa期臨床達到主要終點。結(jié)果顯示����,THDBH130可劑量依賴性地降低痛風患者的血尿酸水平;患者的血尿酸6mg/dl達標率與陽性對照藥物苯溴馬隆相比療效相當��;藥物不良事件發(fā)生率與苯溴馬隆相似或更低����。
國內(nèi)藥訊
1.神州細胞PD-1單抗報肝癌NDA。神州細胞PD-1抑制劑菲諾利單抗(SCT-I10A)和貝伐珠單抗(SCT510)上市申請同時獲得CDE受理�,推測適應(yīng)癥為二者聯(lián)合用藥一線治療肝細胞癌。SCT-I10A目前正在開展多項臨床試驗��,包括一線治療復發(fā)性和/或轉(zhuǎn)移性頭頸部鱗狀細胞癌��、一線治療晚期肝細胞癌、以及二線治療晚期肺鱗癌�。去年年底,菲諾利單抗也提交了用于治療頭頸部鱗狀細胞癌的上市申請��。
2.迪哲JAK1抑制劑啟動III期臨床�。迪哲醫(yī)藥JAK1抑制劑戈利昔替尼登記啟動一項國際III期臨床(CTR20240028),評估戈利昔替尼對比西達本胺片治療復發(fā)難治性外周T細胞淋巴瘤(r/r PTCL)成人患者中的抗腫瘤療效��。該項試驗主要研究者為上海交通大學醫(yī)學院附屬瑞金醫(yī)院醫(yī)學博士趙維蒞��。目前�,戈利昔替尼治療r/r PTCL的上市申請已被CDE受理��,且納入了優(yōu)先審評程序����。
3.正大天晴司美格魯肽啟動III期臨床。正大天晴司美格魯肽注射液登記啟動一項III期臨床��,評估與諾和泰®相比����,治療2型糖尿病的有效性和安全性。該項試驗主要研究者為南京大學醫(yī)學院附屬鼓樓醫(yī)院醫(yī)學博士朱大龍����。司美格魯肽原研產(chǎn)品是諾和諾德開發(fā)的長效GLP-1R激動劑��,商品名為諾和泰®����。
4.長春高新長效黃體酮周制劑獲批臨床��。長春高新旗下金賽藥業(yè)注射用GenSci125獲FDA批準開展I期臨床試驗�,用于輔助生殖技術(shù)中的黃體補充或替代。這是一款長效黃體酮周制劑����,旨在降低臨床給藥次數(shù),給患者提供更好的用藥選擇����。目前,國內(nèi)上市的黃體酮均為需每日用藥的短效劑型�。
5.拜耳sGC激動劑中國獲批腎病臨床。拜耳1類化藥鹽酸BAY 3283142片獲國家藥監(jiān)局臨床試驗?zāi)驹S可��,擬開發(fā)治療慢性腎臟病��。BAY 3283142是一款可溶性鳥苷酸環(huán)化酶(sGC)激動劑����,目前正在Ⅰ期臨床中評估安全性�、藥代動力學特征��,以及對腎功能降低�、輕中度高血壓參與者的影響。sGC是一氧化氮(NO)信號通路中重要的酶�,對血管和心臟的功能起關(guān)鍵作用。
6.榮昌MSLN-ADC聯(lián)合用藥獲批臨床��。榮昌生物MSLN靶向ADC新藥注射用RC88獲國家藥監(jiān)局批準開展Ⅰ/Ⅱa期臨床試驗��,聯(lián)合PD-1抑制劑信迪利單抗注射液治療間皮素表達的晚期惡性實體腫瘤患者(包括不限于胸膜間皮瘤��、腹膜間皮瘤����、卵巢癌��、胰腺癌��、肺腺癌�、胃腺癌和三陰性乳腺癌等其他可能獲益的癌腫)。去年年底�,F(xiàn)DA已批準RC88單藥用于婦科腫瘤的Ⅱ期臨床研究�,并授予快速通道資格�。
國際藥訊
1.首款CRISPR基因編輯療法獲批新適應(yīng)癥。Vertex公司與CRISPR公司開發(fā)的CRISPR/Cas9基因編輯療法Casgevy(exa-cel)獲FDA批準新適應(yīng)癥��,用于治療12歲及以上輸血依賴性β地中海貧血(TDT)患者�。這是全球首款CRISPR基因編輯療法,通過體外對來自患者的造血干細胞進行編輯�,使血紅細胞生產(chǎn)高水平的胎兒血紅蛋白(HbF)。去年年底����,F(xiàn)DA已批準Casgevy治療12歲及以上患有復發(fā)性血管閉塞危象(VOC)的鐮刀型細胞貧血病(SCD)患者��。
2.賽諾菲IL-4/13抑制劑獲批新適應(yīng)癥����。再生元與賽諾菲開發(fā)的IL-4/IL-13抑制劑Dupixent(dupilumab)獲FDA批準新適應(yīng)癥,用于治療12歲及以上�、手和/或腳癥狀未受控制的中重度特應(yīng)性皮炎患者。在Ⅲ期LIBERTY-AD-HAFT臨床中��,與安慰劑相比����,Dupixent治療使這類難治性患者實現(xiàn)手腳的皮膚癥狀獲得清除或幾乎清除的患者比例顯著更高(40%vs17%)��。此前����,Dupixent已被FDA批準特應(yīng)性皮炎��、哮喘�、慢性鼻竇炎伴鼻息肉病等多項適應(yīng)癥。
3.FDA批準IPF人工智能診斷工具��。Imvaria公司基于AI技術(shù)�、非侵入性的診斷輔助系統(tǒng)Fibresolve獲FDA批準上市,應(yīng)用于在侵入性測試之前作為特發(fā)性肺纖維化(IPF)的輔助診斷��。Fibresolve通過提供基于機器學習模式識別的成像結(jié)果����,進行影像的定性診斷分類輸出����,進而提供輔助信息以支持、補充標準護理工作流程��。在臨床試驗中����,F(xiàn)ibresolve早期應(yīng)用可減少41%的肺活檢次數(shù)�。
4.眼科納米免疫調(diào)節(jié)療法Ⅱ/Ⅲ期臨床積極�。Aviceda公司納米免疫調(diào)節(jié)療法AVD-104治療年齡相關(guān)性黃斑變性(AMD)引起的地理性萎縮(GA)的Ⅱ/Ⅲ期臨床SIGLEC結(jié)果積極。3個月治療數(shù)據(jù)顯示��,AVD-104單次注射治療顯著改善患者最佳矯正視力(BCVA)��,顯著減少GA病變進展����;治療期間,AVD-104耐受性良好�,沒有與藥物相關(guān)的嚴重不良反應(yīng)報告。
5.Epitomee公司減肥膠囊關(guān)鍵性臨床成功��。Epitomee公司減肥膠囊用于治療超重或肥胖病患者的關(guān)鍵性RESET研究結(jié)果積極�。數(shù)據(jù)顯示,患者服用減肥膠囊24周期間�,有56%(p<0.0001)患者體重較基線減幅≥5%(其中減重≥10%、或≥15%的患者比例分別達到27% 和11%)����;該治療組患者減掉的基準體重也比安慰劑膠囊對照組更高;臨床中未出現(xiàn)與器械相關(guān)的嚴重不良事件(SAE)。
6.BI聯(lián)合協(xié)和麒麟開發(fā)纖維炎癥性疾病療法��。勃林格殷格翰與協(xié)和麒麟株式會社簽訂合作許可協(xié)議��,共同開發(fā)一種新型的��、同類首創(chuàng)的纖維炎癥性疾病療法��。根據(jù)協(xié)議��,協(xié)和麒麟株式會社將獲得高達4.1億歐元的款項��,包括預(yù)付款��、產(chǎn)品開發(fā)��、注冊和商業(yè)里程碑付款以及銷售提成�;勃林格殷格翰將獲得合作產(chǎn)品的全球獨占權(quán)益。
醫(yī)藥熱點
1.2023年我國全年出生人口902萬人����。1月17日����,國新辦舉行2023年國民經(jīng)濟運行情況新聞發(fā)布會。會上介紹,2023年末����,全國人口(包括31個省、自治區(qū)�、直轄市和現(xiàn)役軍人的人口)140967萬人,比上年末減少208萬人����。全年出生人口902萬人,人口出生率為6.39‰��;死亡人口1110萬人��,人口死亡率為7.87‰����;人口自然增長率為-1.48‰。從性別構(gòu)成看�,男性人口72032萬人,女性人口68935萬人��,總?cè)丝谛詣e比為104.49(以女性為100)�。
2.山東省腫瘤醫(yī)院迎來4位新任副院長。1月15日下午�,山東省腫瘤醫(yī)院召開領(lǐng)導班子副職任職會議�,宣布山東第一醫(yī)科大學(山東省醫(yī)學科學院)黨委對醫(yī)院領(lǐng)導班子的調(diào)整決定:路友華同志任醫(yī)院黨委委員����、副書記;趙磊同志任醫(yī)院黨委委員����、副院長;邢力剛同志任醫(yī)院黨委委員�、副院長;劉玉國同志任醫(yī)院黨委委員����、副院長;孟雪同志任醫(yī)院黨委委員�、副院長。
3.北京友誼醫(yī)院開展HoLEP日間手術(shù)�。近日,北京友誼醫(yī)院泌尿中心積極推行HoLEP(經(jīng)尿道鈥激光前列腺剜除術(shù))日間手術(shù)�,首例HoLEP日間手術(shù)在通州院區(qū)泌尿中心綜合三病區(qū)成功開展。這種手術(shù)方式可以在24小時內(nèi)完成包括入院����、手術(shù)和辦理出院等環(huán)節(jié),為需要行激光剜除術(shù)的前列腺增生患者提供更便捷高效的診療服務(wù)��。
評審動態(tài)
1. CDE新藥受理情況(01月17日)
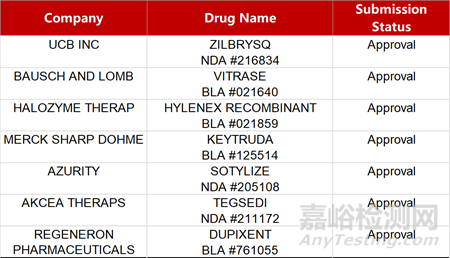
2. FDA新藥獲批情況(北美01月16日)