導(dǎo)語:本篇內(nèi)容為系統(tǒng)性總結(jié)藥械組合產(chǎn)品的注冊申報(bào)要求�,參考了器審中心2022年審評三部《藥械組合醫(yī)療器械注冊申報(bào)資料要求介紹》培訓(xùn)����、《含藥醫(yī)療器械產(chǎn)品注冊申報(bào)資料撰寫指導(dǎo)原則》、《以醫(yī)療器械作用為主的藥械組合產(chǎn)品注冊審查指導(dǎo)原則》����、《醫(yī)療器械注冊申報(bào)資料要求及說明》、《藥械組合產(chǎn)品申報(bào)資料常見問題分析》及《藥械組合產(chǎn)品技術(shù)審評簡介》等資料��,正文約9900字�,詳細(xì)介紹了以醫(yī)療器械作用為主的藥械組合產(chǎn)品注冊申報(bào)的資料要求�,以為諸君關(guān)于藥械組合產(chǎn)品提供點(diǎn)滴參考。
第一部分:申報(bào)前的關(guān)鍵問題
在注冊申報(bào)之前����,我們首先要確定申報(bào)的產(chǎn)品是不是同一注冊單元的產(chǎn)品,也就是說能不能放在一張注冊證上�,這主要就是針對于具有多個(gè)型號規(guī)格的產(chǎn)品,大家可以參考一下《醫(yī)療器械注冊單元?jiǎng)澐种笇?dǎo)原則》去判定一下。對于藥械組合產(chǎn)品來說��,這一點(diǎn)比較容易產(chǎn)生�,比如含藥還是不含藥。因此這一點(diǎn)非常重要����,作者之前在研發(fā)過程中就遇到過到受理審查階段,某一特定型號規(guī)格不能夠按照同一注冊單元進(jìn)行�,結(jié)果進(jìn)行刪除后又存在檢測報(bào)告不完整(當(dāng)時(shí)采用2種型號進(jìn)行差異性檢測)的問題,耽誤了不少時(shí)間�。
不同材料和藥物成分的醫(yī)療器械應(yīng)分別申報(bào):例如,含有雷帕霉素和紫杉醇藥物涂層的支架因成分不同����,不應(yīng)歸入同一注冊單元。
藥物劑量差異大的產(chǎn)品不宜合并申報(bào):若產(chǎn)品間藥物劑量有顯著差異����,建議分別準(zhǔn)備注冊申報(bào),以確保合規(guī)性和安全性�。
準(zhǔn)備注冊申報(bào)資料,參照國家發(fā)布的醫(yī)療器械注冊申報(bào)資料要求和批準(zhǔn)證明文件格式(即121號公告)�,詳盡準(zhǔn)確地準(zhǔn)備相關(guān)文件。
藥械組合產(chǎn)品的特殊指導(dǎo):對于藥械組合產(chǎn)品��,應(yīng)參考以醫(yī)療器械作用為主的注冊審查指導(dǎo)原則等官方指南,確保注冊過程符合相關(guān)法規(guī)和行業(yè)標(biāo)準(zhǔn)��。
第二部分:申報(bào)資料的相關(guān)要求
盡管藥械組合醫(yī)療器械產(chǎn)品不同與單一的醫(yī)療器械�,但注冊申報(bào)資料主要還是參考121號文件,之前撰寫過無源植介入類醫(yī)療器械技術(shù)審評關(guān)注點(diǎn)��,其中詳細(xì)概述了申請表�、綜述資料、研究資料����、產(chǎn)品技術(shù)要求、檢測報(bào)告����、生物相容性評價(jià)、生物安全性評價(jià)��、貨架有效期驗(yàn)證����、生產(chǎn)制造信息以及說明書和標(biāo)簽等12類常見問題解析����。因此,本文介紹來主要從申請表,綜述資料����,產(chǎn)品風(fēng)險(xiǎn)管理資料,產(chǎn)品技術(shù)要求及檢測報(bào)告����,研究資料,臨床評價(jià)資料����、產(chǎn)品說明書和標(biāo)簽樣稿,質(zhì)量管理體系等一些相關(guān)的要求介紹一些差異性的內(nèi)容����。
2.1.申請表的要求
在申請表的填寫方面,藥械組合產(chǎn)品的申請人需特別指出產(chǎn)品類型��,并在結(jié)構(gòu)及組成中詳細(xì)描述器械部分以及藥物涂層的成分�、劑量等信息。例如����,對于帶藥支架,需明確支架和輸送系統(tǒng)的構(gòu)成����,以及藥物涂層的成分(如紫杉醇)��、載藥基質(zhì)(如碘普羅胺)和載藥密度等�。
同時(shí)應(yīng)規(guī)范一產(chǎn)品結(jié)構(gòu)及組成的描述�,在申請表中的信息需要填寫準(zhǔn)確,比如說產(chǎn)品名稱�、分類編碼、注冊人信息����、代理人信息等。器審中心在出報(bào)告前也會(huì)短信讓申請人去確認(rèn)一下注冊證信息����,我們要仔細(xì)的去確認(rèn)一下,尤其是規(guī)格型號表和產(chǎn)品技術(shù)要求����。如果是進(jìn)口的產(chǎn)品,產(chǎn)品的英文名稱�,注冊人的名稱,注冊人的住所����、生產(chǎn)地址等等,都要和提交的證明性文件保持一致����。
注冊人制度(如適用):境內(nèi)產(chǎn)品若走注冊人制度,需在申請表中勾選并提交受托企業(yè)的相關(guān)資質(zhì)和協(xié)議�。
數(shù)據(jù)校驗(yàn)碼:對于多次立卷的產(chǎn)品,注意申請表上的數(shù)據(jù)校驗(yàn)碼����,確保與系統(tǒng)中的數(shù)據(jù)一致。
創(chuàng)新優(yōu)先合同品種(如適用):在申請表中勾選創(chuàng)新或優(yōu)先時(shí)��,需填寫相應(yīng)的申請受理號或提交醫(yī)療器械優(yōu)先審批申請表����,并上傳優(yōu)先審批的理由及依據(jù)。
同品種首個(gè)(如適用):若勾選了同品種首個(gè)�,建議提交真實(shí)性資料以供確認(rèn)。
這一部分常見的問題及分析可參考無源植介入類醫(yī)療器械技術(shù)審評關(guān)注點(diǎn)����。
2.2綜述資料的要求
由于綜述資料包括的內(nèi)容也比較多,本文主要介紹概述����、產(chǎn)品描述����、包裝說明��、與同類或者是前代產(chǎn)品的比較��。
2.2.1概述
根據(jù)楊老師的介紹��,這一部分主要關(guān)注的為產(chǎn)品名稱及分類編碼��。
產(chǎn)品名稱:申請人應(yīng)根據(jù)醫(yī)療器械通用名稱命名規(guī)則來確定產(chǎn)品名稱��,包括核心詞和特征詞�。對于藥械組合產(chǎn)品,應(yīng)在名稱中明確指出含有藥物��,例如“藥物洗脫支架”��、雷帕霉素藥物洗脫支架�。產(chǎn)品名稱不應(yīng)包含夸大或具有宣傳性的詞匯。如果產(chǎn)品適用于特定部位�,應(yīng)在名稱中明確指出,如冠狀動(dòng)脈球囊擴(kuò)張導(dǎo)管����。
分類編碼和管理類別:申請人應(yīng)參考醫(yī)療器械分類目錄和相關(guān)公告來確定產(chǎn)品的分類編碼和管理類別����。如果目錄中有相似品名舉例�,應(yīng)保持分類編碼與目錄一致�。如果目錄中沒有相關(guān)產(chǎn)品,申請人應(yīng)根據(jù)產(chǎn)品特點(diǎn)選擇最接近的分類編碼����,或者在無法確定時(shí)使用“00”作為分類編碼,并尋求分類界定的幫助�。
2.2.2產(chǎn)品描述
產(chǎn)品組成:藥械組合產(chǎn)品由藥品和器械兩部分組成。器械部分包括所有組成部分����,如組件、結(jié)構(gòu)示意圖����、關(guān)鍵位置細(xì)節(jié)圖和剖面圖。每個(gè)組成部分的名稱和關(guān)鍵尺寸測量位置需在圖示中注明����。例如,球囊擴(kuò)張導(dǎo)管的結(jié)構(gòu)圖示應(yīng)標(biāo)明導(dǎo)管�、導(dǎo)管加強(qiáng)件�、球囊導(dǎo)管顯影環(huán)末端等����,以及相關(guān)尺寸。
材料信息:需明確所有材料信息��,包括著色劑�、粘合劑、焊接劑����、潤滑劑等,以及材料與人體的接觸方式�。材料信息應(yīng)與提交的指控文件保持一致,并在建議書列表中明確�,與結(jié)構(gòu)圖示一一對應(yīng)。例如��,球囊組件的材料��、導(dǎo)管每層的材料等��。
藥物涂層部分:需明確藥物名稱�、載藥基質(zhì)或輔料的相關(guān)信息,如化學(xué)結(jié)構(gòu)、分子式�、分子量、理化特性�、藥物劑量等。藥物劑量和載藥基質(zhì)/輔料的選擇依據(jù)應(yīng)提供��,并可參考相關(guān)文獻(xiàn)資料����。對于常見的藥物如紫杉醇和雷帕霉素����,我們一般不會(huì)發(fā)起聯(lián)審。具體關(guān)于藥物的信息描述可參考《以醫(yī)療器械作用為主的藥械組合產(chǎn)品注冊審查指導(dǎo)原則》����,具體如下:
需明確產(chǎn)品中藥物的名稱。適用時(shí)��,提供相關(guān)信息如化學(xué)結(jié)構(gòu)式��、分子量����、性狀、純度、含量��、劑量(如μg/mm2)�、載體類型、與載體的配比��、藥物與器械結(jié)合方式等����;提供理化性質(zhì)參數(shù)如色澤、pH值�、解離常數(shù)(pKa)、粒度����、晶型、比旋度����、光學(xué)異構(gòu)體、熔點(diǎn)�、水分、溶解度等��;提供穩(wěn)定性信息如對光�、濕����、熱的穩(wěn)定性����,固、液態(tài)下的穩(wěn)定性和相互作用的穩(wěn)定性����;提供藥物已有的吸收、分布��、代謝�、消除等信息�。如已上市藥物發(fā)生相關(guān)不良事件或召回事件,建議提供相關(guān)信息��。
以醫(yī)療器械作用為主的藥械組合產(chǎn)品注冊審查指導(dǎo)原則
如果藥品尚未上市��,我們可接受申請(以前是不接受申請的)�。如果藥品已獲得我國或生產(chǎn)國批準(zhǔn)上市銷售的,需提供上市銷售證明性文件����。建議優(yōu)先采用已批準(zhǔn)上市的藥物�,如果沒有采用�,需說明理由。如果使用的藥物或材料已有藥品�,但申請人采用了非藥品,在聯(lián)審后要求更換為藥品��,需進(jìn)行原材料的等同性分析以及中產(chǎn)品的等同性�,并提供更換后藥品的相關(guān)檢測報(bào)告、生物學(xué)評價(jià)報(bào)告����、性能驗(yàn)證報(bào)告以及穩(wěn)定性研究資料等。楊老師舉了一個(gè)之前審評中的例子:產(chǎn)品的原材料中包含硫酸慶大霉素�,但申請人購買的是未獲得藥品批準(zhǔn)證書的試劑級硫酸慶大霉素。經(jīng)過與藥品審評的聯(lián)合審查后����,要求申請人在產(chǎn)品中使用已批準(zhǔn)的硫酸慶大霉素,并補(bǔ)充相關(guān)資料��。
預(yù)期使用原因:
申請人需提供采用藥械組合方式的合理性和必要性分析�,如臨床治療需求,分析論述添加藥物成分的受益和新增風(fēng)險(xiǎn)�,提供相關(guān)支持性資料。如已有可參考的同類產(chǎn)品或前代產(chǎn)品�,宜提供同類產(chǎn)品或前代產(chǎn)品信息�,說明與其差異并評估影響����。如無明確證據(jù)表明適合開發(fā)為藥械組合醫(yī)療器械,不宜采用藥械組合方式�。
以醫(yī)療器械作用為主的藥械組合產(chǎn)品注冊審查指導(dǎo)原則
作用方式:
作用方式為產(chǎn)品實(shí)現(xiàn)預(yù)期治療效果或作用的手段,藥械組合醫(yī)療器械以醫(yī)療器械作用方式為主�,藥物在醫(yī)療器械主要作用基礎(chǔ)上發(fā)揮作用。申請人需闡明藥物在醫(yī)療器械中發(fā)揮作用的原理��,實(shí)現(xiàn)預(yù)期適用范圍的機(jī)理和作用的持續(xù)時(shí)間��,并提供支持性資料�。 如作為藥械組合醫(yī)療器械,產(chǎn)生新的作用機(jī)理��、新的適應(yīng)證��、新的目標(biāo)人群�、新的使用方法等����,申請人需予以說明。
以醫(yī)療器械作用為主的藥械組合產(chǎn)品注冊審查指導(dǎo)原則
2.2.3包裝說說明
在藥械組合產(chǎn)品的包裝設(shè)計(jì)中�,需要詳細(xì)說明產(chǎn)品的包裝信息�,包括包裝形式�、材料和尺寸。如果產(chǎn)品有多種包裝方式或含有多個(gè)組件��,必須明確每個(gè)組件的包裝方式是分開還是合并����,以及產(chǎn)品是插入盤管還是放入吸塑盒中。這些信息可以通過照片或圖片來輔助說明�。
對于藥械組合產(chǎn)品,需要考慮藥物涂層材料穩(wěn)定性的影響因素�,以確定是否有特殊的包裝要求。同時(shí)��,必須評估無菌屏障系統(tǒng)是否可能對藥物涂層產(chǎn)生不利影響��。最后��,需要確認(rèn)所選用的滅菌方法是否適合產(chǎn)品����,并確保滅菌過程不會(huì)對藥物產(chǎn)生影響。
楊老師也舉例了常用的兩種包裝形式:特衛(wèi)強(qiáng)包裝袋和吸塑盒�。這些包裝形式在確保產(chǎn)品安全性和無菌性的同時(shí),也便于運(yùn)輸和存儲(chǔ)��。
2.2.4與同類或者是前代產(chǎn)品的參考和比較
當(dāng)申報(bào)產(chǎn)品與前代產(chǎn)品相似時(shí),審評將重點(diǎn)關(guān)注差異性的研究����,包括差異性對產(chǎn)品性能和安全有效性的影響。
根據(jù)121號公告�,建議對比的項(xiàng)目包括工作原理、結(jié)構(gòu)及組成��、制造材料�、適用范圍、性能指標(biāo)和作用方式�。對于藥械組合產(chǎn)品,除了這些內(nèi)容外�,還應(yīng)對比藥物成分及含量、劑量密度��、載藥基質(zhì)��、藥物配比�、藥物涂層工藝、藥物與器械的結(jié)合以及藥物釋放機(jī)制等方面的異同����。
2.3風(fēng)險(xiǎn)管理資料
對于藥械組合產(chǎn)品����,需要將藥品和器械視為一個(gè)整體進(jìn)行評估��。特別關(guān)注藥物引入的潛在風(fēng)險(xiǎn)�,特別是當(dāng)藥物成分成熟且已有相關(guān)文獻(xiàn)支持時(shí)��,可以結(jié)合這些資料進(jìn)行評估�。然而,藥械組合醫(yī)療器械中藥物的安全性和有效性可能與單獨(dú)使用藥物時(shí)不同��,通常組合使用后的血藥濃度較低�,因此系統(tǒng)毒性風(fēng)險(xiǎn)較小。通常關(guān)注的是藥物局部應(yīng)用的安全性和有效性��。但如果組合應(yīng)用后的藥物血藥濃度較高�,就需要對系統(tǒng)毒性進(jìn)行評價(jià)。
2.4技術(shù)要求及報(bào)告
前面作者撰寫過關(guān)于醫(yī)療器械技術(shù)要求設(shè)定常見問題��,可參考�。產(chǎn)品技術(shù)要求作為注冊證的附件,包含了產(chǎn)品的型號����、規(guī)格、性能指標(biāo)、檢測方法等詳細(xì)信息����。這些要求基于適用的強(qiáng)制性標(biāo)準(zhǔn)和指導(dǎo)原則,并且對于藥械組合產(chǎn)品����,技術(shù)要求中至少應(yīng)制定藥物含量、微粒�、藥物與器械結(jié)合牢固度、體外藥物釋放�、溶劑殘留等藥物相關(guān)的性能要求。產(chǎn)品技術(shù)要求中不需包括無法客觀判定或不屬于成品功能性安全性指標(biāo)的內(nèi)容��。此外��,結(jié)構(gòu)圖示和材料信息也需提供�,以便在必要時(shí)進(jìn)行許可事項(xiàng)變更。
檢測報(bào)告是另一份重要的申報(bào)資料�,其格式和內(nèi)容需符合新法規(guī)和管理規(guī)定的要求。申請人可以提供自檢報(bào)告�,并按照質(zhì)檢管理規(guī)定提交相關(guān)資料。現(xiàn)在認(rèn)可全自檢����、部分自檢加部分委托全委托的檢測方式。如果是部分自檢加部分委托,需提供完整的自檢報(bào)告��,并將委托檢測報(bào)告內(nèi)容匯總后作為附件提交����。不再要求在原檢測機(jī)構(gòu)進(jìn)行復(fù)檢��,只要有資質(zhì)的檢測機(jī)構(gòu)出具的報(bào)告都被認(rèn)可����。
對于典型性型號分析,建議明確每項(xiàng)檢測項(xiàng)目的典型型號����,通常選擇代表最差情形的型號進(jìn)行檢測,比如說泄壓時(shí)間的典型型號是球囊尺寸最大的型號�,峰值拉力的典型型號是導(dǎo)管外徑半徑最小的型號,那么可以選擇導(dǎo)管外徑最小����,而且是球囊尺寸最大的型號去進(jìn)行檢測。如果多個(gè)項(xiàng)目有相同的典型型號�,可以選擇該型號進(jìn)行檢測。對于不同項(xiàng)目的典型型號��,建議選擇補(bǔ)檢相關(guān)性能的型號。
首次注冊時(shí)��,無論提交的是自檢報(bào)告還是有資質(zhì)的第三方報(bào)告��,都需要進(jìn)行體系核查��。對于變更申請����,如果不涉及產(chǎn)品設(shè)計(jì)、原材料�、生產(chǎn)工藝、適用范圍��、使用方法等變化��,提交有資質(zhì)的第三方報(bào)告時(shí)不需要進(jìn)行核查����。
2.5研究資料的要求
2.5.1物理化學(xué)性能研究
在藥械組合產(chǎn)品的研發(fā)過程中,申請人需要根據(jù)產(chǎn)品的特性和潛在風(fēng)險(xiǎn)確定需要研究的性能��,并參考相關(guān)的標(biāo)準(zhǔn)和指導(dǎo)原則����。對于藥械組合產(chǎn)品�,這包括藥品相關(guān)的性能研究�,如單體或溶劑殘留、添加劑/助劑/催化劑/交聯(lián)劑等殘留�、藥物含量、劑量/生物學(xué)活性��、純度�、雜質(zhì)�、藥物釋放特性、涂層完整性����、涂層耐久性、微粒等����。
藥物若為申請人制備,如合成藥物����、生物制品、中藥����,申請人可參考藥物相關(guān)藥學(xué)研究指導(dǎo)原則提供資料����,若申請人認(rèn)為不必提交藥學(xué)研究指導(dǎo)原則建議的某項(xiàng)或某些資料�,應(yīng)標(biāo)明不適用,并提出充分依據(jù)�。
在設(shè)定性能指標(biāo)時(shí),如果相關(guān)標(biāo)準(zhǔn)提供了具體的指標(biāo)和要求��,制定的要求不應(yīng)低于標(biāo)準(zhǔn)規(guī)定��,并應(yīng)保持檢驗(yàn)方法與標(biāo)準(zhǔn)一致����。如果標(biāo)準(zhǔn)中沒有提供具體要求,申請人需要自行設(shè)定指標(biāo)并提供依據(jù)�,可能包括方法學(xué)的驗(yàn)證。例如��,如果YY/T0663標(biāo)準(zhǔn)沒有對支架徑向支撐力作出具體要求�,申請人自行設(shè)定的指標(biāo)需要有充分的依據(jù),并驗(yàn)證其臨床接受度��。
性能研究報(bào)告應(yīng)包括性能測試的型號及典型性分析�、樣本數(shù)量和確定依據(jù)、接受標(biāo)準(zhǔn)��、測試方法、結(jié)果及分析等�。作者在之前的淺談醫(yī)療器械的設(shè)計(jì)驗(yàn)證階段開展及輸出物要求(詳細(xì)攻略)也有說明, 研究的性能至少應(yīng)包括產(chǎn)品技術(shù)要求中的項(xiàng)目��,并且如果適用�,驗(yàn)證項(xiàng)目需要滿足指導(dǎo)原則的要求。一些性能可以通過型檢報(bào)告替代����,如化學(xué)性能�、耐腐蝕性等。
在選擇測試的典型型號時(shí)����,應(yīng)選擇具有代表性的規(guī)格,應(yīng)能代表最差情形的規(guī)格��。樣本數(shù)量的選擇應(yīng)基于相關(guān)標(biāo)準(zhǔn)的要求����,如果沒有明確要求,則建議根據(jù)統(tǒng)計(jì)學(xué)原則考慮��,如風(fēng)險(xiǎn)�、概率等����。在原材料�、生產(chǎn)工藝和包裝材料保持穩(wěn)定的情況下,性能驗(yàn)證通常沒有批次要求��,但對于特殊產(chǎn)品�,如含有生物活性物質(zhì)的,需要考慮批次差異�。
對于列入產(chǎn)品技術(shù)要求中的項(xiàng)目,接受標(biāo)準(zhǔn)和檢測方法����,性能研究建議與產(chǎn)品技術(shù)要求保持一致。如果提交的驗(yàn)證報(bào)告中的測試樣品與申報(bào)產(chǎn)品有差異�,需要明確這些差異并分析報(bào)告的適用性。
2.5.2醫(yī)療器械與藥物的相互作用
對于藥械組合產(chǎn)品��,宜在設(shè)計(jì)開發(fā)全過程中考慮醫(yī)療器械和藥物間的潛在相互作用����,如器械/藥物性能間的相互增強(qiáng)或削弱。
例如藥物洗脫支架的藥物涂層對支架的置入��、生物相容性會(huì)產(chǎn)生影響����;含藥骨水泥的混合聚合過程可能對藥物有效性產(chǎn)生影響��。
一些藥械組合醫(yī)療器械可能會(huì)出現(xiàn)增效作用��;一些藥物由于器械能量發(fā)出而降低穩(wěn)定性或活性��;一些藥物放射性導(dǎo)致器械材料退化�,因此對于藥械組合醫(yī)療器械而言�,單獨(dú)的器械部分或藥物部分評估可能并不能充分評估產(chǎn)品的安全性和有效性,需進(jìn)一步考慮兩者間的相互潛在作用的影響并提供研究資料�。
以醫(yī)療器械作用為主的藥械組合產(chǎn)品注冊審查指導(dǎo)原則
2.5.3藥物含量/劑量選擇
對于藥械組合產(chǎn)品,需提供藥械組合醫(yī)療器械中藥物的含量/劑量選擇/確定依據(jù)��,如需控制藥物釋放的�,還需提供配方信息如比例以及配方篩選依據(jù)��。當(dāng)參考前代產(chǎn)品或同類產(chǎn)品選擇含量/劑量�,需評估產(chǎn)品設(shè)計(jì)差異的影響,如釋放速率不同����。
2.6生物學(xué)特性研究
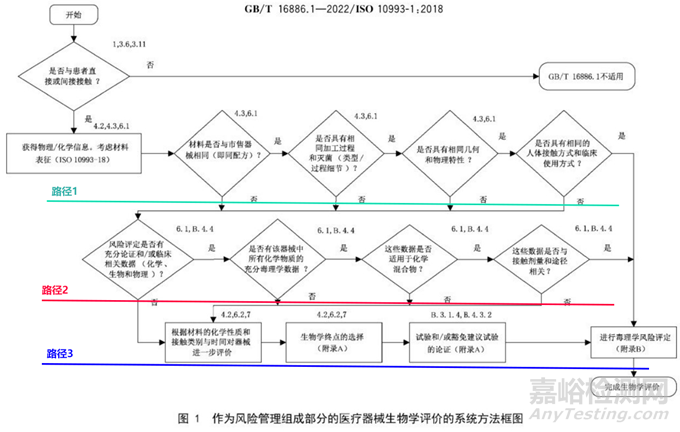
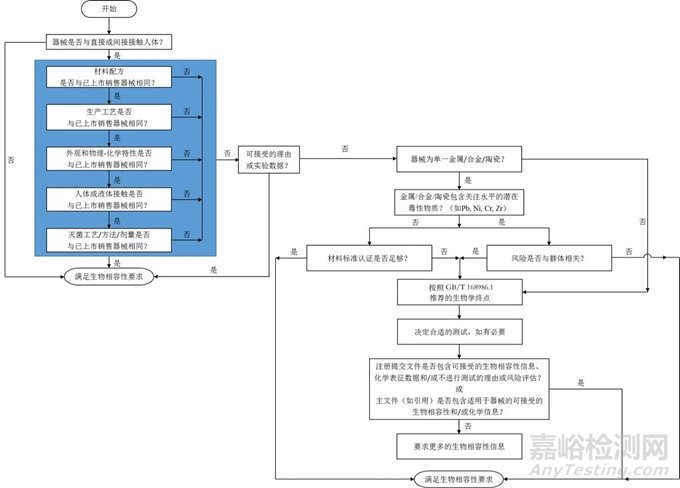
根據(jù)121號文,無論是否進(jìn)行生物學(xué)實(shí)驗(yàn)�,都需要先提交生物學(xué)評價(jià)報(bào)告�。作者前文撰寫過多篇關(guān)于生物學(xué)評價(jià)的文章�,淺談醫(yī)療器械生物學(xué)評價(jià)操作SOP、醫(yī)療器械原材料變化生物學(xué)評價(jià)��、無源植介入類醫(yī)療器械技術(shù)審評生物學(xué)關(guān)注點(diǎn)��、醫(yī)療器械生物學(xué)評價(jià)路徑選擇��、醫(yī)療器械生物學(xué)評價(jià)的技術(shù)評審關(guān)注點(diǎn)�、醫(yī)療器械生物相容性評價(jià)、醫(yī)療器械設(shè)計(jì)開發(fā)流程及質(zhì)量體系核查要求等�,可參考之前撰寫的內(nèi)容進(jìn)行。詳細(xì)的不在此贅述��,按照下圖的方式開展生物學(xué)評價(jià)��。
圖2 生物學(xué)評價(jià)流程圖
報(bào)告內(nèi)容應(yīng)包括的內(nèi)容在121號文件中已十分明確��,在此不過多贅述��。對于藥械組合產(chǎn)品��,藥物可能會(huì)影響生物學(xué)試驗(yàn)的結(jié)果��,申請人可結(jié)合藥物的作用方式、臨床風(fēng)險(xiǎn)/受益論證藥物引入的生物學(xué)風(fēng)險(xiǎn)是否可接受��。
藥物可能會(huì)影響生物學(xué)實(shí)驗(yàn)的結(jié)果����,申請人可以結(jié)合藥物的作用方式,臨床風(fēng)險(xiǎn)收益去論證藥物引入的生物學(xué)風(fēng)險(xiǎn)是否可接受����。比如藥物支架進(jìn)行了細(xì)胞毒性實(shí)驗(yàn)時(shí),如果使用的是帶藥的中產(chǎn)品��,大部分需要對浸提液去進(jìn)行稀釋��,因?yàn)樗幬锟赡軙?huì)帶有毒性�,如果不稀釋的話就沒有辦法去滿足要求。這個(gè)時(shí)候申請人需要明確稀釋的倍數(shù)��,以及對稀釋倍數(shù)去進(jìn)行合理性分析�,可以與同類的已上市產(chǎn)品進(jìn)行實(shí)驗(yàn)時(shí)的稀釋倍數(shù)去進(jìn)行比較比對。
有時(shí)會(huì)采用帶藥和不帶藥的支架進(jìn)行對比實(shí)驗(yàn)����,以評估生物學(xué)風(fēng)險(xiǎn)的可接受性��。對于特殊的藥械組合醫(yī)療器械,由于藥物的接觸時(shí)間可能與器械不同��,需要考慮藥物的持續(xù)作用時(shí)間����、藥物代謝和半衰期等因素,以補(bǔ)充評估藥物引入的長期或持久接觸的生物學(xué)風(fēng)險(xiǎn)����。
在某些情況下,藥械組合醫(yī)療產(chǎn)品可能還需要進(jìn)行其他必要的實(shí)驗(yàn)����,以評估藥物自身特殊的生物學(xué)風(fēng)險(xiǎn)。這些實(shí)驗(yàn)可能包括局部毒性實(shí)驗(yàn)����、光敏毒性實(shí)驗(yàn)、依賴性實(shí)驗(yàn)�、致突變實(shí)驗(yàn)或其他毒理學(xué)實(shí)驗(yàn)。如果不需要開展這些實(shí)驗(yàn)��,需要提供相應(yīng)的理由����。
在藥械組合醫(yī)療器械的開發(fā)中��,藥物通常發(fā)揮的是局部作用����,這意味著產(chǎn)品中的藥物濃度通常低于常規(guī)用藥水平����。因此,如果產(chǎn)品中使用的藥物已經(jīng)獲得批準(zhǔn)并用于其他用途����,可以利用已有的藥物安全性資料來評估產(chǎn)品的安全性。
然而����,需要考慮的是,新的藥械組合方式是否可能改變已知的藥物安全性或有效性��。如果產(chǎn)品的局部藥物暴露超過了已批準(zhǔn)藥物的劑量范圍��,那么可能需要進(jìn)行額外的安全性研究來確保產(chǎn)品的安全性和有效性��,如顱內(nèi)應(yīng)用器械可能導(dǎo)致的局部神經(jīng)毒性等��。
2.7 動(dòng)物試驗(yàn)的要求
對于藥械組合產(chǎn)品��,動(dòng)物試驗(yàn)如同單一的醫(yī)療器械一樣����,并不是強(qiáng)制性的,而是根據(jù)醫(yī)療器械動(dòng)物試驗(yàn)研究和注冊審查指導(dǎo)原則的第一部分決策原則來決定是否需要進(jìn)行����。如果申報(bào)的產(chǎn)品與前代產(chǎn)品在藥物涂層、劑量和球囊材料等方面完全相同����,并且前代產(chǎn)品已經(jīng)完成了動(dòng)物實(shí)驗(yàn),那么可以考慮到動(dòng)物福利和倫理問題��,不必重復(fù)進(jìn)行動(dòng)物實(shí)驗(yàn)�。
如果決策結(jié)果表明需要進(jìn)行動(dòng)物實(shí)驗(yàn),應(yīng)參考指導(dǎo)原則的第二部分�,確保實(shí)驗(yàn)設(shè)計(jì)符合質(zhì)量要求。在試驗(yàn)報(bào)告中�,需要明確動(dòng)物模型的選擇依據(jù)、實(shí)驗(yàn)動(dòng)物的數(shù)量及其確定依據(jù)�、觀察指標(biāo)、觀察終點(diǎn)����、實(shí)驗(yàn)結(jié)果和分析等�。
動(dòng)物試驗(yàn)通常是不需要單獨(dú)開展實(shí)驗(yàn)來研究藥物自身的藥效學(xué)和藥代動(dòng)力學(xué)�,一般在醫(yī)療器械動(dòng)物實(shí)驗(yàn)中進(jìn)行合并的評價(jià)。在試驗(yàn)中設(shè)定藥物相關(guān)的觀察指標(biāo)�,制定的指標(biāo)應(yīng)當(dāng)可以觀察到藥械組合醫(yī)療器械中藥物的有效性,如果是有相關(guān)的臨床文獻(xiàn)等資料��,也可以一并提交去論證��。
在適當(dāng)?shù)臅r(shí)候�,應(yīng)研究藥械組合產(chǎn)品中藥物的體內(nèi)外釋放動(dòng)力學(xué)和體內(nèi)的藥代動(dòng)力學(xué),特別關(guān)注局部組織濃度的變化����。體內(nèi)的藥代動(dòng)力學(xué)研究需要考慮多個(gè)產(chǎn)品聯(lián)合應(yīng)用的情況,以評估在最高藥物暴露劑量下的藥代動(dòng)力學(xué)情況��。此外��,還需考慮藥物耐藥性對產(chǎn)品有效性和公眾健康的影響�。
2.8 穩(wěn)定性研究
穩(wěn)定性研究資料應(yīng)參考《無源植入性醫(yī)療器械穩(wěn)定性研究指導(dǎo)原則》。由于藥物受環(huán)境和時(shí)間影響較大����,藥械組合產(chǎn)品的穩(wěn)定性建議采用實(shí)時(shí)老化方法進(jìn)行研究。
對于藥械組合產(chǎn)品中藥物相關(guān)的穩(wěn)定性����,可以參考藥品相關(guān)的指導(dǎo)原則��。對于受時(shí)間因素影響的性能,需要提交相應(yīng)的貨架有效期驗(yàn)證報(bào)告��。穩(wěn)定性研究通常建議對產(chǎn)品的物理機(jī)械性能和藥品相關(guān)性能進(jìn)行研究��,并提交穩(wěn)定性研究報(bào)告����。
在穩(wěn)定性研究中,除了產(chǎn)品的穩(wěn)定性外�,還應(yīng)包括包裝的穩(wěn)定性和模擬運(yùn)輸?shù)难芯俊_@樣能夠確保產(chǎn)品在整個(gè)使用周期內(nèi)性能穩(wěn)定�,保障患者安全。
2.9臨床評價(jià)
藥械組合產(chǎn)品由于其特殊性�,不適用于免于臨床評價(jià)的醫(yī)療器械目錄。在提交臨床評價(jià)資料時(shí)��,應(yīng)遵循醫(yī)療器械臨床評價(jià)技術(shù)指導(dǎo)原則和相關(guān)文件要求����。注冊申請人應(yīng)根據(jù)這些指導(dǎo)原則來決定是否需要進(jìn)行醫(yī)療器械的臨床實(shí)驗(yàn),并明確開展臨床實(shí)驗(yàn)的主要考慮因素��。
如果決定進(jìn)行臨床實(shí)驗(yàn),必須嚴(yán)格按照《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》(GCP)來執(zhí)行��,并提交完整的臨床試驗(yàn)資料����,包括臨床研究方案、倫理審查報(bào)告等����。在設(shè)計(jì)臨床實(shí)驗(yàn)時(shí),可以參考《醫(yī)療器械臨床實(shí)驗(yàn)設(shè)計(jì)指導(dǎo)原則》��。
對于有境外臨床實(shí)驗(yàn)數(shù)據(jù)的注冊申請人�,可以參考這些數(shù)據(jù)進(jìn)行注冊申請,但需要確保數(shù)據(jù)符合國際醫(yī)療器械監(jiān)管要求����,并且在必要時(shí),可能需要進(jìn)行額外的臨床研究以滿足國內(nèi)注冊要求��。
2.10說明書及標(biāo)簽樣稿
藥械組合產(chǎn)品的說明書和標(biāo)簽樣稿��,應(yīng)明確藥物的成分��,說明書應(yīng)增加關(guān)于藥物過敏等潛在風(fēng)險(xiǎn)的提示。說明書應(yīng)避免包含任何未經(jīng)科學(xué)驗(yàn)證的信息����,以確保信息的準(zhǔn)確性和可靠性。未經(jīng)驗(yàn)證的信息可能會(huì)誤導(dǎo)用戶�,導(dǎo)致不適當(dāng)?shù)氖褂梅绞剑瑥亩黾影踩L(fēng)險(xiǎn)�。
2.11質(zhì)量體系的要求
應(yīng)提交質(zhì)量管理體系核查承諾函、質(zhì)量管理體系文件�,質(zhì)量管理體系文件包括產(chǎn)品描述信息��、一般生產(chǎn)信息��、質(zhì)量管理體系程序文件����、質(zhì)量管理體系核查文件等。對于首次注冊��,必須提交這些文件����。對于注冊變更,如果變更涉及到產(chǎn)品設(shè)計(jì)�、原材料、生產(chǎn)工藝�、使用范圍或使用方法的改變�,需要針對這些變化部分進(jìn)行質(zhì)量管理體系核查����。同時(shí),提交自檢報(bào)告時(shí)�,必須提供相關(guān)的質(zhì)量管理體系文件清單。
對于藥械組合產(chǎn)品��,有特殊的要求��,具體如下:
申請人宜根據(jù)藥物及藥物載體的理化特性和藥物與載體的相互作用�,選擇合適的藥物及藥物載體,并制定合理的生產(chǎn)工藝����,規(guī)定有效的質(zhì)量控制措施及控制指標(biāo)。申請人需在生產(chǎn)制造信息中明確生產(chǎn)工藝流程及關(guān)鍵工藝和特殊工藝控制點(diǎn)����,宜提供藥物與醫(yī)療器械結(jié)合工藝的研究資料,提供加工工藝如滅菌對藥物性能影響的研究資料����。由于需對生物制品的生產(chǎn)過程和中間產(chǎn)品進(jìn)行特殊控制,當(dāng)藥械組合醫(yī)療器械中所含藥物為生物制品時(shí),宜參照生物制品相關(guān)導(dǎo)則開展研究��。
以醫(yī)療器械作用為主的藥械組合產(chǎn)品注冊審查指導(dǎo)原則
2.12 電子申報(bào)資料項(xiàng)目提交要求
申請人應(yīng)按照醫(yī)療器械注冊電子申報(bào)系統(tǒng)(eRPS)格式要求準(zhǔn)備相關(guān)申報(bào)資料����,并在CH3.8(其他資料)提交藥物相關(guān)產(chǎn)品描述、藥物和/或醫(yī)療器械與藥物相互作用����、藥物含量/劑量選擇資料。
這些資料應(yīng)該在注冊文件目錄中指定的CH3.8部分提交����。具體包括但不限于以下內(nèi)容:藥物載藥基質(zhì)�、輔料信息、國內(nèi)外上市批件�、醫(yī)療器械與藥物相互作用研究、藥物含量和劑量選擇����、藥物與載藥基質(zhì)/輔料的配比等。由于同屬于產(chǎn)品方面的研究�,本文中將醫(yī)療器械與藥物相互作用研究、藥物含量和劑量選擇歸納在了研究資料中了��,應(yīng)放在CH3.8其他資料中提交。若具體研究資料在其他eRPS項(xiàng)目提交����,需明確相應(yīng)的eRPS項(xiàng)目編號及文件名稱。如適用��,建議其他項(xiàng)目中藥物相關(guān)資料以附件形式提交����,資料名稱宜參照以下命名規(guī)則:舉例:藥物相關(guān)-CH3.7.1 產(chǎn)品穩(wěn)定性-附件1:實(shí)時(shí)老化研究報(bào)告。
第三部分:特別的話
在資料提交方面��,根據(jù)當(dāng)前法規(guī)�,企業(yè)只有一次機(jī)會(huì)進(jìn)行資料補(bǔ)正。為了提高資料準(zhǔn)備的質(zhì)量和通過率����,器審中心引入了預(yù)審查程序。如果企業(yè)在資料準(zhǔn)備過程中擔(dān)心可能不符合要求��,可以通過預(yù)審查程序讓主審再次審查資料�。
需要注意的是,預(yù)審查的資料并不等同于正式資料����,因此��,即使在預(yù)審查中資料被認(rèn)為是合格的�,企業(yè)在正式提交補(bǔ)正資料時(shí)����,仍需要將所有資料再次提交,以確保完整性��。在上傳資料時(shí)�,企業(yè)應(yīng)確保所有必要的文件都被提交,而不僅僅是對預(yù)審查中發(fā)現(xiàn)問題的補(bǔ)正����。
結(jié)束語:綜上本篇論述了以醫(yī)療器械為主的藥械組合產(chǎn)品的注冊申報(bào)資料要求,其中以涵蓋了我們在設(shè)計(jì)開發(fā)中的注意事項(xiàng)��。