鋰離子(Li+)在電極材料中的擴(kuò)散是鋰離子電池電極反應(yīng)動力學(xué)的重要內(nèi)容�����,Li+擴(kuò)散系數(shù)是衡量材料倍率性能和電池電化學(xué)仿真建模必不可少的參數(shù)之一�����。
根據(jù)菲克第二定律測定Li+擴(kuò)散系數(shù)的方法有很多�����,不同測試方法在室溫下(25℃)所得的Li+擴(kuò)散系數(shù)不盡相同。本文作者通過拆解車載商用動力鋰離子電池�����,以正極材料組裝扣式電池,利用GITT測定正極材料的Li+擴(kuò)散系數(shù)�����,并考慮Li+濃度�����、充放電過程及溫度對Li+擴(kuò)散系數(shù)的影響�����,以期為建立更加精準(zhǔn)的電化學(xué)模型提供參考�����。
1�����、 實驗
1.1 材料形貌分析
實驗電池為額定容量102Ah的三元正極材料鋰離子電池(148mm×52mm×96mm)�����,負(fù)極活性物質(zhì)為石墨,正極活性物質(zhì)為三元材料 NCM811�����。用高分辨場發(fā)射掃描電子顯微鏡進(jìn)行形貌觀測以及能譜(EDS)組成分析。
1.2 扣式電池制作
在氬氣保護(hù)的手套箱中拆解實驗電池�����,將正極片在DMC中浸泡24h�����,以去除電解質(zhì)殘留物�����,并在手套箱中干燥�����。用無水乙醇小心擦除電極涂膏層的一側(cè),同時保證另一側(cè)完好無損�����,之后,裁切成直徑為14mm的圓片�����。以金屬鋰片為對電極�����,Celgard2325膜為隔膜�����,1mol/L LiPF6/EC+DMC(體積比1∶1)為電解液�����,在充滿Ar氣的手套箱中于25℃干燥24h�����,組裝成開路電壓約為3.00V的CR2032型扣式電池,制作完成后�����,擱置12h�����。
1.3 電池測試
化成步驟:25℃下�����,用電池測試系統(tǒng)以0.05C小電流對電池進(jìn)行一次恒流充放電�����,電壓為3.00~4.45V�����,靜置8h�����。
扣式電池完成化成后�����,用電池測試系統(tǒng)在25℃下進(jìn)行容量測試,用高低溫實驗箱進(jìn)行后續(xù)實驗的溫度(-20℃�����、0 ℃�����、25℃和55℃)控制�����。
容量(SOC區(qū)間0~1.000)測試:以 0.10C恒流充電至4.4V�����,轉(zhuǎn)恒壓充電至0.05C,靜置2h�����;以0.10C恒流放電至3.00V�����。循環(huán)3次�����,計算平均容量�����。
1.4 GITT 測試
GITT測試是在一定SOC的平衡狀態(tài)下,以恒定短電流脈沖來激勵電池,在脈沖期間和電流脈沖之后的松弛期間記錄電壓�����。在變化的電壓中�����,歐姆壓降僅充當(dāng)一個常數(shù)。該常數(shù)會偏移所測量的電壓�����,但不會改變曲線的形狀�����。忽略反應(yīng)動力學(xué)的影響,假定將恒定電流短脈沖期間的電壓變化減去歐姆壓降后得到的電壓變化�����,是由濃度梯度的形成所致�����,并符合一維菲克擴(kuò)散定律�����,在小電流I及電勢E與t成線性關(guān)系的條件下,可由式(1)得出Li+擴(kuò)散系數(shù)DGITT的數(shù)值:
式(1)中:r是正負(fù)極活性物質(zhì)粒子半徑�����;t是脈沖電流持續(xù)時間�����;ΔEs是電流脈沖期間平衡電壓的變化�����;ΔEt是電流脈沖期間減去歐姆壓降后的總電壓變化�����。
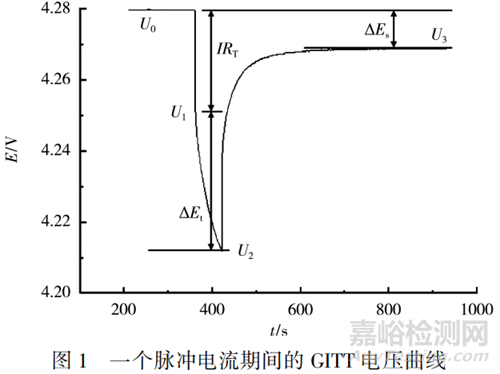
一個脈沖期間內(nèi)的電壓曲線見圖1�����。圖1中:U0為電池在某個SOC下靜置一段時間后的平衡電壓。在施加小電流I時�����,由于電池內(nèi)阻RT產(chǎn)生瞬時歐姆壓降�����,電壓下降至U1�����,接著�����,下降至最低點U2�����;撤去電流脈沖后�����,電壓回彈�����,最終在長時間靜置后回到平衡電壓U3�����。
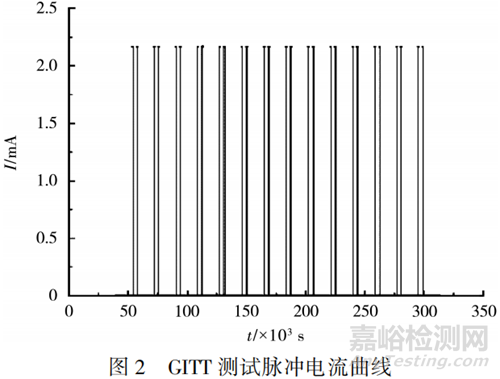
具體測試方法為:用電池測試系統(tǒng)進(jìn)行測試,在每一個給定的SOC點�����,以0.50C短脈沖電流激勵60s�����,靜置1h�����,至電壓達(dá)到穩(wěn)定后�����,以0.50C激勵電流持續(xù)一定的時間�����,到達(dá)下一個指定的SOC點,靜置4h�����,使電池內(nèi)部達(dá)到均衡狀態(tài)�����。循環(huán)上述過程�����,直至達(dá)到截止電壓�����。25℃下�����,充電工況的GITT測試脈沖電流見圖2�����。
2�����、 結(jié)果與討論
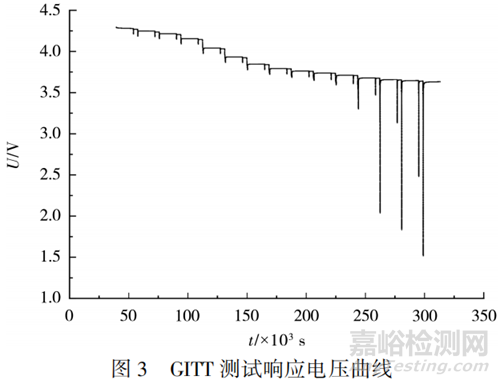
在25℃下進(jìn)行放電工況測試,得到的GITT測試響應(yīng)電壓曲線�����,如圖3所示�����。將圖3中每個SOC點下的第一段電壓變化進(jìn)行處理�����,即可得到對應(yīng)SOC點下的固相Li+擴(kuò)散系數(shù)�����。
2.1 粒子半徑
正極材料的微觀分析圖見圖4�����。識別圖4中的粒子邊界并統(tǒng)計粒子半徑分布�����,最后取正極活性物質(zhì)粒子半徑為2.25μm�����。
2.2 Li+濃度對Li+擴(kuò)散系數(shù)的影響
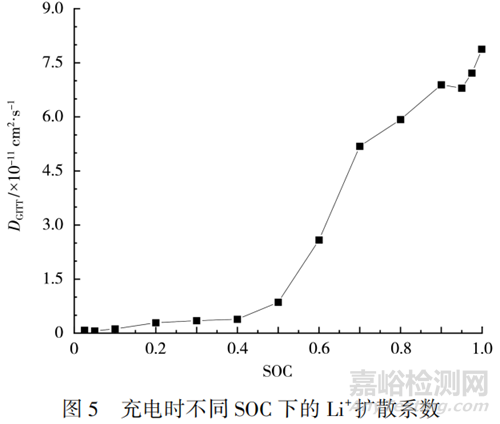
Li+濃度是影響電極材料物理化學(xué)特性的關(guān)鍵因素之一�����,Li+的擴(kuò)散速率與材料的晶體結(jié)構(gòu)�����、Li+傳輸機(jī)制有關(guān)�����,也受嵌脫過程中晶胞參數(shù)體積變化(摩爾體積變化)�����、相變和過渡金屬離子的價態(tài)變化等條件影響�����。25℃下,充電過程中Li+擴(kuò)散系數(shù)隨SOC的變化見圖5�����。
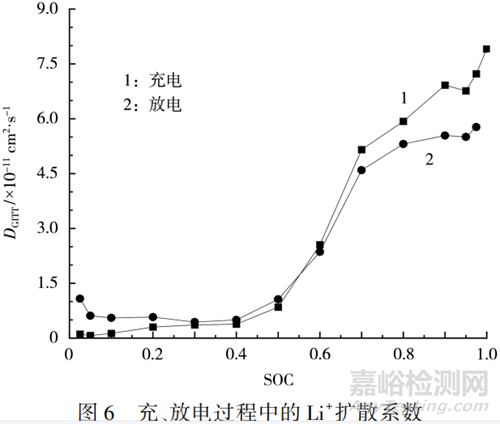
在充電工況下�����,隨著 SOC 的升高�����,Li+在正極活性物質(zhì)中脫出�����,Li+濃度下降�����。從圖5可知�����,Li+擴(kuò)散系數(shù)隨著Li+濃度的下降逐漸增大,當(dāng)SOC=0.025 時�����,為 1.52×10-12cm2/s�����;當(dāng)SOC=1.000時�����,為8.06×10-11cm2/s�����。在SOC較低、Li+濃度較高的階段�����,Li+擴(kuò)散系數(shù)變化不大�����,維持在較低的水平�����。
該現(xiàn)象可用簡單的空位機(jī)制或間隙機(jī)制來解釋�����。在電池內(nèi)部的反應(yīng)過程中,有序的正極材料會發(fā)生兩相反應(yīng)�����,即原始晶格因Li+的嵌脫發(fā)生結(jié)構(gòu)破壞�����,變成另一種結(jié)構(gòu)�����,此時�����,發(fā)生的成核生長及晶界運動,將限制Li+嵌脫過程的動力學(xué)�����。此過程主要發(fā)生在晶格周圍的空位(群)或間隙中,活性物質(zhì)中的Li+濃度越大�����,晶格中空位數(shù)和間隙數(shù)越少�����,Li+的擴(kuò)散越困難,因此Li+擴(kuò)散系數(shù)隨Li+濃度的升高而降低�����。
2.3 充放電過程對Li+擴(kuò)散系數(shù)的影響
在25℃下測得的充�����、放電過程中的Li+擴(kuò)散系數(shù)見圖6�����。從圖6可知,充�����、放電過程中的Li+擴(kuò)散系數(shù)都集中在10-11~10-12cm2/s�����。在低SOC區(qū)間(0~0.200)�����,同一SOC下放電時的Li+擴(kuò)散系數(shù)大于充電時�����;當(dāng)SOC為0.300~0.600時,二者并無明顯差別�����;而在高SOC區(qū)間(0.700~1.000)�����,Li+擴(kuò)散系數(shù)急速上升�����,并且同一SOC下放電時的Li+擴(kuò)散系數(shù)小于充電時�����。原因是正極材料在放電工況下,Li+在活性物質(zhì)中嵌入�����,受到已嵌入的Li+的排斥�����,同時還要克服正極材料之間的膨脹力。
2.4 溫度對 Li+擴(kuò)散系數(shù)的影響
不同溫度下的Li+擴(kuò)散系數(shù)(充放電過程中的平均數(shù)據(jù))見圖7�����。從圖7可知�����,Li+擴(kuò)散系數(shù)隨著溫度的升高逐漸增加�����。25℃時的Li+擴(kuò)散系數(shù)比-20℃時高一個數(shù)量級。在55℃時�����,整個SOC區(qū)間內(nèi)Li+擴(kuò)散系數(shù)變化較大�����,從8×10-12cm2/s上升至2×10-10cm2/s以上�����。
擴(kuò)散的本質(zhì)是原子、離子或分子的無規(guī)則熱運動�����,因此,Li+在材料中的擴(kuò)散過程與溫度的關(guān)系很密切�����。溫度越高�����,擴(kuò)散速度越快,且服從阿倫尼烏斯公式�����。Li+擴(kuò)散系數(shù)與溫度的關(guān)系�����,如式(2)所示:
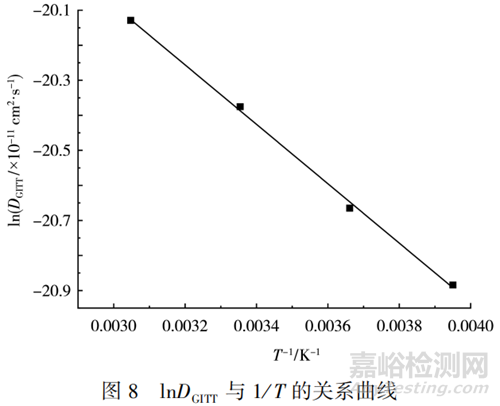
式(2)中:D0為指前因子�����;ΔH為擴(kuò)散活化焓�����;KB為波爾茲曼常數(shù)�����;T為熱力學(xué)溫度�����,K�����。通過阿倫尼烏斯公式�����,擬合得到的Li+擴(kuò)散系數(shù)隨溫度變化的情況見圖8。
從圖8可知�����,lnDGITT與1/T呈線性關(guān)系�����,擬合得到的表達(dá)式見式(3)�����。
圖8中擬合得到的相關(guān)系數(shù)的平方為0.9986,表明lnDGITT與溫度有較強(qiáng)的線性關(guān)系�����。由式(3)計算得到的Li+在正極活性物質(zhì)中擴(kuò)散的活化能為7.061 kJ/mol�����。活化能為正�����,說明Li+擴(kuò)散系數(shù)隨著溫度的上升而增大�����,且較低的活化能壁壘有利于Li+在活性物質(zhì)中快速發(fā)生擴(kuò)散�����。
3�����、 結(jié)論
本文作者拆解得到商用三元電池正極材料,采用GITT方法測得Li+在正極固相中的擴(kuò)散系數(shù)�����,并考慮Li+濃度�����、充放電過程及溫度對于Li+擴(kuò)散系數(shù)的影響�����,得出如下結(jié)論:
測得的Li+擴(kuò)散系數(shù)為10-10~10-12cm2/s,并主要集中在10-11cm2/s左右�����。隨著Li+濃度的增加�����,Li+擴(kuò)散系數(shù)逐漸下降�����,不易在固相材料中發(fā)生擴(kuò)散�����。在低SOC區(qū)間�����,放電過程的Li+擴(kuò)散系數(shù)大于充電過程�����;在高SOC區(qū)間�����,放電過程的Li+擴(kuò)散系數(shù)小于充電過程�����。溫度對Li+的擴(kuò)散有較大的影響�����,溫度越高�����,Li+在固相中越容易擴(kuò)散,擴(kuò)散系數(shù)越大�����。
文獻(xiàn)參考:方乾, 張希, 郭邦軍,等. 鋰離子擴(kuò)散系數(shù)的測定及影響因素[J]. 電池, 2022(052-003).