抗體偶聯(lián)藥物 (ADC) 是一類新興的強效生物藥物��,它通過合適的連接子將強效細胞毒性有效載荷與工程化單克隆抗體結(jié)合起來��,實現(xiàn)其偶聯(lián)化合物的組織特異性遞送�。該抗體通過靶向腫瘤細胞表面表達的特定抗原�,幫助將偶聯(lián)的有效載荷遞送到特定的疾病部位。因此減少了因旁觀者效應(yīng)引起的副作用�,提高了治療指標。盡管有100多種ADC處于臨床試驗階段�,但FDA批準臨床使用的ADC只有14種(截止原文發(fā)表)����。14種獲批藥物中��,有7種用于臨床治療血液系統(tǒng)惡性腫瘤�,7種用于治療實體腫瘤。由于脫靶毒性和低療效�,大多數(shù)ADC在臨床階段停止或終止,超過100種ADC正在臨床試驗中�。
不完善的連接/偶聯(lián)方法以及分子量、連接子長度�、位阻、半衰期��、異質(zhì)性和合適關(guān)鍵組分的選擇等理化因素是導致ADC不成功的根本原因�。具有靶向合適抗原的抗體、連接子和化學穩(wěn)定的有效載荷的ADC可以精確靶向腫瘤細胞����,提高治療指數(shù)。選擇腫瘤區(qū)域特異性的抗原和抗體可以減少脫靶毒性和旁觀者效應(yīng)����。理想的連接子有助于通過防止脫靶載荷來提高ADC的穩(wěn)定性。有效載荷應(yīng)具有高效力�,較低的半數(shù)最大抑制濃度 (IC50) 值以及對體循環(huán)理化條件的穩(wěn)定性��。
在本文中��,我們將討論關(guān)鍵成分及其對ADC療效的重要作用或貢獻�。此外��,我們還介紹了偶聯(lián)方法的最新進展��。此外�,我們還將重點介紹了ADC的作用模式、當前的挑戰(zhàn)和未來的前景����,以克服當前的挑戰(zhàn)����。本文將深入探討成功的ADC開發(fā)過程中應(yīng)考慮的關(guān)鍵因素。
ADC的關(guān)鍵部件
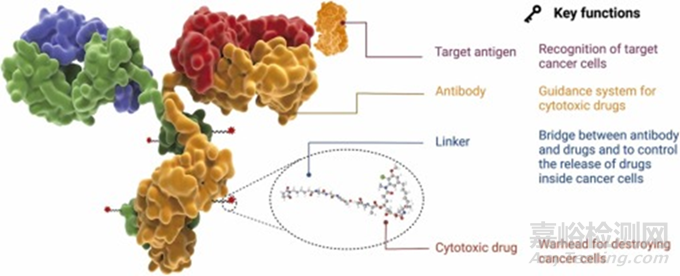
ADC由抗體��、連接子和細胞毒性有效載荷組成 (圖1)����。ADC的每一個組成部分都起著至關(guān)重要的作用,使ADC穩(wěn)定以及潛在地使副作用最小化�。理想的ADC應(yīng)能有效地到達靶點而不釋放任何脫靶載荷�,并具有殺死腫瘤細胞而不影響正常健康細胞的效力����。為了開發(fā)一種有效的ADC,必須考慮抗原�、抗體、高毒性載荷以及連接子的選擇等因素����。
圖1. ADC的原理圖,展示了關(guān)鍵部件及其重要作用�。ADC的關(guān)鍵成分包括抗體、連接子和細胞毒性藥物 (有效載荷)�。抗體幫助ADC獲得靶向特異性結(jié)合��,有效載荷有助于破壞腫瘤細胞�。此外,連接子在抗體和有效載荷之間起橋梁作用��,控制藥物脫靶釋放和不良副作用����。
抗原的選擇
靶抗原有助于區(qū)分腫瘤細胞和正常細胞,從而降低脫靶毒性。因此�,選擇合適的靶抗原是開發(fā)理想ADC的第一步。理想的抗原必須具有某些特征����,如i)與健康細胞相比,它應(yīng)該在腫瘤細胞表面過表達��。例如����,人表皮生長因子受體2 (HER2) (三陽性乳腺癌的靶抗原) 在腫瘤細胞中的拷貝數(shù)是正常細胞的100倍。ii) 靶抗原的結(jié)合位點應(yīng)面向腫瘤細胞的外表面��,而不是面向腫瘤細胞的內(nèi)部��,使從血管擴散的ADC能夠在內(nèi)化之前與靶抗原結(jié)合�;iii) 靶抗原不應(yīng)進入體循環(huán),以避免ADC在腫瘤外的不必要結(jié)合��;iv) 靶抗原應(yīng)具有內(nèi)化結(jié)合ADC的效力����。在已批準和處于臨床期的ADC中��,最常用的血液和實體瘤靶點分別是CD33����、CD30�、CD22����、BCMA、CD19�、CD79B和HER2、Nectin-4�、Trop-2、EGFR�、組織因子(TF) 。此外��,細胞外基質(zhì)成分��、促進血管生成的因子和腫瘤微環(huán)境成分已被報道為殺死腫瘤細胞的可能靶點�,并在臨床前和臨床階段顯示出其效力。計算機模型的最新進展有助于更快��、更經(jīng)濟地選擇靶抗原��。在這種方法中����,與包含基因組數(shù)據(jù)�,特別是最豐富的腫瘤類型的mRNA分析數(shù)據(jù)����,的公開可用數(shù)據(jù)庫進行比較分析。主要數(shù)據(jù)庫有腫瘤基因組圖譜(Cancer Genome Atlas, TCGA) 和基因組織表達(Gene-Tissue Expression, GTEx)�。
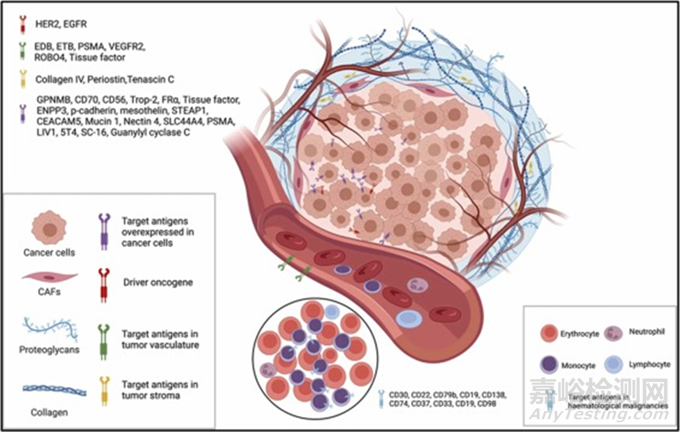
圖2. 示意圖為腫瘤細胞和腫瘤微環(huán)境中最常用的靶抗原。靶點包括過表達的表面抗原�、腫瘤微環(huán)境如ECM成分、血管生成支持因子等����。圖2解釋了主要使用的靶抗原?���?s寫:HER2(人表皮生長因子受體2)、EGFR(表皮生長因子)�、ETB(內(nèi)皮素受體)、PSMA(前列腺特異性膜抗原)����、VEGRF2(血管內(nèi)皮生長因子受體-2)�、ROBO4 (Roundabout同源物4)、GPNMB(糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B)、ENPP3(外核苷酸焦磷酸酶/磷酸二酯酶3)����、STEAP1(前列腺六跨膜上皮抗原1)、CEACAM5(腫瘤胚抗原相關(guān)細胞粘附分子5)����、SLC44A4( 溶質(zhì)載體家族44成員4),CAFs(腫瘤癥相關(guān)成纖維細胞)����。
抗體的選擇
在理想ADC中,抗體是與靶抗原特異性結(jié)合的重要載體����。抗體必須對靶抗原具有高結(jié)合親和力和低免疫原性�。此外,抗體應(yīng)具有維持較長的血漿半衰期和快速內(nèi)化的能力����。在過去的幾十年里,小鼠抗體 (小鼠衍生)被用于ADC�,但具有高免疫原性和針對抗體的適應(yīng)性免疫反應(yīng)。經(jīng)過重組技術(shù)的發(fā)展�,嵌合抗體最終于1988年被開發(fā)出來��。嵌合抗體是將小鼠衍生的可變區(qū)與人衍生的恒定區(qū)融合而成�。而人源化抗體則是將小鼠源性抗體的互補決定區(qū) (CDR) 與人抗體的可變區(qū)結(jié)合在一起��。人血清中共存在5種抗體����。其中免疫球蛋白G (IgG) 類是最豐富的血清抗體,約占總抗體的70-85%��,半衰期約為21天����。由于IgG具有最豐富的抗體種類和啟動免疫效應(yīng)的效力,因此IgG是ADC發(fā)展中最常用的抗體����。此外,IgG類抗體有IgG1��、IgG2����、IgG3和IgG4 4類亞類。在這四個亞類中��,IgG1是ADC發(fā)展中使用最多的抗體,并已被證明是一種有效的免疫效應(yīng)器��。一般來說����,抗腫瘤抗體藥物通過Fc介導的效應(yīng)功能起作用�,如抗體依賴性細胞介導的細胞毒性 (ADCC)、補體依賴性細胞毒性 (CDC) 以及抗體依賴性細胞吞噬 (ADCP)��?;阢q鏈區(qū)域的長度、鏈間二硫鍵和Fc效應(yīng)功能�,IgG的每個抗體亞類都是獨一無二的。為了獲得最佳的ADCC效果�,最小值為10^ 5-10 ^6個靶抗原應(yīng)在腫瘤細胞表面表達。雖然IgG1對FCYR具有很高的結(jié)合親和力����,但與其它亞類相比,IgG1誘導ADCC和CDC更有效��。ADC的半衰期取決于與Fc受體的結(jié)合親和力�。工程Fc部分在增加結(jié)合親和力方面起著至關(guān)重要的作用。例如��,在一項研究中,作者描述在缺乏人類IgG1 (N-鏈寡糖)的情況下�,IgG1對FcYrIII具有更強的結(jié)合親和力,同時能夠誘導更多的ADCC��。
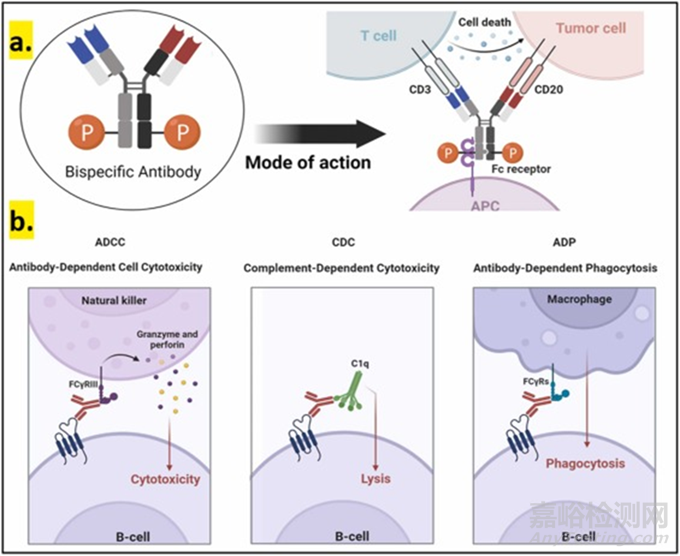
圖3. 該示意圖代表了基于抗體的療法的作用模式��。A) 解釋了雙特異性抗體的結(jié)構(gòu)和作用方式����。雙特異性抗體能夠同時結(jié)合兩種不同類型的靶標。一只手臂與效應(yīng)細胞 (如自然殺傷細胞和T細胞)結(jié)合�,另一只手臂與靶抗原結(jié)合。這種現(xiàn)象激活效應(yīng)細胞�,破壞腫瘤細胞。B) 解釋了基于抗體的治療方法殺死靶向腫瘤細胞的原理�。幫助抗體殺死腫瘤細胞的三種最重要的機制是ADCC、CDC和ADP�。在ADCC中,抗體的Fc區(qū)與Fcγ受體結(jié)合��,在效應(yīng)細胞表面表達��,同時與靶細胞結(jié)合��?���?贵w與Fcγ受體結(jié)合觸發(fā)效應(yīng)細胞的激活�,并分泌穿孔素�、顆粒酶和其它細胞毒性產(chǎn)物,殺死腫瘤細胞��。在CDC中�,一種抗體結(jié)合靶細胞和C1q組分����,誘導腫瘤細胞表面形成膜攻擊復合物,導致腫瘤細胞死亡����。在ADP中,抗體與靶細胞和巨噬細胞結(jié)合�,通過巨噬細胞吞噬靶腫瘤細胞。
IgG2在體內(nèi)通過非共價結(jié)合和高溫形成二聚體����。此外,由于位阻�,降低ADC的血漿濃度,ADC的效力降低�。IgG3的半衰期很短�,約為7天����,因此降低了ADC的治療效果,并且在半衰期增加的同時不能改善Fc介導的效應(yīng)物功能����。盡管IgG4具有誘導ADCC的能力,但它含有fab臂交換��,導致有效性降低��。內(nèi)化是影響ADC療效的另一個主要因素��。特別是在實體瘤中��,抗體應(yīng)具有較長的半衰期以及在體循環(huán)中的高穩(wěn)定性��,通過滯留和滲透作用有效到達腫瘤部位��。然而����,為了獲得滿意的療效,ADC應(yīng)在整個腫瘤中均勻分布,ADC分布不均勻會導致療效不理想��。解離常數(shù) (Kd) 是影響ADC內(nèi)化至腫瘤細胞的主要因素����。Kd越低,抗體與存在于腫瘤細胞表面的新生Fc受體 (FcRn) 的結(jié)合親和力越高�,導致療效較低。因此��,理想情況下����,Kd應(yīng)該高�,以便有效穿透并均勻分布在整個腫瘤細胞中。因此��,在成功開發(fā)ADC時應(yīng)考慮所有這些參數(shù)�。此外,抗體的分子量是影響ADC進入腫瘤細胞的另一個關(guān)鍵因素�。IgG抗體分子量約為150千道爾頓 (KDa)。由于ADC的高分子量�,使其穿透血管到達腫瘤部位成為一個具有挑戰(zhàn)性的部分。因此����,理想的ADC開發(fā)應(yīng)考慮較小的Ab尺寸����。為了克服這一問題����,一種低分子量ADC被開發(fā)出來,目前正在研究中����。在這些ADC中,有效載荷與抗體的小片段或抗體的成分結(jié)合在一起�。
連接子
連接子是抗體和有效載荷之間的橋梁,對ADC的穩(wěn)定性和有效性起著重要作用��。此外����,有效載荷的釋放也主要取決于連接子的類型和性質(zhì)。理想的連接子應(yīng)具有高度的水溶性��,防止ADC聚集的形成以及有效載荷在體循環(huán)中的過早釋放��。一般情況下�,可以對ADC的抗體�、連接子和有效載荷等3個組成部分進行修改�,從而獲得穩(wěn)定、有效的ADC��。影響連接子穩(wěn)定性和載荷釋放的三個主要因素是偶聯(lián)位點�、位阻和連接子長度。
通過選擇特定的偶聯(lián)位點和修飾的連接子�,已經(jīng)開發(fā)了一些不同的方法來獲得穩(wěn)定的ADC。
對ADC的穩(wěn)定性的影響
偶聯(lián)位點是影響ADC穩(wěn)定性的主要因素����,其次是影響其療效的因素。例如����,在一項研究中考察了將半胱氨酸偶聯(lián)位點工程置于HER2/neu抗體不同位點的影響����,結(jié)果對于穩(wěn)定性存在差異。偶聯(lián)位點可以在體循環(huán)中對逆邁克爾反應(yīng)介導的有效載荷損失產(chǎn)生抗性��。它還可以影響體內(nèi)非特異性纈氨酸-瓜氨酸(Val−Cit)的解偶聯(lián)�。也有報道稱,偶聯(lián)位點還可以通過降低代謝負荷來提高ADC的療效����。這項研究表明�,偶聯(lián)位點對ADC的穩(wěn)定性起著至關(guān)重要的作用����。
根據(jù)研究,偶聯(lián)位點產(chǎn)生空間屏蔽��,導致ADC穩(wěn)定性的變化����。單克隆抗體提供的空間屏蔽調(diào)節(jié)連接子的解偶聯(lián)和有效載荷的代謝。例如�,HC-A140、HC-A118和LC-K149等偶聯(lián)位點周圍的高空間屏蔽提高了ADC的穩(wěn)定性�,同時降低了組分溶劑可及性 (FSA)。另一個因素是連接子長度����,據(jù)報道通過單克隆抗體與有效載荷之間的距離影響空間屏蔽,導致ADC穩(wěn)定性的變化����,[39]。與長度較長的連接子相比��,較短的連接子具有更好的ADC穩(wěn)定性。較短的連接子使有效載荷更靠近抗體提供的空間屏蔽體����。理想情況下,連接子應(yīng)該在體循環(huán)中穩(wěn)定�,并在目標腫瘤細胞中以化學或酶的方式解偶聯(lián)。有效解偶聯(lián)連接子�、以釋放足夠量的有效載荷是ADC有效性的關(guān)鍵因素。已經(jīng)有研究考慮了各種連接子的改性技術(shù)以及連接子的化學性質(zhì)�。本文將討論兩種主要的連接方法:馬來酰亞胺連接和二硫鍵連接。馬來酰亞胺可用于可切割和不可切割的連接子�。而可切割連接子采用二硫鍵。在這兩種連接體系中��,最關(guān)鍵的因素是在解偶聯(lián)位點上形成的位阻����,這可以通過多種化學修飾技術(shù)來實現(xiàn)。
對載荷釋放的影響
有效載荷的快速釋放取決于用于連接單克隆抗體和細胞毒性有效載荷的偶聯(lián)/連接技術(shù)的類型��。對于基于不可切割連接子的ADC��,通常抗體通過溶酶體蛋白酶水解�,形成小肽-有效載荷偶聯(lián)物�。而在可切割連接子的情況下�,一個游離的未修飾的有效載荷釋放在溶酶體內(nèi)部。這些ADC經(jīng)過化學或酶的裂解����。因此��,有效載荷的釋放速率取決于連接子的解偶聯(lián)方法和連接子的破壞步驟�。馬來酰亞胺法和二硫鍵法都影響其釋放速度。含有馬來酰亞胺連接子的ADC釋放其有效載荷的速度比含有二硫化物連接子的ADC更快��。因此����,偶聯(lián)位點對有效載荷釋放速率有很大的影響��。如LC-K149�、LCV205、HC-A140�、HC-A118位點之間的比較研究發(fā)現(xiàn),HC-A118C釋放有效載荷的速度比LC-K149快15 min��。偶聯(lián)位點的位阻增加了ADC的穩(wěn)定性�,但降低了載荷釋放率。例如����,根據(jù)研究,通過環(huán)丙基與環(huán)丁基連接子的比較�,發(fā)現(xiàn)環(huán)丙基類似物在腫瘤細胞中釋放有效載荷的效果不如環(huán)丁基。
因此��,為了有效地釋放有效載荷而對ADC進行修改是另一個關(guān)鍵且具有挑戰(zhàn)性的因素����?���?傊悸?lián)位點��、連接子位阻和連接方式是影響ADC穩(wěn)定性和有效性的主要因素��。
有效載荷
有效載荷是ADC的彈頭����,是一種高細胞毒性藥物�。理想的ADC應(yīng)具有強效性,對全身循環(huán)中多種代謝或分解代謝過程中的任何化學反應(yīng)都具有穩(wěn)定性��,溶解度高����。此外,它還應(yīng)具有偶聯(lián)和膜透性的官能團�。
盡管由于溶酶體屏障和腫瘤微環(huán)境的復雜性����,很少有細胞毒性藥物能到達靶點,但低IC50值的有效載荷應(yīng)該是一種高效的理想ADC的選擇�。DAN破壞類有效載荷的IC50值為皮摩爾濃度,而微管抑制劑的IC50值為納摩爾范圍��。例如��,Duocarmycin��、Pyrolobenzodiazepines的IC50值分別為1-10 pM和0.1-1 pM����,對腫瘤細胞的殺傷效率很高�。此外����,另外兩種被認可的脫氧核糖核酸(DNA)損傷強效細胞毒有效載荷是Calicheamicins和Exatecans��,IC50值分別為0.1-1 nM和1-10 nM�。在穩(wěn)定性方面����,有效載荷應(yīng)該在系統(tǒng)循環(huán)和生產(chǎn)過程中對任何化學反應(yīng)都是穩(wěn)定的。不穩(wěn)定的有效載荷可以轉(zhuǎn)化為前藥形式�,在血液循環(huán)中轉(zhuǎn)化為活性形式,導致不良副作用�。如果有效載荷在溶酶體狀態(tài)下不穩(wěn)定�,則應(yīng)在細胞表面或進入細胞之前將有效載荷分離。特別是����,對溶酶體蛋白酶不敏感的有效載荷不應(yīng)用于不可切割的連接子。以α氨基酸和酯為官能團的有效載荷通常對溶酶體蛋白酶不穩(wěn)定��。高效液相色譜 (HPLC) 技術(shù)可以通過兩種方式分析有效載荷的穩(wěn)定性�。首先,將含有放射性標記有效載荷的ADC與細胞孵育�。然后,用分離的溶酶體孵育未結(jié)合的有效載荷��。
在溶解度和膜滲透性方面�,一般來說��,由于抗體的蛋白質(zhì)性質(zhì)��,偶聯(lián)過程是在水環(huán)境中進行的����,可能是水不相容的有機溶劑�。然而�,具有疏水性的有效載荷需要大量的有機溶劑進行偶聯(lián)。過度使用有機溶劑會使抗體變性����。此外,疏水載荷可以改變藥代動力學性質(zhì)并形成聚集��。因此����,應(yīng)該使用最佳數(shù)量的有機溶劑,并且可以選擇水溶性有效載荷來避免上述復雜性�。如果ADC本質(zhì)上是可切割的,那么它應(yīng)該是親水的����,以支持ADC獲得水溶性。為了通過細胞膜進入�,所選擇的有效載荷本質(zhì)上應(yīng)該是親脂性的,并且可以通過溶酶體膜到達靶點�。
偶聯(lián)方法
連接方式和連接位置也是設(shè)計理想ADC的關(guān)鍵因素����。它可以調(diào)節(jié)有效載荷釋放的位置和速率,最終與ADC的安全性和有效性相關(guān)��。這里�,我們將描述用于結(jié)合抗體和有效載荷的技術(shù)����。
工程半胱氨酸
工程半胱氨酸殘基允許細胞毒性載荷均勻分布在整個ADC。IgG類抗體含有8個半胱氨酸鍵�,可以通過特異性工程獲得2-4的藥物抗體比 (DAR)����。Seattle Genetics�、Genentech����、MedImmune、諾華和輝瑞等多家公司都將其作為開發(fā)方向����。根據(jù)工程半胱氨酸的數(shù)量����,ADC形成均勻的化學計量結(jié)果,DAR約為2或4����。與傳統(tǒng)ADC相比��,這些ADC在臨床前階段顯示出巨大的潛力和耐受性�。然而,由于馬來酰亞胺與白蛋白�、游離半胱氨酸或谷胱甘肽中的活性硫醇交換����,高溶劑可及性位點在血漿中迅速失去了偶聯(lián)巰基反應(yīng)性連接子�。為了克服這一挑戰(zhàn)�,在帶正電的環(huán)境中,一個部分可達的位點促進了連接子中琥珀酰亞胺環(huán)的水解����,從而阻止了馬來酰亞胺交換反應(yīng)。研究表明�,靶向CD33的SGN-CD33A對急性髓性白血病 (AML) 細胞系具有較高的抗腫瘤活性。SGN-CD33A含有一種工程抗CD33A�,其具有高效的吡咯苯二氮卓二聚體,通過蛋白酶可切割連接子連接�。此外�,根據(jù)研究,砜與硒代半胱氨酸的偶聯(lián)提高了ADC在人血清中的穩(wěn)定性��。此外����,在THIOMABs中,這種砜連接子標記了工程半胱氨酸殘基�,并增加了血漿中的穩(wěn)定性。因此�,偶聯(lián)位點的結(jié)構(gòu)和化學特性通過影響ADC的穩(wěn)定性來影響其性能。
聚糖修飾
一般來說��,抗體在Fc區(qū)有一個糖基化鏈����。N297殘基具有N-糖基化位點����,是修飾的中心?�;瘜W氧化����、代謝工程�、化學-酶或酶修飾等幾種方法已被開發(fā)用于修飾天然抗體的碳水化合物基團(N-聚糖)。
鑒于此�,腙化學可用于修飾未修飾的單克隆抗體的聚糖。為了氧化碳水化合物基團��,使用高碘酸鈉形成醛基��。但由于在氧化過程中使用了苛刻的條件,蛋氨酸殘基也會被氧化�,并存在于FcRn結(jié)合位點上。而且��,蛋氨酸的氧化過程會影響其結(jié)合親和力��,降低血清半衰期�。
代謝工程是提高均勻性的另一有效方法。在該方法中����,一種巖藻糖衍生物,即6-硫代巖藻糖取代單克隆抗體上存在的天然巖藻糖�,并通過馬來酰亞胺基團偶聯(lián)有效載荷。然而�,所有這些方法都有不必要的并發(fā)現(xiàn)象,應(yīng)該注意�。深入了解影響每種修飾的因素可能有助于未來開發(fā)強大的靶向治療。
酶定向修飾
酶定向修飾����,其中酶特別作用于氨基酸,選擇性地將有效載荷附加到特定位點�。轉(zhuǎn)肽酶 A (SrtA) 催化轉(zhuǎn)肽化反應(yīng),將SrtA識別肽插入輕鏈和重鏈的C端��,然后通過轉(zhuǎn)肽化反應(yīng)加入美登素或單甲基奧瑞他汀(MMAE)。Redwood開發(fā)了一種SMARTag��,利用甲?���;拾彼嵘擅?(FGE) 將Cys-X-Pro-X-Arg序列插入到抗體中��,導致半胱氨酸被甲?;拾彼崛〈H缓?�,修飾后的單克隆抗體通過肼- Pictet - Spengler連接特異性結(jié)合到含醛的載荷物上����。另一種通過細菌轉(zhuǎn)谷氨酰胺酶 (BTG) 進行位點特異性偶聯(lián)的方法在生物過程中起著至關(guān)重要的作用。轉(zhuǎn)谷氨酰胺酶通過共價鍵在賴氨酸的伯胺和谷氨酰胺的酰胺基團之間形成酰胺鍵��。然而�,根據(jù)研究����,與其它TG相比��,從莫巴氏鏈黃霉中收集的BTG含有一個非典型的催化位點,并且它不會在賴氨酸的伯胺和谷氨酰胺的酰胺基之間形成鍵����。Innate Pharma開發(fā)的一種ADC,通過BTG將MMAE與IgG1結(jié)合��。這種BTG介導的ADC形成高度穩(wěn)定的鍵�,DAR為2。
半胱氨酸再橋接
半胱氨酸再橋接是一種很有前途的技術(shù)�,可以在不需要對抗體進行任何特異性工程的情況下開發(fā)出均勻穩(wěn)定的ADC。這些ADC在體外和體內(nèi)模型中均表現(xiàn)出較高的療效����,具有較高的結(jié)合能力和血漿穩(wěn)定性。這項技術(shù)吸引了幾家公司��,如Igenica, Sorrento Therapeutics, ThioLogics, biotheraptics����。
氨基末端工程絲氨酸
氨基末端工程絲氨酸具有水解穩(wěn)定性和均質(zhì)性。在該技術(shù)中����,重鏈和輕鏈的氨基端含有工程絲氨酸殘基。絲氨酸殘基含有一個羥基,經(jīng)過輕度氧化形成醛基�。然后這些醛基參與肟連接。對這樣技術(shù)感興趣的公司包括ImmunoGen和MedImmune�。
連接到Fab核苷酸結(jié)合位點
IgG抗體的Fab區(qū)在核苷酸結(jié)合袋 (NBP) 處含有賴氨酸基團。根據(jù)加州大學的研究人員的研究�,可以通過基于偶聯(lián)的吲哚基 5-二氟-2,4-二硝基苯連接子-藥物基團特異性地對這些賴氨酸基團進行連接。
非天然氨基酸工程
這是一種通過摻入非天然氨基酸對蛋白質(zhì)進行位點特異性改變的合適方法����。根據(jù)研究,利用轉(zhuǎn)運核糖核酸(tRNA)/tRNA合成酶對將非天然氨基酸整合到終止密碼子處�。例如,據(jù)研究報道����,對乙酰-苯丙氨酸是一種非天然氨基酸,摻入抗HER2 IgG1中��,在不干擾其它氨基酸的情況下改變酮基����。另一項研究使用該方法將曲妥珠單抗與單甲基奧瑞他汀F (MMAF)偶聯(lián)。該方法對抗體的官能團是可耐受的;因此�,它是一種調(diào)節(jié)DAR的有用技術(shù)�。然而,引入非天然氨基酸會引起免疫反應(yīng)��。此外,由于基因工程的參與����,這需要先進的技術(shù)。
ADC的作用機制
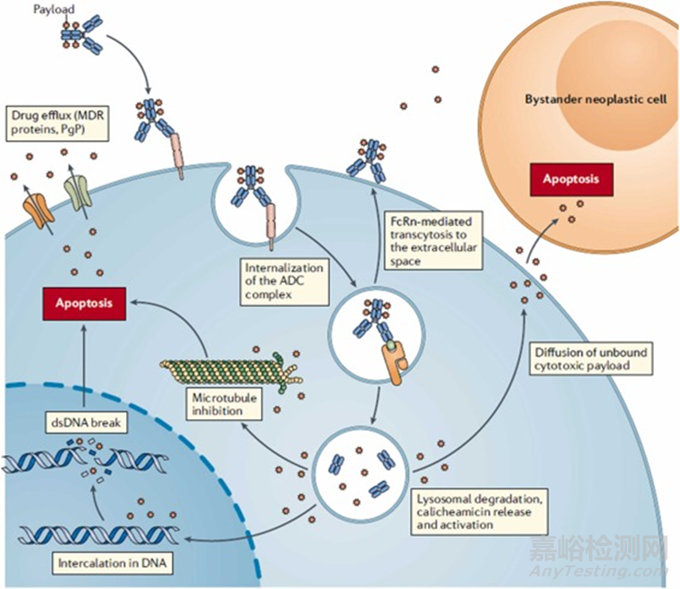
ADC是一種能夠精確靶向腫瘤細胞的抗腫瘤藥物��,具有治療指數(shù)高����、脫靶毒性小的特點�。下圖顯示了ADC作用機制的主要概述。如圖所示����,與正常細胞相比,ADC的單克隆抗體與腫瘤細胞上過表達的靶抗原結(jié)合時����,ADC被內(nèi)化到細胞中形成早期內(nèi)體�,隨后該早期內(nèi)體成熟為晚期內(nèi)體并與溶酶體融合。此外��,由于溶酶體蛋白酶的存在,細胞毒性有效載荷與單克隆抗體分離��,并通過靶向微管或DNA殺死腫瘤細胞����。透過膜的有效載荷可以擴散回細胞外基質(zhì),并殺死鄰近的細胞��,稱為旁觀者效應(yīng)��,這進一步增強了ADC的功效����。此外��,其它機制����,如ADCC、CDC和ADCP機制也參與了ADC的抗腫瘤作用����。在這些機制中����,ADC抗體的Fab片段與抗原表位結(jié)合,在腫瘤細胞表面表達����,而同一抗體的Fc片段與免疫細胞 (如自然殺傷細胞、巨噬細胞等)的FCR結(jié)合�,直接導致細胞死亡。單克隆抗體直接結(jié)合腫瘤細胞的特異性抗原��,抑制相應(yīng)的下游信號轉(zhuǎn)導����。例如����,T-DM1的曲妥珠單抗與HER2受體結(jié)合時,可阻斷HER2與HER1�、HER3或HER4之間異源二聚體的形成,抑制MAPK��、PI3K等信號通路��,導致細胞凋亡����。
圖4. ADC的作用方式。
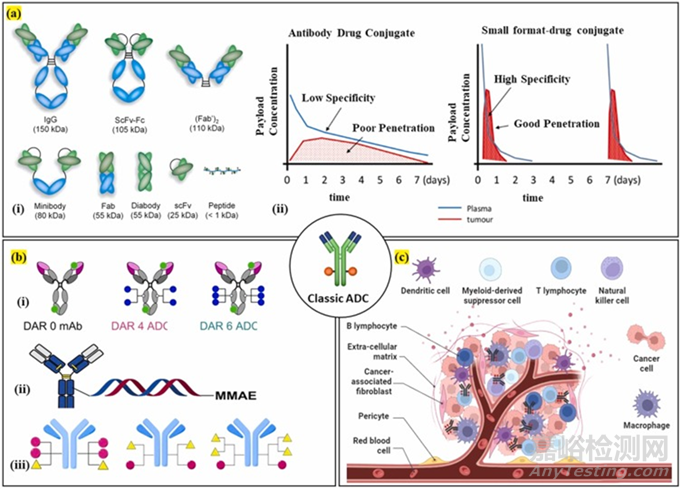
圖5. 下一代ADC:a) 顯示了不同的抗體片段�,以降低分子量并增加ADC的滲透率����;b) 顯示了通過使用支鏈連接子,以及具有雙載荷和DNA作為連接子的ADC����,來增加ADC的DAR和效力的方法;c) 顯示了TME靶向ADC�。在這種方法中����,ADC可以針對TME的不同成分,而不是細胞內(nèi)部環(huán)境�。
原文:A.Samantasinghar, N.P.Sunildutt, F.Ahmed, et al., A comprehensive review of key factors affecting the efficacy of antibody drug conjugate. Biomedicine & Pharmacotherapy, 2023.