摘 要 Abstract
人乳頭瘤病毒(human papillomavirus���,HPV)感染具有廣泛性和自限性,通常能被免疫細(xì)胞清除���。然而���,持續(xù)感染很有可能導(dǎo)致正常細(xì)胞病變�����,最終引發(fā)宮頸癌等惡性腫瘤�。接種HPV 疫苗是宮頸癌一級(jí)預(yù)防的有效措施。采用大腸桿菌表達(dá)系統(tǒng)研發(fā)的HPV 疫苗具有低成本�����、高產(chǎn)量的優(yōu)勢(shì)�����。本文綜述了HPV 基本概況和大腸桿菌表達(dá)系統(tǒng)的優(yōu)勢(shì)與挑戰(zhàn)�����,重點(diǎn)梳理了大腸桿菌表達(dá)的HPV 疫苗的研發(fā)進(jìn)展���,以期為大腸桿菌重組表達(dá)系統(tǒng)的改進(jìn)策略和新型HPV 疫苗的研發(fā)方向提供參考���。
Human papillomavirus (HPV) infection is a common and self-limited viral infection that is primarily cleared by the immune system. However, persistent HPV infections may lead to cellular abnormalities, elevating the risk of malignant tumors, including cervical cancer. HPV vaccination is an effective primary prevention strategy against cervical cancer. The use of Escherichia coli expression systems for HPV vaccine development offers significant advantages in terms of costeffectiveness and high production yield. This paper provides an overview of HPV, discusses the advantages and challenges of the Escherichia coli expression system, and reviews the progress in the research and development of HPV vaccines using this system. It offers insights into the improvement of the Escherichia coli recombinant expression system and the future development of novel HPV vaccines.
關(guān)鍵詞 Key words
原核表達(dá)系統(tǒng);大腸桿菌���;人乳頭瘤病毒�����;疫苗�;重組蛋白���;宮頸癌
prokaryotic expression system; Escherichia coli; human papillomavirus; vaccine; recombinant protein; cervical cancer
人乳頭瘤病毒(human papilloma virus�,HPV)是一種脫氧核糖核酸(DNA)病毒���,屬于乳頭瘤病毒科�����。HPV 通過皮膚或黏膜的微小創(chuàng)傷接觸具有分化能力的基底層細(xì)胞后���,依靠衣殼蛋白與受體的相互作用進(jìn)入細(xì)胞內(nèi)。隨后�,病毒基因組在衣殼蛋白L2 的協(xié)助下進(jìn)入細(xì)胞核。低危型HPV 感染通常導(dǎo)致皮膚疣���、口腔及喉部瘤和尖銳濕疣等疾??��;HPV16���、18 等其他高危型HPV的持續(xù)反復(fù)感染與宮頸癌的發(fā)生、發(fā)展密切相關(guān)���。因此�����,開發(fā)有效的HPV 疫苗對(duì)于防控上述疾病具有重要意義�。目前,全球共有6 種針對(duì)不同HPV 型別的預(yù)防性HPV 疫苗�。這些疫苗可誘導(dǎo)人體產(chǎn)生免疫力以抵御70% 的生殖器疣和90% 的皮膚疣及癌癥,比自然感染產(chǎn)生的免疫力更強(qiáng)�����,且對(duì)非疫苗型別也能產(chǎn)生一定的交叉保護(hù)作用���。
基于衣殼蛋白L1 形成的重組病毒樣顆粒(virus-likeparticle,VLP) 開發(fā)的HPV疫苗�,由病毒結(jié)構(gòu)蛋白組成。它模擬天然的病毒但缺乏病毒遺傳物質(zhì)�,是疫苗中高度安全且有效的活性成分。目前已獲批的基于VLP 開發(fā)的疫苗大多采用酵母�����、大腸桿菌�、植物、昆蟲和哺乳動(dòng)物細(xì)胞系統(tǒng)進(jìn)行生產(chǎn)���。其中���,原核表達(dá)系統(tǒng)特別是大腸桿菌���,相較于昆蟲和酵母等更具成本效益,成為全球疫苗開發(fā)的首選表達(dá)宿主�。2010 年,有研究者證明了在重組大腸桿菌中大規(guī)模生產(chǎn)小鼠多瘤病毒VP1 五聚體蛋白的可行性�,采用1L 大腸桿菌可得到克數(shù)級(jí)別的目的蛋白[1]。2019 年年底�����, 廈門大學(xué)攜手萬泰生物采用大腸桿菌表達(dá)系統(tǒng)研發(fā)的第一支國產(chǎn)HPV 二價(jià)疫苗在我國獲批上市�����,為大腸桿菌應(yīng)用于重組蛋白疫苗生產(chǎn)奠定了基礎(chǔ)�����。此后���,大腸桿菌表達(dá)的HPV 疫苗不斷創(chuàng)新發(fā)展�,越來越多免疫原性更強(qiáng)�、保護(hù)性更廣的新型疫苗出現(xiàn)在HPV 疫苗賽道上�。本文總結(jié)了HPV 分子生物學(xué)和流行病學(xué)發(fā)展情況�����,回顧了大腸桿菌表達(dá)的HPV 疫苗的里程碑試驗(yàn)���,并闡述了基于原核表達(dá)系統(tǒng)生產(chǎn)的HPV 疫苗的發(fā)展前景和面臨的挑戰(zhàn)�,旨在為HPV 疫苗開發(fā)提供新思路�。
1、 HPV 疫苗研發(fā)背景
1.1 基因組及編碼蛋白
HPV 是一種小雙鏈環(huán)狀DNA 病毒���,通過感染黏膜和皮膚組織引發(fā)各種良性和惡性病變�����。HPV 的基因組大小約為8kb[2],主要由3 個(gè)區(qū)域組成:① 上游調(diào)控區(qū)(upstream regulatory region�����,URR)�, 為非編碼區(qū),包含病毒的啟動(dòng)子�、增強(qiáng)子和復(fù)制起點(diǎn)等重要調(diào)控元件�,在病毒的復(fù)制和轉(zhuǎn)錄中發(fā)揮作用�。②早期編碼區(qū)(early region,ER)���,約占4kb�����,負(fù)責(zé)編碼調(diào)節(jié)病毒基因組復(fù)制和轉(zhuǎn)錄的蛋白質(zhì)���,包括E1、E2�、E4、E5�����、E6�、E7 蛋白,其中E6 和E7 蛋白的持續(xù)表達(dá)可導(dǎo)致癌變�。③晚期編碼區(qū)(lateregion,LR)�����, 約占3kb, 負(fù)責(zé)編碼裝配病毒粒子的主要衣殼蛋白L1 和次要衣殼蛋白L2�,二者構(gòu)成了T=7 正二十面體病毒衣殼結(jié)構(gòu)。其中�,L1 蛋白分子量約為55kDa,編碼衣殼上5 個(gè)高度可變的Loop 環(huán)區(qū)(分別為BC�����、DE�、EF、FG�、HI), 環(huán)區(qū)包含L1 蛋白的大部分中和抗體表位�。L1 蛋白可通過二硫鍵、離子鍵等相互作用自發(fā)組裝成VLP���,后者與天然病毒粒子結(jié)構(gòu)高度相似�����,是HPV 疫苗的主要成分。L2 蛋白的分子量約為55kDa�����,目前其結(jié)構(gòu)還未被完全解析。但有研究表明�����,L2 蛋白可與細(xì)胞表面受體相互作用���,影響病毒的吸附�、入胞和入核等過程�。L2 蛋白在HPV 中高度保守,具有廣譜中和表位���,是新型預(yù)防性和治療性疫苗的研發(fā)熱點(diǎn)�����。
1.2 流行病學(xué)研究
HPV 感染會(huì)導(dǎo)致多種癌癥�,包括宮頸癌�、肛門癌、口咽癌���、外陰癌���、陰莖癌�、口腔癌�����、喉癌等�。2020 年全球癌癥統(tǒng)計(jì)數(shù)據(jù)[3]顯示,宮頸癌是全球女性第四大常見癌癥�,也是全球女性癌癥死亡的第四大原因。統(tǒng)計(jì)數(shù)據(jù)還顯示�,2020 年,全球新增宮頸癌病例約60.4 萬例���,因?qū)m頸癌死亡病例數(shù)達(dá)34.2 萬���,死亡率約為56.62%。
HPV 可分為高危型和低危型�。高危型HPV 包括HPV16、18 �����、31 �、33 、35 ���、45 �����、52 ���、58 等型別。其中�����,HPV16 和HPV18 更為常見���,與70% 的宮頸癌直接相關(guān)���。各型別HPV 的總患病率約為31%(95%CI:27%~35%),其中高危型HPV的總患病率為21%(95%CI:18%~24%)���。HPV16 是最常見的HPV 基因型(5%���,95%CI:4%~7%)�����,其次是HPV6(4%,95%CI:3%~5%)[4]���。值得關(guān)注的是,大多數(shù)宮頸癌病例發(fā)生在中低收入國家�����。相關(guān)數(shù)據(jù)顯示���,宮頸癌在發(fā)展中國家和發(fā)達(dá)國家中的標(biāo)化發(fā)病率分別為18.8/10萬和11.3/10 萬���,標(biāo)化死亡率分別為12.4/10 萬和5.2/10 萬[3]�。
在全球細(xì)胞學(xué)檢查正常的婦女中�,HPV 的感染率約為10%���?;疾÷首罡叩牡貐^(qū)是撒哈拉以南非洲(24%)�����,其次是拉丁美洲和加勒比(16%)�����、東歐(14%)和東南亞(14%)[5]�。在全球范圍內(nèi)�,宮頸癌發(fā)病年齡多分布在35 歲以下。隨著年齡的增長�����,女性宮頸癌發(fā)病率呈下降趨勢(shì)���。然而�����,在45 歲及以上�����,女性感染HPV 的概率會(huì)達(dá)到第二高峰���,該趨勢(shì)在非洲�、南美洲�����、北美洲以及歐洲地區(qū)尤為明顯[6]。
在我國�����,宮頸癌病例數(shù)量逐年增多, 已成為女性健康的一大殺手�。數(shù)據(jù)顯示���,2020 年我國宮頸癌新發(fā)病例數(shù)約為11 萬,約占全球?qū)m頸癌新發(fā)病例數(shù)的18.2%�����,僅次于印度(20.5%)�����,位居全球第二���。2020 年薈萃分析[7] 發(fā)現(xiàn)�����,在我國�,HPV CIN1(宮頸上皮內(nèi)瘤變1 級(jí))中常見的HPV 型別依次為HPV52(20.31%)、HPV16(16.81%)���、HPV58(14.44%)���、HPV18(6.44%)、HPV53(5.76%)�。HPV CIN2/3(宮頸上皮內(nèi)瘤變2/3 級(jí)) 以HPV16(45.69%)為主�����,其次為HPV58(15.50%)�����、HPV52(11.74%)���、HPV33(9.35%)、HPV31(4.34%)�。此外,我國易感染宮頸癌的女性年齡階段從以往集中于40~60 歲逐漸轉(zhuǎn)移到15~44 歲�,呈現(xiàn)出宮頸癌發(fā)病年齡逐漸年輕化的趨勢(shì)�����。
1.3 HPV 疫苗的重要性
目前�����,HPV 感染途徑主要包括性接觸���、母嬰垂直傳播���、皮膚黏膜接觸等。盡管90% 以上的人群在感染HPV 后可在自身免疫力的作用下清除大部分病毒�,多數(shù)癌前病變也會(huì)自行消失���,但在HPV 持續(xù)感染的情況下�����,癌前病變發(fā)展為浸潤性癌癥的風(fēng)險(xiǎn)大幅提高。目前宮頸癌是唯一一種可以預(yù)防的癌癥���, 女性從感染HPV 發(fā)展到罹患宮頸癌需要15~20 年。在整個(gè)過程中���,針對(duì)宮頸癌的預(yù)防可分為三級(jí)。其中�����,第一級(jí)也是最重要的一級(jí)預(yù)防措施就是接種HPV 疫苗���。及時(shí)接種HPV 疫苗能夠針對(duì)不同型別HPV 提供免疫保護(hù),從而預(yù)防相關(guān)疾病的發(fā)生�,這是目前較為經(jīng)濟(jì)有效的防護(hù)措施���。
1.4 HPV 疫苗的發(fā)展
在20 世紀(jì)90 年代, 一系列動(dòng)物實(shí)驗(yàn)表明�����,牛乳頭瘤病毒可感染牛[8]���,而狗在接種福爾馬林滅活病毒疫苗后可抵御犬口腔乳頭瘤病毒的黏膜感染[9]�。鑒于HPV 無法在體外培養(yǎng)基中生長,HPV 預(yù)防疫苗研制初期的主要挑戰(zhàn)是尋找合適的HPV 抗原���。在20 世紀(jì)90 年代初�,有研究者成功表達(dá)出能夠形成VLP 的PV L1蛋白�;進(jìn)一步研究發(fā)現(xiàn)���,VLP 保護(hù)是特異性的,因此疫苗需要由多價(jià)VLP 構(gòu)成[10]�。1995 年的一項(xiàng)研究表明�,接種VLPs 可保護(hù)家兔免于棉尾兔乳頭瘤病毒感染[11]�����。隨后又有研究發(fā)現(xiàn)�,人體在接種HPV16 VLPs 后�����,血清免疫球蛋白G(IgG)會(huì)滲出進(jìn)入生殖道,為宿主提供保護(hù)作用[12]���?;谝陨涎芯拷Y(jié)果,有企業(yè)開發(fā)并測(cè)試了相關(guān)疫苗產(chǎn)品�����。2006 年�,默克公司研發(fā)出針對(duì)HPV6、11�����、16���、18 的四價(jià)疫苗Gardasil[13]�����,該疫苗可預(yù)防約90% 的生殖器疣和70% 的宮頸癌�。2007 年�����,葛蘭素史克公司的針對(duì)HPV16�、18 的二價(jià)疫苗Cervarix 上市[14],該疫苗可預(yù)防約70% 的宮頸癌���。2014 年年底�,默克公司又上市了針對(duì)HPV6、11���、16�、18�����、31�、33、45���、52 和58 的九價(jià)疫苗Gardasil 9[15]�����。臨床試驗(yàn)表明�,肌內(nèi)注射這類預(yù)防性疫苗能產(chǎn)生高度的免疫原性[16-17]�,也能誘導(dǎo)產(chǎn)生特異性記憶B 淋巴細(xì)胞[18]�����。上述3 種疫苗均已獲得美國食品藥品監(jiān)督管理局(FDA)和世界衛(wèi)生組織(WHO)的許可�,并已獲批用于我國適齡女性人群�。
然而,HPV 疫苗在我國的普及問題尚未完全得到解決���。在我國,由于進(jìn)口疫苗價(jià)格高昂且供應(yīng)有限���,以及對(duì)預(yù)防接種的認(rèn)知程度仍有待提高�,接種群體主要為18~45 歲女性���, 而大部分9~14 歲的女性仍未接種疫苗。加之缺乏HPV 疫苗接種計(jì)劃�,HPV 引起的宮頸癌發(fā)病率和死亡率仍較高,疫苗接種和篩查的覆蓋率較低���。2020 年國際癌癥研究機(jī)構(gòu)的報(bào)告顯示,2000~2016年�,我國宮頸癌年發(fā)病率和死亡率均顯著上升。其中���,新發(fā)病例達(dá)109 741 例,占全球新發(fā)病例總數(shù)的18.2% �����;死亡病例達(dá)59 060 例�,占全球死亡病例總數(shù)的17.3%[19]�����。
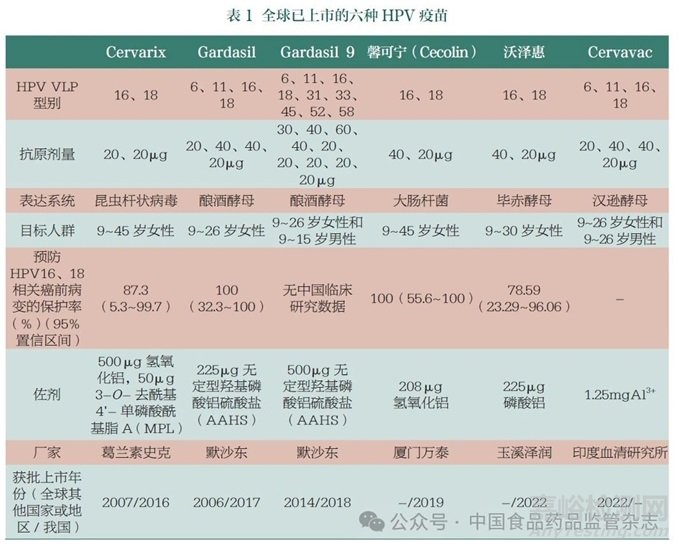
目前�����,我國女性群體能夠接種的商品化HPV 疫苗共有6 種,除了全球范圍內(nèi)使用的3 種HPV預(yù)防性疫苗外�����,我國國家藥品監(jiān)督管理局(NMPA)還批準(zhǔn)了2種我國自主研發(fā)的二價(jià)HPV 疫苗(表1)。值得關(guān)注的是���,2019年首個(gè)國產(chǎn)二價(jià)HPV 疫苗馨可寧(Cecolin) 的獲批上市�����, 促進(jìn)了我國及其他發(fā)展中國家HPV疫苗接種計(jì)劃的推行。Cecolin采用了大腸桿菌表達(dá)系統(tǒng)�����,生產(chǎn)成本低���、產(chǎn)量高�����,每劑售價(jià)約為Cervarix 價(jià)格的一半, 但保護(hù)率相似���。據(jù)報(bào)道�����,Cervarix 和Cecolin 兩種疫苗預(yù)防HPV16���、18 相關(guān)6 個(gè)月持續(xù)性感染的保護(hù)率分別為96.8%(95%CI:88.0%~99.6%) 和97.7%(95%CI :86.2%~99.9%)�。因此,Cecolin 的上市很好地解決了進(jìn)口HPV 疫苗價(jià)格高昂且供應(yīng)有限的問題。
2�����、 大腸桿菌表達(dá)的HPV疫苗研發(fā)主要進(jìn)展
2.1 大腸桿菌表達(dá)系統(tǒng)概述
外源基因表達(dá)系統(tǒng)可分為真核表達(dá)系統(tǒng)和原核表達(dá)系統(tǒng)�����。真核表達(dá)系統(tǒng)包括昆蟲桿狀病毒表達(dá)系統(tǒng)、植物表達(dá)系統(tǒng)�、酵母表達(dá)系統(tǒng)、哺乳動(dòng)物細(xì)胞表達(dá)系統(tǒng)�;原核表達(dá)系統(tǒng)主要為大腸桿菌表達(dá)系統(tǒng)。
大腸桿菌是一種革蘭陰性細(xì)菌���,屬于腸桿菌科,是廣泛應(yīng)用于生產(chǎn)重組蛋白的宿主�。目前�����,大腸桿菌已被開發(fā)出許多不同的菌株�,其中B 和K-12 系列菌株常用來生產(chǎn)重組蛋白[20]�。大腸桿菌K-12 系列菌株通常缺失表達(dá)rec A 重組酶、非特異性的核酸內(nèi)切酶以及β- 半乳糖苷酶的部分基因�����,常用于DNA 克隆構(gòu)建�。而大腸桿菌B 系列菌株或B 系列與K-12 系列的雜交菌株通常不表達(dá)宿主蛋白酶,可用于外源表達(dá)重組蛋白���。例如���,大腸桿菌BL21 菌株是一種大腸桿菌B 系列與K-12 系列的衍生菌株,具有生長速度更快�����、乙酸積累量更低、重組蛋白表達(dá)水平更高���、在純化過程中蛋白降解更少等特性[21]���。這些菌株缺乏可增加蛋白穩(wěn)定性的蛋白酶Lon 和OmpT, 菌株BL21(DE3) 含有T7 RNA 聚合酶基因的染色體拷貝���,可以在T7 啟動(dòng)子的控制下簡單有效地表達(dá)基因[22]�。而菌株Rosetta 和Rosetta(DE3) 攜帶pRARE質(zhì)粒�����,其中編碼氨基?����;鵷RNA合成酶的基因使得精氨酸(Arg)、異亮氨酸(Ile)�����、亮氨酸(Leu)�����、脯氨酸(Pro) 和甘氨酸(Gly)共表達(dá)[23],能有效促進(jìn)含有罕見密碼子的基因高頻表達(dá)���。
大腸桿菌作為一種常用的重組蛋白表達(dá)系統(tǒng)�, 被廣泛應(yīng)用于疫苗研發(fā), 如戊型肝炎疫苗益可寧(Hecolin)、B 型腦膜炎球菌疫苗Trumenba 和Bexsero���、治療性乙型肝炎疫苗HeberNasvac[24] 等�����。2018 年1月~2022 年6 月�,在美國和歐盟批準(zhǔn)的重組生物制藥產(chǎn)品中,有67% 采用哺乳動(dòng)物細(xì)胞�,23%來自大腸桿菌�,5% 來自酵母[25]�����。大腸桿菌具有較強(qiáng)的生物合成能力和分泌能力,能夠高效表達(dá)蛋白質(zhì)���。此外,大腸桿菌表達(dá)系統(tǒng)的成本較低�����,生產(chǎn)規(guī)?;^為容易,因此被認(rèn)為是一種理想的表達(dá)系統(tǒng)�。大腸桿菌的主要優(yōu)勢(shì)在于其特征明確的基因組、已知的轉(zhuǎn)錄和翻譯系統(tǒng)�����,以及易于遺傳操作���。這些特點(diǎn)允許構(gòu)建大量的菌株突變體,因此可以根據(jù)異源蛋白質(zhì)的性質(zhì)和結(jié)構(gòu)選擇合適的表達(dá)菌株�。此外�����,這些細(xì)菌能夠在廉價(jià)的培養(yǎng)基中快速生長到高密度[26]���,且所有大腸桿菌表達(dá)菌株都不含致病劑�。
2.2 大腸桿菌表達(dá)系統(tǒng)與HPV 疫苗研發(fā)
與真核表達(dá)系統(tǒng)相比�����,原核表達(dá)系統(tǒng)具有獨(dú)特的優(yōu)勢(shì)�����。大腸桿菌是一種生長速度快、培養(yǎng)周期短�、產(chǎn)量大、遺傳背景清晰的優(yōu)質(zhì)重組蛋白表達(dá)宿主�����。將大腸桿菌應(yīng)用于基因工程疫苗的研究中,有助于降低疫苗生產(chǎn)成本�、簡化制備過程,從而實(shí)現(xiàn)工業(yè)化生產(chǎn)�,提高疫苗的可獲得性。因此���, 大腸桿菌表達(dá)系統(tǒng)在VLP疫苗的研發(fā)與生產(chǎn)方面具有巨大潛力�。近年來���,我國不斷突破技術(shù)難關(guān)�����,成功上市多款基于大腸桿菌表達(dá)系統(tǒng)的基因工程疫苗���。2012 年,廈門萬泰聯(lián)合廈門大學(xué)成功研發(fā)全球首個(gè)戊型肝炎疫苗益可寧并獲批上市���,開創(chuàng)了基于原核表達(dá)系統(tǒng)的VLP 疫苗技術(shù)體系的先河���。隨后,廈門大學(xué)團(tuán)隊(duì)與廈門萬泰又于2019 年成功研制出基于大腸桿菌表達(dá)系統(tǒng)的HPV 疫苗馨可寧�����。這是第一支由發(fā)展中國家擁有完全自主知識(shí)產(chǎn)權(quán)而獲得WHO 預(yù)認(rèn)證(PQ)的宮頸癌疫苗�����,標(biāo)志著我國成為繼美國���、英國之后世界上第3 個(gè)具備宮頸癌疫苗自主供應(yīng)能力的國家���。在Ⅰ 期和Ⅱ 期臨床試驗(yàn)中,馨可寧顯示了良好的安全性和免疫原性���,其中HPV16 具有劑量依賴性�����。60μg 和90μg 中高劑量疫苗組的中和抗體幾何平均滴度(GMT) 分別為10 548和12 505���, 顯著高于30μg 低劑量組(GMT=7596), 整體來說疫苗耐受性良好�����,沒有出現(xiàn)疫苗相關(guān)嚴(yán)重不良反應(yīng)[27]。Ⅲ期臨床試驗(yàn)共入組7372 名18~45歲女性�����, 馨可寧在符合方案集(PPS)人群中對(duì)主要臨床終點(diǎn)HPV16�����、18 相關(guān)的CIN2/3�����、宮頸原位腺癌(AIS)或?qū)m頸癌的保護(hù)效力為100.0%(95%CI :55.7%~100.0%)�, 高于或等于兩個(gè)同類進(jìn)口疫苗,且兩種抗原可誘導(dǎo)強(qiáng)抗體反應(yīng)并能夠持續(xù)至少66 個(gè)月[28]�。研究證明,9~14歲女性僅需接種兩針該疫苗�。使用大腸桿菌表達(dá)系統(tǒng)研發(fā)HPV疫苗是一條全新的技術(shù)途徑,提供了經(jīng)濟(jì)實(shí)惠且高質(zhì)量的疫苗選擇�����,有助于HPV 疫苗在全球范圍內(nèi)進(jìn)一步普及�����。根據(jù)肯尼亞[29]、莫桑比克[30] 和菲律賓[31] 的模型試驗(yàn)結(jié)果���,在當(dāng)前的商品化HPV疫苗中�,馨可寧是凈成本最低且最具經(jīng)濟(jì)效益的HPV 預(yù)防性疫苗�。馨可寧已于2019 年12 月獲得我國NMPA 批準(zhǔn)�����,并于2020年5 月在我國境內(nèi)(不包括港澳臺(tái)地區(qū))正式推行[32]���。2021 年10 月�����, 該疫苗獲得WHO 預(yù)認(rèn)證[31,33]���。截至2023 年3 月,該疫苗還獲得了孟加拉國�����、摩洛哥�、尼泊爾���、泰國、剛果民主共和國和柬埔寨的上市許可[28,33]���。
在現(xiàn)有的6 種HPV 疫苗中���,只有四價(jià)和九價(jià)疫苗可以高效保護(hù)人體免于HPV6 和HPV11 感染?��;谲翱蓪幍某晒ρ邪l(fā)���,廈門大學(xué)于2017 年進(jìn)一步嘗試使用大腸桿菌表達(dá)一種針對(duì)HPV6和HPV11 的雙價(jià)疫苗。該疫苗抗原由HPV6 和HPV11 的L1截短蛋白組裝而成的VLPs 構(gòu)成�����,氫氧化鋁作為佐劑���。體內(nèi)評(píng)價(jià)結(jié)果表明�����,該疫苗在猴子體內(nèi)表現(xiàn)出與四價(jià)疫苗Gardasil 相當(dāng)?shù)闹泻托r(jià)并且能夠產(chǎn)生相似的抗體譜�����。目前�����,該疫苗已在我國完成Ⅰ期和Ⅱ期臨床試驗(yàn)[34]�。
此外,廈門大學(xué)研制的第二代HPV 疫苗馨可寧9(Cecolin9)正處于Ⅲ期臨床試驗(yàn)階段�����,可預(yù)防HPV6�����、8�����、11�����、16�����、31���、33���、45、52�、58 感染。研究表明�,該疫苗在小鼠和非人類靈長類動(dòng)物體內(nèi)均顯示出與Gardasil 9 相似的免疫原性;進(jìn)一步研究發(fā)現(xiàn)�,在接種該疫苗后,針對(duì)9 個(gè)HPV型別均能產(chǎn)生耐久性良好且高效的中和抗體[35]�。Ⅰ期和Ⅱ期臨床試驗(yàn)數(shù)據(jù)顯示,HPV 九價(jià)疫苗在18~45 歲女性中具有良好的耐受性和免疫原性[36-37]���。這意味著若馨可寧 9 上市�����,有望填補(bǔ)當(dāng)前九價(jià)HPV 疫苗的市場(chǎng)空白�。
據(jù)報(bào)道, 我國CIN1 患者中常見的HPV 型別依次為HPV52(20.31%)�、HPV16(16.81%)、HPV58(14.44%)�、HPV18(6.44%)、HPV53(5.76%)�。其中,HPV53 感染率為3.87%~4.74%�����, 其在我國CIN 患者中的感染率排名第6���,在CIN1 患者中的感染率排名第5[7]�。從全球范圍來看�,不同型別的HPV 在不同國家和地區(qū)呈現(xiàn)出不同的流行情況,如高危型HPV35 在非洲和歐洲的流行率分別為3.4% 和1.4%�����。然而�����,目前市場(chǎng)上保護(hù)范圍較廣的HPV 預(yù)防性疫苗Gardasil 9 對(duì)HPV53 和HPV35 等高危型別無法達(dá)到理想的保護(hù)效果���。因此�����,根據(jù)HPV基因型的流行和分布特點(diǎn)�����,開發(fā)預(yù)防HPV 感染的新疫苗具有重要意義�。廈門大學(xué)于2017 年發(fā)表的研究確定了HPV 型別特異性的關(guān)鍵表位�,其中HPV58 關(guān)鍵表位為D154、S168 和N170�,HPV59 的關(guān)鍵表位為M267、Q270���、E273�����、Y276�����、K278 和R283[38]���。該研究將HPV 衣殼上參與病毒感染的區(qū)域縮小至幾個(gè)關(guān)鍵氨基酸�,提供了不同型別免疫機(jī)制分子層面的見解�����,為研制出更具有交叉保護(hù)效果的HPV VLP 打下了基礎(chǔ)���。
先前的研究表明�����,HPV16和HPV31 的L1 蛋白的FG 環(huán)上替換部分殘基可以產(chǎn)生一種新的血清型[39]�����。為解決現(xiàn)有疫苗交叉保護(hù)率低的問題�,2018 年, 廈門大學(xué)團(tuán)隊(duì)使用環(huán)區(qū)表位移植設(shè)計(jì)了包含HPV33�����、58、52 這3 種型別的嵌合VLPs[40]�����,旨在不增加免疫顆粒數(shù)量和劑量的情況下提高HPV 疫苗對(duì)宮頸癌的保護(hù)率�����。研究者根據(jù)L1 蛋白的進(jìn)化距離將20 種HPV 型別分為7 組�,選取了親緣關(guān)系最近的兩個(gè)型別HPV58 和HPV33,分別以這兩種型別的L1 蛋白作為骨架���,移植另一種型別的五個(gè)環(huán)區(qū)之一構(gòu)建了10 個(gè)雙型別的嵌合VLPs�。在性質(zhì)鑒定后�,選擇H33-58HI 和H58-33BC兩個(gè)能夠產(chǎn)生與野生型HPV58和HPV33 相當(dāng)中和效果的顆粒���, 進(jìn)一步嘗試加入第3 個(gè)與HPV58���、33 均為親緣關(guān)系的型別HPV52�。在評(píng)價(jià)抗HPV52 的中和效果后���, 選定H33-58HI-52DE �����、H33-58HI-52FG 、H58-33BC-52DE 和H58-33BC-52HI 這4個(gè)分子�����, 而其中只有H58-33BC-52HI 能夠在小鼠和非人靈長類動(dòng)物中引發(fā)與3 種野生型VLPs 混合后相當(dāng)?shù)闹泻涂贵w效應(yīng)���。該團(tuán)隊(duì)將此策略進(jìn)一步推廣���,成功開發(fā)了其他5 種嵌合分子(HPV16/35/31�、HPV56/66/53�����、HPV39/68/70[41]、HPV69/51/26[42]�����、HPV18/45/59),為研制包含全部致癌性HPV 型別的新一代預(yù)防性疫苗提供了可能性���。
若能繼續(xù)擴(kuò)大單個(gè)HPV VLP的保護(hù)范圍�,便能夠進(jìn)一步降低疫苗劑量,提高保護(hù)效力���,降低生產(chǎn)成本�����。2020 年�����,廈門大學(xué)團(tuán)隊(duì)圍繞HPV 雜合體[43] 展開了研究�,研究表明,在HPV VLP上相鄰五聚體之間的Cys175 和Cys428 兩個(gè)殘基�,能夠通過氧化還原反應(yīng)控制衣殼的組裝、解聚過程���。任何一個(gè)殘基的突變都會(huì)抑制衣殼的組裝�����。研究發(fā)現(xiàn),當(dāng)C175A 和C428A 兩種突變五聚體可以雜合組裝成VLPs 且摩爾比率相等時(shí)�����,組裝效率最高�����。性質(zhì)鑒定表明�����,雜合VLPs 性質(zhì)與野生型VLPs 相似,且保持了與野生型同樣高水平的免疫原性�,并對(duì)其他未包含型別的HPV 具有輕微的交叉中和作用。這兩種研發(fā)策略為廣譜性HPV 疫苗的設(shè)計(jì)提供了全新的思路�,旨在達(dá)到“以一防多”的目的�����。
我國女性HPV 感染型別分布情況表明,HPV58 是我國常見的HPV 型別之一�。對(duì)此�����,康樂衛(wèi)士于2020 年開發(fā)了一種重組三價(jià)HPV 疫苗���,其中包含大腸桿菌表達(dá)的HPV16、18 和58型L1-VLP 抗原。疫苗型在恒河猴體內(nèi)的GMT 均可達(dá)到105 以上�����;對(duì)非疫苗型HPV6、11�、31�、33�、45 和52 也能產(chǎn)生一定的交叉保護(hù)效果[44]�。目前�����,康樂衛(wèi)士已完成三價(jià)和九價(jià)HPV 疫苗Ⅲ期臨床試驗(yàn)入組���,并已啟動(dòng)九價(jià)HPV 疫苗男性適應(yīng)癥Ⅰ期臨床試驗(yàn)�����。目前���,廈門大學(xué)團(tuán)隊(duì)采用嵌合分子的策略正在研制全球首個(gè)第三代宮頸癌疫苗(二十價(jià))���,現(xiàn)已取得關(guān)鍵技術(shù)突破���。
3�、 大腸桿菌表達(dá)的HPV疫苗面臨的挑戰(zhàn)和發(fā)展前景
大腸桿菌表達(dá)系統(tǒng)成本低廉���、增長迅速�����、易于生產(chǎn),已被大量用于病毒蛋白、抗體片段�����、酶���、脂類等多種生物產(chǎn)品的工業(yè)化生產(chǎn)�。然而,與其他生物技術(shù)應(yīng)用情況相同�����,大腸桿菌表達(dá)的HPV疫苗研發(fā)也面臨著諸多挑戰(zhàn)�����。
3.1 安全性問題
脂多糖(LPS) 也稱內(nèi)毒素,是幾乎所有革蘭陰性菌外膜外小葉的主要成分。其分子被脂質(zhì)A 段錨定在外膜上�����,是哺乳動(dòng)物中Toll 樣受體4 和髓系分化因子2 介導(dǎo)的促炎活性的有效激動(dòng)劑�,高濃度可引起哺乳動(dòng)物宿主的發(fā)熱反應(yīng)和感染性休克���。大腸桿菌表達(dá)重組蛋白通常會(huì)引起內(nèi)毒素污染,從產(chǎn)品的安全性考慮必須去除內(nèi)毒素���,但該過程非常困難且成本高昂�。有研究者通過鑒定和編輯與LPS 合成途徑相關(guān)的非生長必需基因(lpxL、lpxM�、lpxP�����、eptA、pagP���、kdsD�、msbA 和gutQ)制備和表征了無內(nèi)毒素大腸桿菌菌株�,在沉默這些基因后,LPS 轉(zhuǎn)化為脂質(zhì)IVA并錨定在重組菌株的膜外�,IVA并不會(huì)引發(fā)人類典型的細(xì)菌LPS化學(xué)型內(nèi)毒素反應(yīng)[45]�����。在純化過程中,細(xì)菌表達(dá)的治療性蛋白內(nèi)毒素水平降低�����,因此安全性進(jìn)一步提高。
在目前實(shí)驗(yàn)室規(guī)模上���,質(zhì)粒的穩(wěn)定表達(dá)通常依賴于內(nèi)含的抗性基因。然而,在大規(guī)模發(fā)酵中���,質(zhì)粒的快速復(fù)制會(huì)給細(xì)胞帶來代謝負(fù)擔(dān)�,同時(shí)也會(huì)使質(zhì)粒結(jié)構(gòu)不穩(wěn)定,導(dǎo)致發(fā)酵得到的蛋白質(zhì)量參差不齊[46]���。此外�����,抗生素的存在會(huì)對(duì)公眾健康和環(huán)境產(chǎn)生很大的影響�。對(duì)此,廈門大學(xué)團(tuán)隊(duì)成功構(gòu)建了7 株LPS 缺陷的大腸桿菌整合染色體菌株,在生產(chǎn)過程中不需要使用抗生素�����,且與野生型菌株相比,其蛋白產(chǎn)物中殘留的內(nèi)毒素水平顯著降低[47]���。
3.2 生產(chǎn)效率問題
與真核表達(dá)系統(tǒng)相比,大腸桿菌缺乏翻譯后修飾系統(tǒng)�����,可能會(huì)影響蛋白質(zhì)折疊���、空間構(gòu)象及生物活性。折疊錯(cuò)誤會(huì)導(dǎo)致大量重組蛋白表達(dá)在包涵體內(nèi)�����。有研究者發(fā)現(xiàn)���,溫和增溶法可溶解包涵體聚集體,同時(shí)保留蛋白質(zhì)的天然結(jié)構(gòu)�,因此將蛋白質(zhì)重新折疊純化可得到高回收率的具有生物活性的蛋白質(zhì)[48]���。在N 端融合MBP���、GST 等高分子量的標(biāo)簽可促進(jìn)靶蛋白的溶解度�。目前�,在大腸桿菌中可以通過共表達(dá)相應(yīng)的酶來實(shí)現(xiàn)某些翻譯后修飾�。然而�����,這種共表達(dá)會(huì)影響大腸桿菌的生長速度���,且多種載體難以在單一菌株中共表達(dá)。一種解決方案是將編碼翻譯后修飾因子的基因整合到基因組中�,以創(chuàng)造“真核樣”大腸桿菌���。有研究者通過敲除大腸桿菌中編碼O 端抗原連接酶的waaL 基因后,引入空腸彎曲菌N 端糖基化系統(tǒng)的關(guān)鍵酶PglB,將O 端多糖從脂質(zhì)載體(焦磷酸烯丙烯酯)轉(zhuǎn)移至受體蛋白���,以達(dá)到在大腸桿菌中建立糖基化修飾系統(tǒng)的目的[49]。
目前,大腸桿菌表達(dá)系統(tǒng)已被廣泛研究�,但使用該系統(tǒng)進(jìn)行蛋白質(zhì)表達(dá)和純化仍費(fèi)時(shí)費(fèi)力。因此�����,蛋白質(zhì)的表達(dá)和純化可逐步嘗試采用并行和高通量的方法。對(duì)此�,研究者們提出了一些有效的高通量蛋白質(zhì)生產(chǎn)方法�,包括通過商用機(jī)器人工作站���, 如來自Labcyte(Sunnyvale�����,CA,USA)的Equator GX8 分配器,來自Genomic Solutions(AnnArbor�����,MI�����,USA)的MicroSys分配器[50] 等其他系統(tǒng)實(shí)現(xiàn)快速基因克隆至蛋白純化�����;使用含有優(yōu)化后的甘油�����、乳糖和葡萄糖培養(yǎng)基實(shí)現(xiàn)蛋白自誘導(dǎo)[51] 等。
綜上所述�����,大腸桿菌表達(dá)系統(tǒng)在HPV 疫苗的生產(chǎn)上具備良好的發(fā)展前景���,且將逐漸成為開發(fā)其他重組疫苗的主要技術(shù)平臺(tái)之一�。HPV 感染與相關(guān)癌癥為全球帶來了沉重的醫(yī)療負(fù)擔(dān)�����,也成為人類生命健康的一大威脅�。一方面,我們將繼續(xù)致力于研發(fā)免疫原性更強(qiáng)、成本更低的廣譜預(yù)防性疫苗�����。另一方面,蛋白和多肽疫苗、重組載體疫苗�、核酸疫苗以及樹突狀細(xì)胞疫苗均在一定程度上具有免疫原性弱、個(gè)體差異性大等不足�,相關(guān)問題亟待解決���。個(gè)體化基因靶向治療仍是未來疫苗接種計(jì)劃和相關(guān)疾病治療的主要方向���,mRNA 和佐劑等方面新興技術(shù)的出現(xiàn)也將推動(dòng)疫苗開發(fā)和聯(lián)合治療方法持續(xù)發(fā)展。
引用本文
張姝玥���,王致萍,顧蓉�,李少偉,夏寧邵*.基于大腸桿菌表達(dá)系統(tǒng)的人乳頭瘤病毒疫苗研發(fā)進(jìn)展[J].中國食品藥品監(jiān)管.2023.12(239):42-49.