今日頭條
信達(dá)哮喘新藥啟動Ⅰ期臨床��。信達(dá)生物在Clinicaltrials.gov網(wǎng)站上注冊一項(xiàng)IBI3002用于健康受試者和中至重度哮喘成人患者的Ⅰ期臨床試驗(yàn)��。這是一項(xiàng)隨機(jī)�、雙盲、安慰劑對照的單劑量遞增研究�,擬評估IB13002的安全性耐受性、藥代動力學(xué)和藥效學(xué)�,以及治療中重度哮喘的初步療效。預(yù)計(jì)2025年2月完成��。據(jù)悉�,信達(dá)生物尚未對外公開IBI3002的靶點(diǎn)。
國內(nèi)藥訊
1.百濟(jì)神州PD-1單抗新適應(yīng)癥報(bào)產(chǎn)����。百濟(jì)神州PD-1抑制劑替雷利珠單抗新適應(yīng)癥上市申請(sBLA)獲CDE受理,用于可切除非小細(xì)胞肺癌(NSCLC)患者的圍術(shù)期(覆蓋新輔助+輔助)治療��。在Ⅲ期RATIONALE 315研究中����,與安慰劑聯(lián)合化療相比,替雷利珠單抗聯(lián)合化療用于新輔助治療顯著提高了MPR(主要病理學(xué)緩解)率(56.2%vs15.0%)和pCR(病理學(xué)完全緩解)率(40.7%vs5.7%)����。
2.恒瑞TROP2-ADC啟動II/III期研究����。恒瑞醫(yī)藥靶向TROP2的ADC新藥SHR-A1921在clinicaltrials.gov網(wǎng)站上注冊一項(xiàng)III期臨床試驗(yàn)��,擬評估SHR-A1921對比鉑類雙重化療治療復(fù)發(fā)性上皮性卵巢癌患者的有效性與安全性��。在I期研究中����,SHR-A1921治療實(shí)體瘤達(dá)到33.3%的客觀緩解率,疾病控制率為80%��。去年12月��,科倫藥業(yè)開發(fā)的國內(nèi)首款Trop-2 ADC新藥SKB264上市申請已獲得CDE受理��,用于三線治療局部晚期或轉(zhuǎn)移性三陰性乳腺癌��。
3.博銳CD3/HER2/HER2三抗獲批臨床�。博銳生物與成都恩沐聯(lián)合開發(fā)的三特異性抗體BR115注射液(CMG6A19)獲國家藥監(jiān)局臨床許可��,擬開發(fā)用于治療HER2陽性實(shí)體瘤����。BR115可特異性結(jié)合腫瘤細(xì)胞表面的HER2 ECD2和HER2 ECD4����,并同時(shí)與T細(xì)胞表面的CD3分子結(jié)合�,從而將T細(xì)胞募集到靶細(xì)胞附近,重新定向T細(xì)胞的殺傷作用����,誘導(dǎo)T細(xì)胞活化,裂解靶細(xì)胞��。博銳擁有CMG6A19在大中華區(qū)的開發(fā)�、生產(chǎn)以及商業(yè)化權(quán)益。
4.神州細(xì)胞CD38單抗獲批I期臨床�。神州細(xì)胞自主研發(fā)的1類生物藥SCTC21C注射液獲國家藥監(jiān)局批準(zhǔn)開展I期臨床研究,擬評估用于治療CD38+血液瘤的安全性與初步療效����。SCTC21C是一款經(jīng)Fc段改造、靶向CD38的單抗藥物�,可增強(qiáng)對CD38+腫瘤細(xì)胞的殺傷作用。臨床前研究顯示�,SCTC21C具有良好的臨床前藥代動力學(xué)和安全性結(jié)果。
5.元宋生物溶瘤病毒國內(nèi)報(bào)IND��。元宋生物1類生物制品重組L-IFN腺病毒注射液(YSCH-01)臨床試驗(yàn)申請獲CDE受理。YSCH-01利用具有靶向腫瘤雙重調(diào)控的溶瘤腺病毒載體攜帶了抗癌多功能的重組免疫抗癌基因L-IFN����,已在臨床前多個(gè)實(shí)體腫瘤類別研究中顯示出90-100%的抑瘤效果。去年年底�,該新藥已獲FDA批準(zhǔn)開展新藥研究。
國際藥訊
1.AZ補(bǔ)體因子D抑制劑獲批上市�。阿斯利康“first-in-class”口服補(bǔ)體因子D抑制劑Voydeya(danicopan)獲日本厚生勞動省批準(zhǔn)上市,聯(lián)合標(biāo)準(zhǔn)治療藥物C5抑制劑Ultomiris或Soliris治療陣發(fā)性睡眠性血紅蛋白尿癥(PNH)��。Voydeya阻止C3b片段在患者血紅細(xì)胞上的沉積�,控制PNH患者紅細(xì)胞分解與血管外溶血,進(jìn)而改善患者的治療效果�。在III期ALPHA臨床中,與安慰劑相比�,danicopan聯(lián)合治療顯著改善患者血紅蛋白水平較基線的變化(2.94[0.211]g/dLvs 0.50[0.313]g/dL)。
2.Novocure公司腫瘤電場療法報(bào)新適應(yīng)癥�。Novocure公司腫瘤電場治療(TTFields)的新適應(yīng)癥上市申請獲FDA受理,聯(lián)合標(biāo)準(zhǔn)治療(SOC)用于二線治療非小細(xì)胞肺癌(NSCLC)患者��。TTFields旨在通過多種機(jī)制施加物理外力以抑制腫瘤細(xì)胞有絲分裂進(jìn)而抑制其生長����。在III期LUNAR研究中�,與標(biāo)準(zhǔn)治療相比��,TTFields聯(lián)合標(biāo)準(zhǔn)治療顯著提高患者的總生存期(中位OS:13.2個(gè)月vs9.9個(gè)月����,HR:0.74��,P=0.035)����。再鼎醫(yī)藥擁有TTFields的中國權(quán)益。
3.MAIA公司端粒靶向抗癌藥肺癌Ⅱ期臨床積極��。MAIA公司端粒靶向藥物THIO治療非小細(xì)胞肺癌(NSCLC)經(jīng)治患者的Ⅱ期研究THIO-101結(jié)果積極����。THIO可誘導(dǎo)產(chǎn)生端粒酶依賴性端粒DNA修飾、DNA損傷反應(yīng)和選擇性癌細(xì)胞死亡��。臨床數(shù)據(jù)顯示��,作為二線和三線治療時(shí)�,THIO聯(lián)合PD-1單抗cemiplimab的初步疾病控制率分別達(dá)到100%和88%。此前�,該藥物曾獲得FDA授予孤兒藥資格(ODD)。
4.Coherus公司IL-27單抗肝癌II期臨床積極����。Coherus公司IL-27單抗casdozokitug(casdozo)聯(lián)合PD-L1抑制劑阿替利珠單抗和貝伐珠單抗(bev)治療局部晚期或轉(zhuǎn)移性肝細(xì)胞癌(uHCC)的II期臨床結(jié)果積極��。根據(jù)RECIST v1.1評估�,casdozokitug聯(lián)合治療達(dá)到客觀緩解率為38%����,中位無進(jìn)展生存期為8.1個(gè)月,疾病控制率為58.6%����。Coherus計(jì)劃在臨床試驗(yàn)中評估casdozo聯(lián)合PD-1抗體toripalimab和bev組合的治療效果。
5.現(xiàn)貨型CAR-NK療法早期臨床見刊《自然》子刊��。MD安德森癌癥中心研究人員開發(fā)的源于臍帶血����、工程化表達(dá)CD19靶向CAR與白細(xì)胞介素-15(CAR19/IL-15)的CAR-NK細(xì)胞療法,在治療CD19陽性B細(xì)胞惡性腫瘤患者的Ⅰ/Ⅱ期臨床獲積極結(jié)果����。數(shù)據(jù)顯示,患者在第30天和第100天的總緩解率均為48.6%�;1年總生存率和無進(jìn)展生存率分別為68%和32%;試驗(yàn)中沒有觀察到明顯的毒性����。詳細(xì)結(jié)果公布于《自然》子刊(MDNature Medicine)上。
6.CD19靶向CAR-T治療MS獲快速通道資格����。Kyverna公司靶向CD19的自體CAR-T療法KYV-101獲FDA授予快速通道資格,用于多發(fā)性硬化(MS)的治療�。KYV-101旨在深度誘導(dǎo)血液循環(huán)和組織實(shí)現(xiàn)B細(xì)胞完全耗竭,對B細(xì)胞驅(qū)動的自身免疫性疾?。ㄈ缋钳徯阅I炎、系統(tǒng)性硬化癥和炎性肌?���。┚哂兄委煗摿Α4饲?���,F(xiàn)DA已授予KYV-101快速通道資格��,用于治療難治性狼瘡腎炎(LN)和重癥肌無力(MG)��。
醫(yī)藥熱點(diǎn)
1.章軻履新國家醫(yī)保局黨組書記����。據(jù)國家醫(yī)保局網(wǎng)站消息��,1月20日上午�,中央組織部有關(guān)負(fù)責(zé)同志出席國家醫(yī)療保障局領(lǐng)導(dǎo)干部會議��,宣布中央決定:章軻同志任國家醫(yī)療保障局黨組書記��。公開信息顯示����,章軻,男��,漢族����,1968年5月出生�,中共黨員,研究生學(xué)歷��,管理學(xué)博士學(xué)位����。此前,章軻任審計(jì)署黨組成員����、副審計(jì)長�。
2.中山六院關(guān)節(jié)外科/運(yùn)動醫(yī)學(xué)科開科。1月18日上午��,中山大學(xué)附屬第六醫(yī)院關(guān)節(jié)外科/運(yùn)動醫(yī)學(xué)科正式開科��。宋斌副主任表示,關(guān)節(jié)外科/運(yùn)動醫(yī)學(xué)科將秉承“守真?zhèn)鞒?���、求真?chuàng)新”精神和“三創(chuàng)三服”文化核心理念����,力爭經(jīng)過5-10年的建設(shè)��,將科室打造成為國內(nèi)一流��、華南地區(qū)規(guī)模最大����、涵蓋預(yù)防����、治療�、康復(fù)�、教學(xué)、科研��、轉(zhuǎn)化為一體的全流程骨關(guān)節(jié)運(yùn)動醫(yī)學(xué)品牌。
3.瑞士CDMO公司裁員218人�。瑞士CDMO公司龍沙(Lonza)宣布永久關(guān)閉加州Hayward工廠(生物治療藥物�、生物試劑和生物材料的生產(chǎn)基地)�,并裁員218人����,裁員將于2月2日生效。這是由于CDMO市場需求主要集中在臨床和商業(yè)產(chǎn)品的結(jié)合和整合上��,而Hayward基地提供的增長機(jī)會有限�。去年10月,Lonza與其生物制藥合作伙伴擴(kuò)大合作����,在位于瑞士Stein的工廠建立一條專用的商業(yè)灌裝線。作為該項(xiàng)目的一部分��,龍沙增加約115個(gè)工作崗位��。
評審動態(tài)
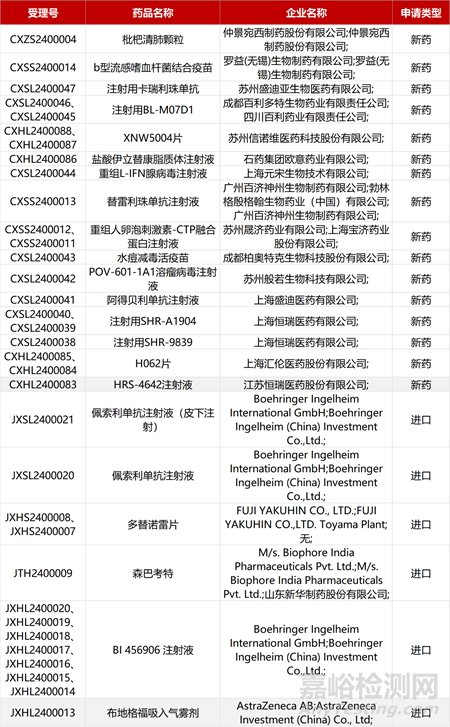
1. CDE新藥受理情況(01月20日)
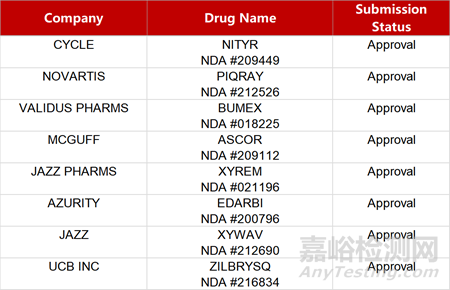
2. FDA新藥獲批情況(北美01月18日)