引 言
生物醫(yī)學(xué)工程是一門(mén)交叉學(xué)科�����,主要研究生命科學(xué)��、機(jī)械工程���、電子工程和人工智能等方面的基本知識(shí)和技能�����,包括生物材料���、人工器官��、生物醫(yī)學(xué)信號(hào)處理方法�����、醫(yī)學(xué)成像和圖像處理方法���、機(jī)械工程設(shè)計(jì)等��。生物醫(yī)學(xué)工程是醫(yī)療器械產(chǎn)品設(shè)計(jì)��、制造以及醫(yī)療器械產(chǎn)業(yè)發(fā)展的基礎(chǔ)學(xué)科��。
通過(guò)醫(yī)工結(jié)合針對(duì)性地設(shè)計(jì)能解決臨床問(wèn)題的醫(yī)療器械產(chǎn)品��,是醫(yī)療器械產(chǎn)品研發(fā)的初始階段同時(shí)也是關(guān)鍵階段�����。醫(yī)療器械產(chǎn)品的設(shè)計(jì)���、制造���、臨床試驗(yàn)、醫(yī)療器械產(chǎn)品注冊(cè)證申報(bào)及其產(chǎn)業(yè)化是一個(gè)復(fù)雜的流程。筆者根據(jù)20多年醫(yī)療器械研發(fā)實(shí)踐對(duì)醫(yī)療器械產(chǎn)品轉(zhuǎn)化過(guò)程中的要素進(jìn)行分析,并探討如何構(gòu)建促進(jìn)醫(yī)療器械產(chǎn)業(yè)發(fā)展的微環(huán)境���。通過(guò)打造產(chǎn)業(yè)集群�����、形成從原料供應(yīng)到臨床服務(wù)的完善產(chǎn)業(yè)鏈���,配套以政策及產(chǎn)業(yè)基金扶持�����、人才培養(yǎng)�����、監(jiān)管政策研究��、知識(shí)產(chǎn)權(quán)服務(wù)���、產(chǎn)品檢測(cè)及產(chǎn)品注冊(cè)服務(wù)等重要要素��,加強(qiáng)醫(yī)工有效結(jié)合�����、成果轉(zhuǎn)化及醫(yī)療器械產(chǎn)業(yè)的發(fā)展�����。
醫(yī)工結(jié)合是醫(yī)療器械創(chuàng)新的源泉
醫(yī)療器械是指單獨(dú)或組合應(yīng)用于人體的儀器���、設(shè)備、器具���、材料或其他物品�����,包括所需要的軟件���。其使用旨在達(dá)到對(duì)疾病的預(yù)防�����、診斷���、治療、監(jiān)護(hù)��、康復(fù)�����,對(duì)損傷或殘疾的診斷��、治療���、監(jiān)護(hù)、緩解�����、補(bǔ)償�����,對(duì)解剖或生理過(guò)程的研究��、替代、調(diào)節(jié)��,以及妊娠控制等目的��。醫(yī)療器械按風(fēng)險(xiǎn)從低到高分為Ⅰ��、Ⅱ、Ⅲ 3個(gè)類(lèi)型���,按型式分為有源醫(yī)療器械���、高端植入性醫(yī)用材料���、體外檢測(cè)試劑盒和低值耗材4個(gè)部分。高端醫(yī)療器械主要是指前2種型式���。
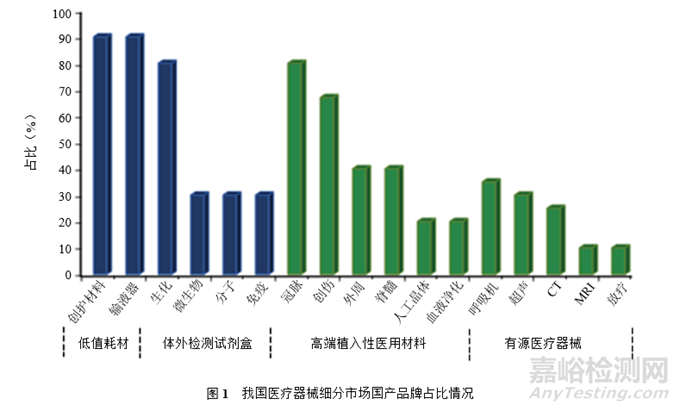
國(guó)際管理咨詢公司羅蘭貝格于2023年發(fā)布的《中國(guó)醫(yī)療器械行業(yè)發(fā)展現(xiàn)狀與趨勢(shì)》報(bào)告中指出,我國(guó)醫(yī)療器械市場(chǎng)規(guī)模從2021年的8 438億元躍升至2022年的9 582億元���,近7年復(fù)合增速約17.5%。但從藥品和醫(yī)療器械人均消費(fèi)額的比例(藥械比)角度看���,我國(guó)目前藥械比僅為2.9,與全球平均藥械比(1.4)水平仍有一定差距��,表明我國(guó)醫(yī)療器械市場(chǎng)未來(lái)存在較大的增長(zhǎng)空間��。報(bào)告還指出,目前我國(guó)80%~90%高端醫(yī)療器械都依賴于進(jìn)口�����,如放療設(shè)備、MRI等�����。我國(guó)醫(yī)療器械細(xì)分市場(chǎng)國(guó)產(chǎn)品牌占比情況見(jiàn)圖1���。雖然有部分醫(yī)療器械已經(jīng)實(shí)現(xiàn)了國(guó)產(chǎn)化,但其部分核心零部件��、原材料�����、制造設(shè)備和檢測(cè)設(shè)備等仍依賴進(jìn)口�����。
醫(yī)工結(jié)合是生物醫(yī)學(xué)工程面向臨床需求的具體體現(xiàn),是針對(duì)性設(shè)計(jì)能解決臨床問(wèn)題的醫(yī)療器械產(chǎn)品的關(guān)鍵步驟�����。生物醫(yī)學(xué)工程是醫(yī)療器械產(chǎn)品設(shè)計(jì)���、制造以及醫(yī)療器械產(chǎn)業(yè)發(fā)展的關(guān)鍵學(xué)科。
醫(yī)療器械的創(chuàng)新能力是醫(yī)療器械產(chǎn)業(yè)發(fā)展的核心驅(qū)動(dòng)力���。盡管?chē)?guó)家出臺(tái)了一系列政策鼓勵(lì)企業(yè)做原始創(chuàng)新,但目前一些國(guó)內(nèi)醫(yī)療企業(yè)仍存在創(chuàng)新動(dòng)力不足��、創(chuàng)新能力不強(qiáng)的現(xiàn)象�����。臨床的需求是醫(yī)療器械創(chuàng)新的源泉�����,生物醫(yī)學(xué)工程專家與臨床專家的充分合作與結(jié)合是醫(yī)療器械創(chuàng)新的前提��。醫(yī)工結(jié)合在醫(yī)療器械的研發(fā)�����、驗(yàn)證和升級(jí)換代過(guò)程中是不可替代的�����。不少地方政府陸續(xù)出臺(tái)政策支持臨床醫(yī)生參與醫(yī)療器械技術(shù)創(chuàng)新���,積極開(kāi)展醫(yī)療器械協(xié)同研發(fā)相關(guān)工作���,探索實(shí)施臨床試驗(yàn)機(jī)構(gòu)和臨床試驗(yàn)實(shí)施醫(yī)務(wù)人員的合作激勵(lì)機(jī)制,以推動(dòng)醫(yī)療器械創(chuàng)新發(fā)展�����。
醫(yī)工結(jié)合對(duì)醫(yī)療器械開(kāi)發(fā)的意義具體體現(xiàn)在:(1)促進(jìn)創(chuàng)新和發(fā)展��,推動(dòng)醫(yī)療器械的創(chuàng)新設(shè)計(jì)��、制造和使用�����,提高醫(yī)療技術(shù)水平�����;(2)改善醫(yī)療器械的性能和功能��,提高醫(yī)療設(shè)備的準(zhǔn)確性��、安全性和效率���,從而增強(qiáng)診斷和治療的準(zhǔn)確性和有效性�����,提升醫(yī)療質(zhì)量��;(3)幫助開(kāi)發(fā)個(gè)性化醫(yī)療解決方案�����,如定制化假肢��、人工智能輔助診斷系統(tǒng)等,根據(jù)患者的特定需求和生理特征進(jìn)行個(gè)體化的治療和康復(fù)�����;(4)鼓勵(lì)不同學(xué)科之間的合作�����,包括醫(yī)學(xué)���、生物學(xué)��、工程學(xué)和材料科學(xué)等領(lǐng)域的專家與研究人員之間的合作�����,從而促進(jìn)知識(shí)交流�����、技術(shù)創(chuàng)新和跨領(lǐng)域的發(fā)展;(5)有助于開(kāi)發(fā)更具競(jìng)爭(zhēng)力的醫(yī)療器械���,提高醫(yī)療資源的利用效率。
醫(yī)療器械產(chǎn)品研發(fā)的關(guān)鍵環(huán)節(jié)與關(guān)鍵因素
醫(yī)療器械產(chǎn)品的設(shè)計(jì)���、制造�����、臨床試驗(yàn)、醫(yī)療器械產(chǎn)品注冊(cè)證申報(bào)及其產(chǎn)業(yè)化是一個(gè)復(fù)雜的流程�����。每個(gè)環(huán)節(jié)對(duì)醫(yī)療器械的產(chǎn)業(yè)化至關(guān)重要�����,同時(shí)也可能成為其進(jìn)程中的障礙。本文主要從臨床醫(yī)學(xué)與生物醫(yī)學(xué)工程科學(xué)的結(jié)合���、醫(yī)療器械技術(shù)創(chuàng)新、醫(yī)療器械產(chǎn)品的研發(fā)���、醫(yī)療器械監(jiān)管政策與醫(yī)療器械創(chuàng)新和社會(huì)資本投資與醫(yī)療器械產(chǎn)業(yè)5個(gè)方面分別進(jìn)行闡述��。
1.臨床醫(yī)學(xué)與生物醫(yī)學(xué)工程科學(xué)的結(jié)合
臨床專家與生物醫(yī)學(xué)工程專家的緊密合作是醫(yī)療器械創(chuàng)新的關(guān)鍵�����。臨床專家根據(jù)臨床實(shí)踐經(jīng)驗(yàn)可以發(fā)現(xiàn)臨床治療中的瓶頸問(wèn)題�����,可以針對(duì)醫(yī)療器械產(chǎn)品的可能使用場(chǎng)景提出對(duì)未來(lái)產(chǎn)品的參數(shù)要求,生物醫(yī)學(xué)工程專家可以利用生物醫(yī)學(xué)工程技術(shù)設(shè)計(jì)出進(jìn)行體外或動(dòng)物模型測(cè)試的樣機(jī)��,這些環(huán)節(jié)都離不開(kāi)臨床醫(yī)生與生物醫(yī)學(xué)工程專家的緊密合作���。
如何有效地加強(qiáng)醫(yī)工結(jié)合呢?一些國(guó)際醫(yī)療器械龍頭企業(yè)��,如美敦力�����、強(qiáng)生等���,每年都會(huì)投入大量的研發(fā)經(jīng)費(fèi)���,同時(shí)設(shè)有專門(mén)的團(tuán)隊(duì)銜接臨床專家和生物醫(yī)學(xué)工程研發(fā)團(tuán)隊(duì)���,根據(jù)臨床需求設(shè)計(jì)出原創(chuàng)的醫(yī)療器械產(chǎn)品。國(guó)內(nèi)有些醫(yī)療器械企業(yè)則把精力放在產(chǎn)品仿制上��,但從較長(zhǎng)時(shí)間來(lái)看��,既浪費(fèi)了經(jīng)費(fèi)��,又失去了寶貴的原始創(chuàng)新機(jī)會(huì)。因此���,我國(guó)也需要有效地加強(qiáng)醫(yī)工結(jié)合。
醫(yī)工的有效結(jié)合需要強(qiáng)調(diào)優(yōu)勢(shì)互補(bǔ)�����,讓專業(yè)的人做專業(yè)的事。臨床醫(yī)生熟悉臨床需求��,但沒(méi)有受過(guò)專業(yè)的醫(yī)學(xué)工程訓(xùn)練�����,產(chǎn)品制造由生物醫(yī)學(xué)工程專家來(lái)完成則可事半功倍�����。生物醫(yī)學(xué)工程專家對(duì)于醫(yī)療器械產(chǎn)品的設(shè)計(jì)與制造有著舉足輕重的地位��。如本團(tuán)隊(duì)用了20多年時(shí)間研發(fā)了首個(gè)脊髓損傷修復(fù)產(chǎn)品——有序神經(jīng)再生膠原支架NeuroRegen®�����。該產(chǎn)品的設(shè)計(jì)來(lái)源于大量的臨床調(diào)研和一批神經(jīng)外科專家的參與。臨床醫(yī)生通過(guò)核磁共振圖像讓本研究團(tuán)隊(duì)了解到脊髓神經(jīng)像電纜一樣有序排列���;臨床專家也告訴本研究團(tuán)隊(duì)人脊髓是浸泡在流動(dòng)的腦脊液里的,這在動(dòng)物模型中是看不到的��。因此���,本團(tuán)隊(duì)設(shè)計(jì)了基于膠原纖維有序排列的NeuroRegen®��,同時(shí)解決了支架上藥物或細(xì)胞緩釋技術(shù)的難題。在之后的動(dòng)物模型及臨床研究中�����,臨床專家也發(fā)揮了不可替代的作用��。NeuroRegen®支架作為國(guó)際上首個(gè)治療脊髓損傷的產(chǎn)品,通過(guò)近9年120余例脊髓損傷患者的移植被證明安全有效���。該產(chǎn)品已于2023年7月獲得第六屆國(guó)家醫(yī)療器械創(chuàng)新大賽(醫(yī)用生物材料組)第一名��。
2.醫(yī)療器械技術(shù)創(chuàng)新
面向臨床需求是醫(yī)療器械創(chuàng)新的動(dòng)力�����。為了設(shè)計(jì)和制造出滿足臨床需求的迭代產(chǎn)品,發(fā)揮生物醫(yī)學(xué)工程專家的作用就顯得至關(guān)重要��。醫(yī)療器械的創(chuàng)新對(duì)于生物醫(yī)學(xué)工程人才的要求很高。在我國(guó)除了少數(shù)大型醫(yī)療器械企業(yè)外���,多數(shù)企業(yè)的研發(fā)力量較弱�����。生物醫(yī)學(xué)工程創(chuàng)新人才是我國(guó)醫(yī)療器械技術(shù)創(chuàng)新的主要力量��,主要集中在大學(xué)和科研院所。
近年來(lái)���,國(guó)家非常重視生物醫(yī)學(xué)工程學(xué)科的人才培養(yǎng)�����,不斷升級(jí)生物醫(yī)學(xué)工程學(xué)科的課程��,提升我國(guó)生物醫(yī)學(xué)工程人才的創(chuàng)新能力��。但醫(yī)療器械技術(shù)創(chuàng)新和理論創(chuàng)新有較大區(qū)別,醫(yī)療器械的技術(shù)創(chuàng)新對(duì)于醫(yī)療器械產(chǎn)品的設(shè)計(jì)���、制造至關(guān)重要,需要生物醫(yī)學(xué)工程人員重視產(chǎn)品的實(shí)際功效�����。
目前我國(guó)醫(yī)療器械創(chuàng)新力量主要集中在大學(xué)和科研院所���,科研人員和企業(yè)研發(fā)人員考核目標(biāo)的差別非常大�����?����?蒲腥藛T的晉升往往與科研基金和發(fā)表論文掛鉤,這導(dǎo)致科研人員的主要精力用于發(fā)表高影響因子論文和申請(qǐng)各類(lèi)基金�����。長(zhǎng)此以往,將會(huì)導(dǎo)致一些科研人員遠(yuǎn)離市場(chǎng)���,缺乏醫(yī)療器械技術(shù)創(chuàng)新敏感性及產(chǎn)品研發(fā)過(guò)程中解決實(shí)際問(wèn)題的能力。
改變科研院所科研人員的考核方式可以鼓勵(lì)一些科研人員積極投入到醫(yī)療器械技術(shù)創(chuàng)新過(guò)程中��。中國(guó)醫(yī)學(xué)科學(xué)院生物醫(yī)學(xué)工程研究所正在探索2個(gè)評(píng)估體系的結(jié)合,“理論創(chuàng)新學(xué)術(shù)帶頭人(principal investigator��,PI)”將注重考核科學(xué)問(wèn)題導(dǎo)向的論文和領(lǐng)域影響力�����;“應(yīng)用創(chuàng)新PI”將主要考核應(yīng)用導(dǎo)向的醫(yī)療器械技術(shù)創(chuàng)新發(fā)明專利和成果轉(zhuǎn)化績(jī)效等。后者將成為醫(yī)療器械技術(shù)創(chuàng)新的主力��,這和國(guó)家近期試行的卓越工程師培養(yǎng)計(jì)劃不謀而合。
3.醫(yī)療器械產(chǎn)品的研發(fā)
醫(yī)療器械產(chǎn)品的研發(fā)過(guò)程是在企業(yè)完成的�����,包括產(chǎn)品立項(xiàng)�����、概念驗(yàn)證��、產(chǎn)品標(biāo)準(zhǔn)及質(zhì)量體系建立、大動(dòng)物實(shí)驗(yàn)�����、臨床試驗(yàn)及醫(yī)療器械注冊(cè)申報(bào)等主要環(huán)節(jié)��。
醫(yī)療器械公司產(chǎn)品立項(xiàng)非常重要�����。醫(yī)療器械產(chǎn)品的技術(shù)可能來(lái)源于外部成果轉(zhuǎn)化���,也可能來(lái)自公司內(nèi)部的研發(fā)成果���。產(chǎn)品的立項(xiàng)往往需要較詳細(xì)的相關(guān)市場(chǎng)調(diào)研�����,包括技術(shù)的創(chuàng)新性�����、可行性及市場(chǎng)規(guī)模等。目前不少企業(yè)忽略了該階段�����,很多都是仿制類(lèi)產(chǎn)品���。近年來(lái)國(guó)家?guī)Я坎少?gòu)政策的實(shí)施�����,推動(dòng)了這一類(lèi)靠仿制的醫(yī)療器械企業(yè)開(kāi)始做原始創(chuàng)新研發(fā)��。還有一些企業(yè)需要通過(guò)市場(chǎng)調(diào)研報(bào)告來(lái)確定公司的戰(zhàn)略,但國(guó)內(nèi)的一些行業(yè)研究報(bào)告水平存在數(shù)據(jù)陳舊和真實(shí)性存疑等問(wèn)題���。筆者曾經(jīng)購(gòu)買(mǎi)過(guò)一份某類(lèi)醫(yī)療器械產(chǎn)品的行業(yè)報(bào)告��,發(fā)現(xiàn)其中數(shù)據(jù)主要拼湊于網(wǎng)上一些資料,缺乏及時(shí)性與真實(shí)性���,參考意義不大��。
醫(yī)療器械產(chǎn)品概念驗(yàn)證是公司通過(guò)測(cè)試來(lái)修改和定型產(chǎn)品的階段��,是企業(yè)研發(fā)團(tuán)隊(duì)的主要任務(wù)。目前大多數(shù)企業(yè)的產(chǎn)品概念驗(yàn)證是公司內(nèi)部測(cè)試完成的���,有部分需要貴重的設(shè)備完成測(cè)試,可以和科研部門(mén)合作或委托第三方測(cè)試企業(yè)幫助完成�����。近年來(lái)��,國(guó)家出臺(tái)政策鼓勵(lì)地方政府支持成立與產(chǎn)業(yè)配套的概念驗(yàn)證中心,初衷是幫助企業(yè)減少產(chǎn)品概念驗(yàn)證階段的人力投入和設(shè)備投入�����。但目前有些地方不考慮地區(qū)的產(chǎn)業(yè)現(xiàn)狀和需求�����,盲目設(shè)立不少概念驗(yàn)證中心�����。這些機(jī)構(gòu)大多缺乏足夠的相關(guān)專業(yè)團(tuán)隊(duì)及設(shè)備���,主要靠申請(qǐng)政府補(bǔ)貼來(lái)運(yùn)營(yíng)�����。從長(zhǎng)遠(yuǎn)來(lái)看���,這種現(xiàn)象可能讓企業(yè)付出更多的費(fèi)用及時(shí)間,甚至還有技術(shù)泄密的風(fēng)險(xiǎn)�����。
產(chǎn)品定型后���,企業(yè)需要建設(shè)廠房�����、建立產(chǎn)品標(biāo)準(zhǔn)及質(zhì)量體系�����。由于我國(guó)醫(yī)療器械起步較晚,這方面人才缺乏��。企業(yè)一般是通過(guò)咨詢顧問(wèn)公司及培養(yǎng)自己專業(yè)人才團(tuán)隊(duì)相結(jié)合的方式進(jìn)行�����。這對(duì)咨詢公司的能力及信譽(yù)度要求很高。如醫(yī)療器械的廠房與藥企廠房要求差別很大�����,如果所選的顧問(wèn)公司專業(yè)性不高會(huì)導(dǎo)致廠房在通過(guò)良好操作規(guī)范(good manufacturing practices��,GMP)驗(yàn)收時(shí)返工,導(dǎo)致時(shí)間和經(jīng)費(fèi)的浪費(fèi)�����。質(zhì)量體系專業(yè)性要求更強(qiáng),多個(gè)層級(jí)的幾百份文件都十分專業(yè)�����。筆者也曾找過(guò)一家顧問(wèn)公司��,只收到一套文件樣板���,對(duì)撰寫(xiě)產(chǎn)品質(zhì)量體系沒(méi)有太多幫助�����。產(chǎn)品標(biāo)準(zhǔn)也很重要�����,如果設(shè)計(jì)不合理會(huì)增加產(chǎn)品的生產(chǎn)成本�����。令人擔(dān)憂的是目前有些醫(yī)療器械相關(guān)的顧問(wèn)公司不專注提供獨(dú)立的產(chǎn)品研發(fā)階段的某項(xiàng)特色服務(wù)��,而是擴(kuò)張到全鏈條�����,這可能涉及到利益沖突���、核心技術(shù)泄密等問(wèn)題。
醫(yī)療器械產(chǎn)品的注冊(cè)檢驗(yàn)報(bào)告是醫(yī)療器械產(chǎn)品注冊(cè)申報(bào)的必備文件���。以前相關(guān)產(chǎn)品檢測(cè)只能在中國(guó)食品藥品檢定研究院及相關(guān)單位進(jìn)行�����。隨著國(guó)家對(duì)醫(yī)療器械發(fā)展的支持,逐漸開(kāi)放了醫(yī)療器械第三方檢測(cè)中心的設(shè)立���,對(duì)我國(guó)醫(yī)療器械發(fā)展起了推動(dòng)作用,在醫(yī)療器械產(chǎn)品檢驗(yàn)項(xiàng)目及檢測(cè)方法上有非常大的優(yōu)化空間��。以動(dòng)物源性生物材料植入性醫(yī)療器械為例,這類(lèi)產(chǎn)品在世界范圍內(nèi)的應(yīng)用超過(guò)了半個(gè)世紀(jì)��,大量的臨床使用數(shù)據(jù)表明其安全可靠���。但目前要求的檢測(cè)內(nèi)容除了必要的物理指標(biāo)及化學(xué)殘留外���,每個(gè)產(chǎn)品的生物降解���、免疫源性���、遺傳毒和病毒滅活等都需要檢測(cè)���。理論上講動(dòng)物源性的材料都有病毒傳播的風(fēng)險(xiǎn),還有瘋牛病病原體的傳播風(fēng)險(xiǎn)��。20多年前�����,世界衛(wèi)生組織就發(fā)布了瘋牛病病原體滅活方法。現(xiàn)在國(guó)內(nèi)動(dòng)物源性醫(yī)療器械生產(chǎn)工藝都要求加上相關(guān)工藝而且也需廣泛驗(yàn)證���。如果動(dòng)物源性的醫(yī)療器械生產(chǎn)工藝?yán)锖幸郧捌渌嚓P(guān)產(chǎn)品已經(jīng)驗(yàn)證的病毒滅活、瘋牛病病原體滅活工藝��,是否可以豁免這樣的重復(fù)驗(yàn)證�����?
大動(dòng)物實(shí)驗(yàn)報(bào)告也是醫(yī)療器械產(chǎn)品注冊(cè)申報(bào)的必備文件��。試圖通過(guò)大動(dòng)物實(shí)驗(yàn)報(bào)告來(lái)證明產(chǎn)品的安全性與有效性,這樣的要求對(duì)于一些產(chǎn)品是必要的��,特別是臨床上沒(méi)有類(lèi)似產(chǎn)品��,而且無(wú)法判定安全性的產(chǎn)品。而動(dòng)物源性生物材料植入性醫(yī)療器械已經(jīng)大量用于臨床���,已經(jīng)有充分的數(shù)據(jù)證明其安全性。至于有效性�����,動(dòng)物與人的差別���,動(dòng)物模型與人體真實(shí)疾病的差別非常大,有效性應(yīng)該是臨床試驗(yàn)階段考察的目標(biāo)�����。大動(dòng)物實(shí)驗(yàn)報(bào)告往往需要企業(yè)花大量的時(shí)間和資金。
臨床試驗(yàn)�����、醫(yī)療器械注冊(cè)申報(bào)是產(chǎn)品研發(fā)的關(guān)鍵���。獲得醫(yī)療器械產(chǎn)品注冊(cè)證可以幫助企業(yè)進(jìn)入快速發(fā)展階段�����。這個(gè)階段一般企業(yè)也需要與顧問(wèn)公司合作來(lái)完成�����。需要確定臨床中心���、臨床方案���。臨床費(fèi)用是臨床試驗(yàn)費(fèi)用的主要部分��,近年來(lái)價(jià)格上漲很快���。臨床方案中還需要有臨床統(tǒng)計(jì)顧問(wèn)參與。統(tǒng)計(jì)費(fèi)用從十幾年前幾萬(wàn)漲到現(xiàn)在十幾萬(wàn)���、幾十萬(wàn)或更高���。對(duì)比一下工作量��,一項(xiàng)國(guó)家自然科學(xué)基金面上項(xiàng)目也就50萬(wàn)元左右,但其研究工作需要一個(gè)研究團(tuán)隊(duì)4年完成���。臨床試驗(yàn)費(fèi)用大幅上漲���,給醫(yī)療器械企業(yè)研發(fā)帶來(lái)較大壓力。醫(yī)療器械產(chǎn)品注冊(cè)一般也需要顧問(wèn)公司幫助完成��,好的顧問(wèn)公司在注冊(cè)資料的整理及審評(píng)過(guò)程中發(fā)補(bǔ)回復(fù)資料的準(zhǔn)備都有幫助�����,甚至包括產(chǎn)品的名稱是否影響產(chǎn)品進(jìn)入醫(yī)保系統(tǒng)等。
4.醫(yī)療器械監(jiān)管政策與醫(yī)療器械創(chuàng)新
醫(yī)療器械行業(yè)是國(guó)家重點(diǎn)支持的戰(zhàn)略新興產(chǎn)業(yè)���。國(guó)家“十三五”“十四五”陸續(xù)出臺(tái)一系列支持醫(yī)療器械產(chǎn)業(yè)政策��。
2018年11月���,國(guó)家藥品監(jiān)督管理局組織修訂了《創(chuàng)新醫(yī)療器械特別審查程序》�����,針對(duì)具有核心技術(shù)發(fā)明專利���、國(guó)際領(lǐng)先���、國(guó)內(nèi)首創(chuàng)���、具有顯著的臨床應(yīng)用價(jià)值等情形的醫(yī)療器械優(yōu)先予以審評(píng)審批��。2021年3月���,《中華人民共和國(guó)國(guó)民經(jīng)濟(jì)和社會(huì)發(fā)展第十四個(gè)五年規(guī)劃和2035年遠(yuǎn)景目標(biāo)綱要》發(fā)布�����。2021年12月���,工業(yè)和信息化部等10部門(mén)聯(lián)合印發(fā)《“十四五”醫(yī)療裝備產(chǎn)業(yè)發(fā)展規(guī)劃》�����,是醫(yī)療裝備領(lǐng)域首個(gè)國(guó)家層面的產(chǎn)業(yè)發(fā)展規(guī)劃�����。2022年9月�����,財(cái)政部等5部門(mén)發(fā)布《關(guān)于加快部分領(lǐng)域設(shè)備更新改造貸款財(cái)政貼息工作的通知》�����。2023年2月���,《質(zhì)量強(qiáng)國(guó)建設(shè)綱要》發(fā)布�����,提到要推動(dòng)臨床急需和罕見(jiàn)病治療藥品�����、醫(yī)療器械審評(píng)審批提速。近期���,國(guó)務(wù)院常務(wù)會(huì)議審議通過(guò)《醫(yī)藥工業(yè)高質(zhì)量發(fā)展行動(dòng)計(jì)劃(2023—2025年)》《醫(yī)療裝備產(chǎn)業(yè)高質(zhì)量發(fā)展行動(dòng)計(jì)劃(2023—2025年)》2部醫(yī)療產(chǎn)業(yè)高質(zhì)量發(fā)展規(guī)劃,從醫(yī)藥創(chuàng)新���、醫(yī)藥原輔料供給和醫(yī)械裝備突破等方面給予明確指導(dǎo)。
醫(yī)療器械監(jiān)管政策的研究與制訂可以促進(jìn)醫(yī)療器械的創(chuàng)新與醫(yī)療器械產(chǎn)業(yè)的發(fā)展�����,其與國(guó)家對(duì)醫(yī)療器械產(chǎn)業(yè)的支持是相輔相成的。醫(yī)療器械的監(jiān)管政策涉及產(chǎn)品的分類(lèi)���、標(biāo)準(zhǔn)及質(zhì)量體系、檢測(cè)及臨床前研究�����、臨床研究及產(chǎn)品注冊(cè)和上市后的研究等�����。僅從創(chuàng)新醫(yī)療器械分類(lèi)和罕見(jiàn)病醫(yī)療器械方面來(lái)說(shuō)明醫(yī)療器械監(jiān)管研究對(duì)于醫(yī)療器械創(chuàng)新的重要性。
國(guó)務(wù)院分別于2015年8月���、2017年10月頒布《國(guó)務(wù)院關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見(jiàn)》及《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見(jiàn)》,用以鼓勵(lì)醫(yī)療器械創(chuàng)新�����。國(guó)家藥品監(jiān)督管理局圍繞發(fā)展和監(jiān)管��,修訂發(fā)布《創(chuàng)新醫(yī)療器械特別審查程序》(2018年第83號(hào))���,將具有我國(guó)發(fā)明專利��、在技術(shù)上屬于國(guó)內(nèi)首創(chuàng)��、在國(guó)際領(lǐng)先���、具有顯著臨床應(yīng)用價(jià)值的醫(yī)療器械納入特別審批通道���。創(chuàng)新醫(yī)療器械進(jìn)入特別審批程序后�����,主要采取早期介入�����、專人負(fù)責(zé)�����、全程指導(dǎo),在標(biāo)準(zhǔn)不降低�����、程序不減少的情況下予以優(yōu)先審評(píng)審批。符合下列情形的醫(yī)療器械審查���,適用于特別審查程序:
(1)申請(qǐng)人通過(guò)其主導(dǎo)的技術(shù)創(chuàng)新活動(dòng),在中國(guó)依法擁有產(chǎn)品核心技術(shù)發(fā)明專利權(quán)��,或依法通過(guò)受讓取得在中國(guó)發(fā)明專利權(quán)或其使用權(quán)�����,創(chuàng)新醫(yī)療器械特別審查申請(qǐng)時(shí)間距專利授權(quán)公告日不超過(guò)5年���;或核心技術(shù)發(fā)明專利的申請(qǐng)已由國(guó)務(wù)院專利行政部門(mén)公開(kāi)���,并由國(guó)家知識(shí)產(chǎn)權(quán)局專利檢索咨詢中心出具檢索報(bào)告��,報(bào)告載明產(chǎn)品核心技術(shù)方案具備新穎性和創(chuàng)造性�����。
(2)申請(qǐng)人已完成產(chǎn)品的前期研究并具有基本定型產(chǎn)品�����,研究過(guò)程真實(shí)和受控,研究數(shù)據(jù)完整和可溯源�����。
(3)產(chǎn)品主要工作原理或作用機(jī)制為國(guó)內(nèi)首創(chuàng)���,產(chǎn)品性能或安全性與同類(lèi)產(chǎn)品比較有根本性改進(jìn),技術(shù)上處于國(guó)際領(lǐng)先水平���,且具有顯著的臨床應(yīng)用價(jià)值。國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心設(shè)立創(chuàng)新醫(yī)療器械審查辦公室��,對(duì)創(chuàng)新醫(yī)療器械特別審查申請(qǐng)進(jìn)行審查��。創(chuàng)新醫(yī)療器械審查辦公室作出審查決定后,將審查結(jié)果通過(guò)器審中心網(wǎng)站告知申請(qǐng)人�����。審查結(jié)果告知后5年內(nèi)���,未申報(bào)注冊(cè)的創(chuàng)新醫(yī)療器械��,不再按照特別審查程序?qū)嵤彶椤?年后�����,申請(qǐng)人可按照特別審查程序重新申請(qǐng)創(chuàng)新醫(yī)療器械特別審查�����。
創(chuàng)新醫(yī)療器械特別審查程序的實(shí)施,確實(shí)給一些創(chuàng)新器械的快速審批帶來(lái)了顯著的促進(jìn)作用��。隨著該政策將近5年的實(shí)施,創(chuàng)新醫(yī)療器械特別審查過(guò)程也有許多需要改進(jìn)的地方��。如創(chuàng)新醫(yī)療器械特別審查程序中的國(guó)內(nèi)首創(chuàng)目標(biāo)需要調(diào)整�����。隨著醫(yī)療器械產(chǎn)業(yè)的國(guó)際化���,醫(yī)療器械原創(chuàng)研發(fā)至關(guān)重要�����。從目前獲得創(chuàng)新醫(yī)療器械審批的產(chǎn)品看主要是仿制產(chǎn)品。從長(zhǎng)期來(lái)看�����,鼓勵(lì)企業(yè)加大研發(fā)投入�����,加大原始創(chuàng)新醫(yī)療器械的研發(fā),將有利于提高國(guó)家醫(yī)療器械關(guān)鍵技術(shù)在世界范圍內(nèi)的競(jìng)爭(zhēng)力��。因此,建議創(chuàng)新醫(yī)療器械應(yīng)該重點(diǎn)支持國(guó)際領(lǐng)先的技術(shù)與產(chǎn)品��。
創(chuàng)新醫(yī)療器械特別審查程序規(guī)定創(chuàng)新醫(yī)療器械特別審查申請(qǐng)時(shí)間距專利授權(quán)公告日不超過(guò)5年��。這一規(guī)定脫離了國(guó)內(nèi)科研單位專利申請(qǐng)、轉(zhuǎn)化與實(shí)施過(guò)程長(zhǎng)及效率偏低的現(xiàn)實(shí)��。雖然國(guó)家設(shè)立了綠色通道加快了一些專利審查與授權(quán)時(shí)間�����,但是專利成果的轉(zhuǎn)化到實(shí)施仍需要很長(zhǎng)的時(shí)間。尤其是一些原創(chuàng)技術(shù)到產(chǎn)品的轉(zhuǎn)化過(guò)程時(shí)間很長(zhǎng)���,產(chǎn)品概念驗(yàn)證要花費(fèi)多年的時(shí)間。所以這樣的規(guī)定實(shí)際上會(huì)阻礙原始創(chuàng)新�����。本團(tuán)隊(duì)2003年開(kāi)始研發(fā)的首個(gè)脊髓損傷修復(fù)產(chǎn)品有序神經(jīng)再生膠原支架NeuroRegen®���,2014年獲得了改進(jìn)型國(guó)家發(fā)明專利。在該專利5年期內(nèi)申報(bào)了創(chuàng)新醫(yī)療器械通道�����,但在審查過(guò)程中因?yàn)槌^(guò)了5年被駁回。為什么創(chuàng)新通道的專利有效期要規(guī)定為5年,而不是像國(guó)家的發(fā)明專利一樣有效期20年呢���?
另外�����,創(chuàng)新醫(yī)療器械產(chǎn)品的認(rèn)定過(guò)程都是通過(guò)專家委員會(huì)來(lái)評(píng)審��,但是隔行如隔山,創(chuàng)新醫(yī)療器械產(chǎn)品需要行業(yè)內(nèi)很了解該產(chǎn)品的專家來(lái)認(rèn)定�����。很有可能評(píng)審某個(gè)產(chǎn)品的專家委員會(huì)只有少數(shù)專家達(dá)到此要求��,那么這個(gè)專家委員會(huì)的結(jié)論就未必科學(xué)合理。因此���,建議采用對(duì)創(chuàng)新醫(yī)療器械產(chǎn)品的核心要素?cái)?shù)字化,通過(guò)大數(shù)據(jù)了解該產(chǎn)品是否創(chuàng)新��,創(chuàng)新程度如何,盡量減少審評(píng)過(guò)程中人為誤差���。還是以本團(tuán)隊(duì)研發(fā)的神經(jīng)再生膠原支架NeuroRegen®產(chǎn)品為例,2023年7月在第六屆國(guó)家醫(yī)療器械大賽上獲得生物材料組第一名��,但在9月份舉行的醫(yī)療器械大賽決賽上僅因一位“專家”不相信脊髓神經(jīng)能再生,導(dǎo)致NeuroRegen®支架產(chǎn)品最后僅獲得鼓勵(lì)獎(jiǎng)�����。因此�����,專家評(píng)審時(shí)應(yīng)該去調(diào)查研究、深入分析該領(lǐng)域的情況��。另外評(píng)獎(jiǎng)過(guò)程中僅因個(gè)人言論就可以影響其他專家打分的評(píng)價(jià)方式也需要改變�����。
我國(guó)對(duì)罕見(jiàn)病相關(guān)醫(yī)療器械研究的重視度有些不夠。罕見(jiàn)病是指發(fā)病率極低的疾病���。根據(jù)世界衛(wèi)生組織的定義���,罕見(jiàn)病為患病人數(shù)占總?cè)丝?.065%~0.100%的疾病。罕見(jiàn)病多數(shù)沒(méi)有特效藥治療��,因此常危及生命��。罕見(jiàn)病為什么特效藥少?除了一些是發(fā)病機(jī)制不清楚外�����,主要是因?yàn)榛颊邤?shù)量太少���,市場(chǎng)極其有限��,企業(yè)無(wú)法承擔(dān)產(chǎn)品研發(fā)成本無(wú)以回報(bào)的風(fēng)險(xiǎn)��。因此���,不少國(guó)家開(kāi)始出臺(tái)罕見(jiàn)病產(chǎn)品研發(fā)的優(yōu)惠政策�����,支持企業(yè)通過(guò)綠色通道在保持產(chǎn)品安全性前提下大大降低研發(fā)成本�����,特別是降低臨床試驗(yàn)成本來(lái)獲得產(chǎn)品注冊(cè)證。
最近��,期待已久的國(guó)家第二批罕見(jiàn)病目錄公布,與第一期目錄類(lèi)似���,第二批目錄沒(méi)有出生缺陷的一些疾病,如脊柱裂��、唇腭裂�����、新生兒膈疝��、尿道裂���、陰道缺失和先天性心臟病等。筆者“十三五”期間主持了國(guó)家“出生缺陷組織器官再生修復(fù)產(chǎn)品的研發(fā)”重大研發(fā)計(jì)劃���,項(xiàng)目針對(duì)以上疾病開(kāi)展的出生缺陷再生修復(fù)醫(yī)療器械產(chǎn)品研發(fā),這些疾病的發(fā)病率都遠(yuǎn)低于世界衛(wèi)生組織定義罕見(jiàn)病的發(fā)病率�����,應(yīng)該屬于罕見(jiàn)病��。
以新生兒膈疝為例���,大多數(shù)嬰兒產(chǎn)前檢測(cè)時(shí)被人流掉�����。如果產(chǎn)后24 h通過(guò)新生兒手術(shù),可以通過(guò)再生材料補(bǔ)片進(jìn)行修復(fù)�����,新生兒可以正常發(fā)育。如果有膈疝修復(fù)產(chǎn)品���,我國(guó)健康新生兒每年可以增加5 000~10 000例。但是按照正常的疾病分類(lèi)�����,企業(yè)很難承擔(dān)起產(chǎn)品臨床試驗(yàn)的時(shí)間及費(fèi)用。我國(guó)每年大概有一萬(wàn)左右女?huà)牖枷忍煨躁幍廊睋p或缺失�����。目前還沒(méi)產(chǎn)品專門(mén)用來(lái)重建陰道�����。陰道缺損給這類(lèi)女孩身心帶來(lái)非常大的負(fù)擔(dān)���。此外��,最關(guān)注的脊髓損傷也屬于罕見(jiàn)病���。我國(guó)每年有10萬(wàn)人患有脊髓損傷�����,其發(fā)病率也低于世界衛(wèi)生組織定義罕見(jiàn)病的發(fā)病率。脊髓損傷多為年青人��,給家庭和社會(huì)帶來(lái)沉重的負(fù)擔(dān)��。如果脊髓損傷按罕見(jiàn)病來(lái)定義,本團(tuán)隊(duì)研發(fā)的國(guó)際上首個(gè)脊髓損傷修復(fù)產(chǎn)品有序神經(jīng)再生膠原支架NeuroRegen®產(chǎn)品有可能獲得醫(yī)療器械產(chǎn)品注冊(cè)證�����,以盡快造福這些患者���。
國(guó)家目前對(duì)罕見(jiàn)病認(rèn)定數(shù)量偏低���。國(guó)際上認(rèn)定罕見(jiàn)病有7 000多種��,而我國(guó)第一批罕見(jiàn)病目錄只有121種��,第二批目錄只有86種�����,共計(jì)207種。建議罕見(jiàn)病按照疾病流行病發(fā)生的罕見(jiàn)性來(lái)定義��,不需要具體的目錄��。
5.社會(huì)資本投資與醫(yī)療器械產(chǎn)業(yè)
社會(huì)資本可以促進(jìn)醫(yī)療器械的創(chuàng)新和加快創(chuàng)新醫(yī)療器械產(chǎn)業(yè)化��。與藥品研發(fā)相比�����,醫(yī)療器械產(chǎn)品的研發(fā)周期短�����、投入少。從過(guò)去的主體投資項(xiàng)目來(lái)看���,社會(huì)資本的投資主要集中在制藥企業(yè)。隨著國(guó)家出臺(tái)支持醫(yī)療器械創(chuàng)新的政策�����,社會(huì)資本開(kāi)始關(guān)注醫(yī)療器械產(chǎn)業(yè)��。但不管是政府的產(chǎn)業(yè)基金還是商業(yè)風(fēng)險(xiǎn)投資基金都存在投入偏少的現(xiàn)象���。
不少地方政府組建健康產(chǎn)業(yè)基金來(lái)促進(jìn)地方健康產(chǎn)業(yè)的發(fā)展,醫(yī)藥產(chǎn)業(yè)需要時(shí)間來(lái)培育��,需要耐心��。既然地方政府需要打造醫(yī)療器械產(chǎn)業(yè),就應(yīng)該有至少10年的孵育期���。實(shí)際上有些地方上一屆政府的產(chǎn)業(yè)政策到下一屆政府就變味了。這導(dǎo)致醫(yī)療器械產(chǎn)業(yè)的夭折和政府資源的浪費(fèi)���。政府產(chǎn)業(yè)基金一般不愿意孵育初創(chuàng)企業(yè),而愿意花大價(jià)錢(qián)引進(jìn)成熟的大企業(yè)或上市企業(yè)���。這對(duì)于當(dāng)?shù)卣畞?lái)說(shuō)可能只是表面經(jīng)濟(jì)數(shù)據(jù)好看一些�����,實(shí)際上花掉的資源比孵育初創(chuàng)企業(yè)要大得多���,更重要的是失去了孵化本地產(chǎn)業(yè)集群的時(shí)機(jī)。政府產(chǎn)業(yè)基金應(yīng)該主要側(cè)重孵化本地初創(chuàng)企業(yè)���,醫(yī)療器械初創(chuàng)企業(yè)需要的資金比藥企少得多�����,政府產(chǎn)業(yè)基金完全可以承擔(dān)此風(fēng)險(xiǎn)��。
商業(yè)風(fēng)險(xiǎn)投資也可以促進(jìn)醫(yī)療器械的創(chuàng)新與產(chǎn)業(yè)發(fā)展。但是一些風(fēng)險(xiǎn)投資機(jī)構(gòu)缺乏了解醫(yī)療器械產(chǎn)業(yè)的人才���。部分投資團(tuán)隊(duì)不了解醫(yī)療器械產(chǎn)業(yè),特別在過(guò)去的10年��,投資團(tuán)隊(duì)很少能靜下心來(lái)了解醫(yī)療器械產(chǎn)業(yè)��、傾聽(tīng)項(xiàng)目技術(shù)創(chuàng)新點(diǎn)��,同時(shí)對(duì)風(fēng)險(xiǎn)的忍耐度也很低��。因此���,真正的原創(chuàng)項(xiàng)目常被忽視���,造成盲目跟投,甚至出現(xiàn)泄密現(xiàn)象�����。
企業(yè)通過(guò)上市獲得的資金可以大大提升企業(yè)的創(chuàng)新能力�����,把企業(yè)做大做強(qiáng)�����。但是目前的國(guó)內(nèi)上市平臺(tái)對(duì)醫(yī)療器械初創(chuàng)企業(yè)的創(chuàng)新來(lái)說(shuō)幫助不大��。國(guó)內(nèi)創(chuàng)業(yè)板對(duì)公司上市的要求是連續(xù)3年的利潤(rùn)達(dá)幾千萬(wàn)�����。同比美國(guó)的創(chuàng)業(yè)板關(guān)注的主要是企業(yè)的創(chuàng)新技術(shù)本身�����,很多企業(yè)成立第1年就能上市,獲得的資金可以幫助企業(yè)加快研發(fā)和發(fā)展���。當(dāng)醫(yī)療器械公司年利潤(rùn)超過(guò)幾千萬(wàn)�����,進(jìn)入發(fā)展期���,多數(shù)并不缺乏資金,創(chuàng)業(yè)板募集的資金起到的作用僅是錦上添花���。因此背離助力產(chǎn)業(yè)研發(fā)初衷���。
構(gòu)建再生醫(yī)學(xué)產(chǎn)業(yè)發(fā)展的微環(huán)境
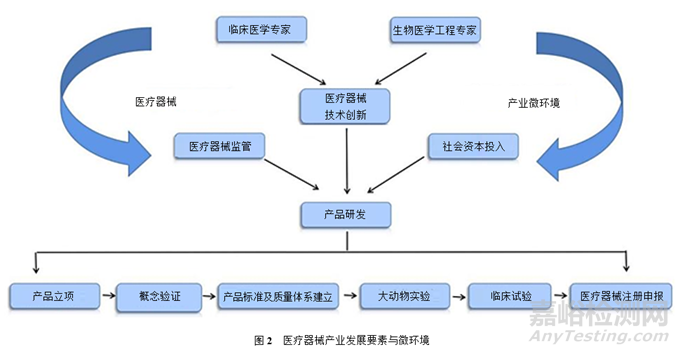
醫(yī)療器械產(chǎn)業(yè)的高質(zhì)量發(fā)展需要一個(gè)合適的微環(huán)境�����。(圖2)
國(guó)家政策鼓勵(lì)在京津冀�����、長(zhǎng)三角和粵港澳發(fā)展醫(yī)藥產(chǎn)業(yè)集群���,完善產(chǎn)業(yè)鏈�����。與醫(yī)藥產(chǎn)業(yè)相比���,醫(yī)療器械產(chǎn)業(yè)規(guī)模小��,很多技術(shù)及法規(guī)都有待完善。但這也正是千載難逢的機(jī)遇��。醫(yī)療器械產(chǎn)業(yè)快速發(fā)展也需要產(chǎn)業(yè)集群形式,形成從原料供應(yīng)到臨床服務(wù)的產(chǎn)業(yè)鏈��,打造一個(gè)適合行業(yè)發(fā)展的微環(huán)境。
圍繞著醫(yī)療器械產(chǎn)業(yè)集群建設(shè)��,加速生物醫(yī)學(xué)工程核心技術(shù)的轉(zhuǎn)化最為關(guān)鍵。與海外醫(yī)藥龍頭企業(yè)相比��,我國(guó)的醫(yī)藥企業(yè)研發(fā)投入偏低��,部分原因?yàn)閲?guó)內(nèi)企業(yè)研發(fā)基礎(chǔ)弱產(chǎn)出效率低,盡管?chē)?guó)家出臺(tái)政策鼓勵(lì)企業(yè)加大研發(fā)投入���,但成效并不顯著。因此加大大學(xué)和科研院所成果的轉(zhuǎn)移及團(tuán)隊(duì)的引進(jìn)可能更為重要��。這需要地方政府著眼于未來(lái)為醫(yī)療器械產(chǎn)業(yè)量身制定配套的產(chǎn)業(yè)支撐政策���。
地方政府的醫(yī)療器械產(chǎn)業(yè)基金是醫(yī)療器械產(chǎn)業(yè)集群建設(shè)最重要的保障。從國(guó)內(nèi)投資機(jī)構(gòu)來(lái)看�����,他們?nèi)狈?guó)外投資機(jī)構(gòu)的長(zhǎng)線投資忍耐度���,更喜歡短平快項(xiàng)目或成熟的項(xiàng)目�����。錦上添花對(duì)于醫(yī)療器械產(chǎn)業(yè)發(fā)展來(lái)說(shuō)絲毫無(wú)益。面對(duì)初創(chuàng)醫(yī)療器械企業(yè)��,政府產(chǎn)業(yè)基金要投首輪�����,幫助企業(yè)盡快啟動(dòng)。醫(yī)療器械產(chǎn)業(yè)的發(fā)展需要產(chǎn)業(yè)基金做更多雪中送炭的事情���。醫(yī)療器械企業(yè)初具規(guī)模、產(chǎn)品管線清晰后�����,可以協(xié)助引進(jìn)投資機(jī)構(gòu)或幫助企業(yè)上市�����,引導(dǎo)企業(yè)進(jìn)入高速發(fā)展軌道�����。
醫(yī)療器械產(chǎn)品設(shè)計(jì)在不斷創(chuàng)新�����,很多產(chǎn)品沒(méi)有現(xiàn)成的法規(guī)可依��。需要有專門(mén)團(tuán)隊(duì)與國(guó)家市場(chǎng)監(jiān)督管理總局相關(guān)部門(mén)保持溝通,共同制定行業(yè)監(jiān)管政策和創(chuàng)新產(chǎn)品的審評(píng)路徑,讓企業(yè)在醫(yī)療器械產(chǎn)品研發(fā)過(guò)程中少走彎路��,同時(shí)引導(dǎo)企業(yè)突破產(chǎn)品研發(fā)過(guò)程中的思維瓶頸�����。
醫(yī)療器械產(chǎn)業(yè)化人才缺乏�����,各方面的人才需要企業(yè)自己培養(yǎng)��。作為產(chǎn)業(yè)集群建設(shè)的一部分��,做好人才引進(jìn)和培訓(xùn)可以極大地助力醫(yī)療器械產(chǎn)業(yè)的發(fā)展�����。培養(yǎng)方式既可以培訓(xùn)班形式�����,也可以和當(dāng)?shù)丶夹?�、中?�;蚋咝:献鞫ㄏ蚺囵B(yǎng)醫(yī)療器械人才���,不斷為企業(yè)輸送新鮮血液�����。
建立一個(gè)高效的生物醫(yī)學(xué)工程技術(shù)平臺(tái)和專業(yè)的強(qiáng)有力的企業(yè)服務(wù)團(tuán)隊(duì)對(duì)于醫(yī)療器械產(chǎn)業(yè)發(fā)展非常重要��。一支專業(yè)的知識(shí)產(chǎn)權(quán)服務(wù)團(tuán)隊(duì)���、產(chǎn)品檢驗(yàn)及注冊(cè)服務(wù)團(tuán)隊(duì)可以為早期企業(yè)節(jié)省大量人力成本,同時(shí)也會(huì)顯著提升企業(yè)產(chǎn)品研發(fā)效率��。
本文介紹了醫(yī)療器械產(chǎn)業(yè)微環(huán)境的主要組成部分���,筆者多年前就有建立醫(yī)療器械產(chǎn)業(yè)集群的想法。與數(shù)百個(gè)國(guó)家級(jí)醫(yī)藥產(chǎn)業(yè)園相比規(guī)模不大,醫(yī)療器械產(chǎn)業(yè)集群非常適合二三線城市的高新區(qū)建設(shè)�����?��;疽c(diǎn)是引進(jìn)���、孵化30~50家醫(yī)療器械產(chǎn)業(yè),并建立一支專門(mén)團(tuán)隊(duì)為這些企業(yè)服務(wù)���,包括人才招聘和培訓(xùn)���、知識(shí)產(chǎn)權(quán)�����、產(chǎn)品檢驗(yàn)��、臨床研究、產(chǎn)品注冊(cè)和投資服務(wù)等方面��。建立一個(gè)規(guī)模為5~10億的醫(yī)療器械產(chǎn)業(yè)基金為初創(chuàng)企業(yè)雪中送炭。一個(gè)30~50家良性發(fā)展的醫(yī)療器械產(chǎn)業(yè)集群�����,將形成一個(gè)令人矚目的醫(yī)療器械產(chǎn)業(yè)高地。