在2022年11月,由RDPAC 的藥學(xué)團(tuán)隊(duì)對中美歐藥學(xué)技術(shù)指導(dǎo)原則和指南進(jìn)行了調(diào)研與對比�,總結(jié)分析了中美歐指南的標(biāo)準(zhǔn)差異及實(shí)施情況差異,采用了主題詞及分類方式���、深度對比�、報(bào)告撰寫和定稿流程,最后呈現(xiàn)研究報(bào)告����,給到藥審中心參考。
技術(shù)指導(dǎo)原則有其自身的特點(diǎn):
第一�、指導(dǎo)原則是在藥品注冊管理法規(guī)的框架下�,遵循藥品研發(fā)和技術(shù)審評的規(guī)律撰寫的指導(dǎo)性原則,并非硬性規(guī)定;����。
第二���、隨著我國藥品研發(fā)和評價(jià)的發(fā)展和變化�,指導(dǎo)原則也比如會(huì)客觀且不斷的進(jìn)行修改和完善����。
第三、藥品研發(fā)與評價(jià)是一個(gè)復(fù)雜����、科學(xué)的系統(tǒng)工程���,藥品研發(fā)者與評價(jià)者在遵循一般規(guī)律和原則的同時(shí)���,應(yīng)具體問題具體分析����,不應(yīng)被普遍性要求阻礙創(chuàng)新。
為此����,足夠的行業(yè)宣傳和培訓(xùn)���,及適時(shí)的進(jìn)行更新或修訂�,會(huì)使得技術(shù)指導(dǎo)原則的使用更為準(zhǔn)確�,也會(huì)更好的促進(jìn)藥物的研發(fā)。
我們將分享調(diào)研報(bào)告的精華部分�,給到同行參考����,給到同行理解藥審中心自2022年11月之后的藥學(xué)指南更新,理解藥審中心培訓(xùn)主題的安排����。
本文為調(diào)研報(bào)告的概述部分����。課題組對75 個(gè)中國����、187 個(gè) FDA 和 76 個(gè) EMA 的藥學(xué)專業(yè)技術(shù)指導(dǎo)原則進(jìn)行分析���,分別按照原料藥����、雜質(zhì)�、輔料包材、工藝開發(fā)及質(zhì)量管控等共計(jì) 20 個(gè)主題詞進(jìn)行分類及對比分析。 按主題詞分類分析結(jié)果顯示我國藥學(xué)指南綜合性強(qiáng)���,一個(gè)指南中可能含有歐美多個(gè)指南的內(nèi)容,所以我國藥學(xué)專業(yè)各個(gè)主題詞中均包括對應(yīng)的指南���,已形成初具規(guī)模的藥學(xué)指導(dǎo)原則體系���。
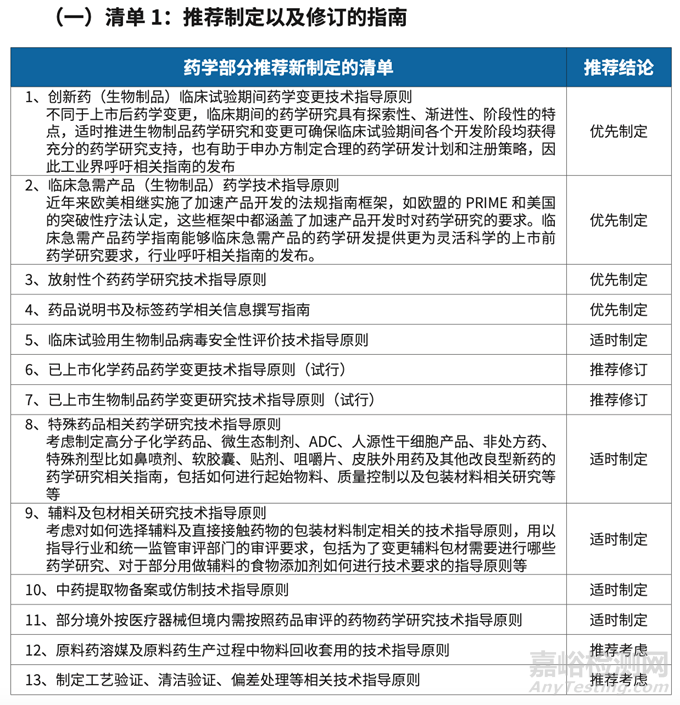
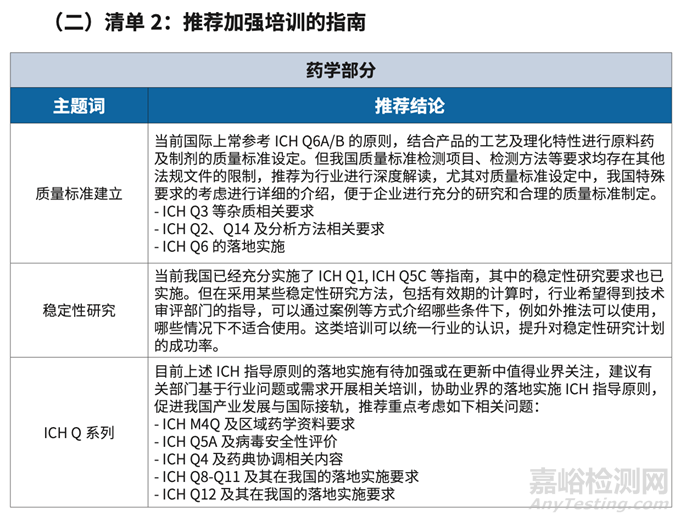
推薦制修訂13個(gè)指南����,加大對9個(gè)藥學(xué)專業(yè)話題的培訓(xùn)。
為了進(jìn)一步補(bǔ)充完善我國指南�,滿足最新技術(shù)發(fā)展的需要���,課題組基于國內(nèi)外指南對比結(jié)果����,及國外新指南制定動(dòng)態(tài)���,開展了兩次行業(yè)調(diào)研�,最終課題組提出共計(jì) 13 個(gè)藥學(xué)專業(yè)的指南制修訂建議�,供藥審中心參考。
在 2022 年 5-6 月開展的第一次問卷調(diào)研和深度訪談中���,課題組共發(fā)現(xiàn) 27 個(gè)藥學(xué)研究存在的行業(yè)痛點(diǎn),結(jié)合藥學(xué)專業(yè)審評部門的建議���,推薦其中 7 個(gè)藥學(xué)專業(yè)的指南進(jìn)行制修訂工作,涉及創(chuàng)新藥臨床試驗(yàn)期間藥學(xué)變更���、臨床急需藥品藥學(xué)指導(dǎo)原則等����。
隨后為了擴(kuò)大本土企業(yè)的訴求,在 2022 年 11 月進(jìn)行的第二次行業(yè)問卷調(diào)研中���,收集到 97 個(gè)國內(nèi)企業(yè)代表反饋的需求(81%�,共收到 119 個(gè)反饋)���,課題組結(jié)合我國企 業(yè)研發(fā)需要,擴(kuò)大推薦新增了 6 個(gè)指南制定的考慮方向。
結(jié)合調(diào)研及深度訪談的結(jié)果����,對部分行業(yè)反饋的問題�,可以通過加強(qiáng)培訓(xùn)的方式,使得行業(yè)對指南中的描述有更充分的理解�,便于行業(yè)的理解。同時(shí)���,高效率的使用審評資源,也減少 審評部門對這類共性問題���,單獨(dú)與企業(yè)解決�,節(jié)省審評資源���。為此,課題組推薦在 9 個(gè)與 ICH 及我國相關(guān)技術(shù)指南相關(guān)的話題���,加強(qiáng)行業(yè)培訓(xùn),包括藥品質(zhì)量標(biāo)準(zhǔn)建立����、穩(wěn)定性研究等�。
需要特別說明的是����,對于部分藥學(xué)專業(yè)問題�,如藥檢、工藝驗(yàn)證等共計(jì)二十項(xiàng)相關(guān)話題����,因?yàn)樯婕翱绮块T協(xié)作或受其他法規(guī)文件限制,不能單純通過建立技術(shù)指導(dǎo)原則予以解決����,推薦單獨(dú)立項(xiàng),逐步解決�。
在未來���,課題組推薦擴(kuò)大研究團(tuán)隊(duì),納入更多的本土代表企業(yè)以推進(jìn)相關(guān)領(lǐng)域的問題收集����、 納入輔料包材企業(yè)或行業(yè)協(xié)會(huì),調(diào)研對歐美日監(jiān)管機(jī)構(gòu)對于輔料和包材的審評技術(shù)要求����,以推薦后續(xù)我國技術(shù)審評部門考慮如何設(shè)計(jì)及推進(jìn)相關(guān)技術(shù)指南的制定及修訂計(jì)劃。
學(xué)習(xí)小結(jié):
1.《創(chuàng)新藥(生物制品)臨床試驗(yàn)期間藥學(xué)變更技術(shù)指導(dǎo)原則》在2023年8月進(jìn)行了第二次征求意見稿�,第一次征求意見稿在2020年9月���。當(dāng)前該指南仍未實(shí)施。
2. 針對臨床急需產(chǎn)品(生物制品)相關(guān)的藥學(xué)技術(shù)���,未見有指導(dǎo)原則發(fā)布�。
3. 針對放射性藥物����,在2023年9月�,藥審中心有發(fā)布《放射性化學(xué)仿制藥藥學(xué)研究技術(shù)指導(dǎo)原則》征求意見稿。
4.在2022年3月���,藥審中心《化學(xué)藥品說明書及標(biāo)簽藥學(xué)相關(guān)信息撰寫指導(dǎo)原則》發(fā)布執(zhí)行。
5.關(guān)于臨床試驗(yàn)用生物制品病毒安全性評價(jià)技術(shù)指導(dǎo)原則的內(nèi)容未見發(fā)布���。
6. 針對《已上市化學(xué)藥品藥學(xué)變更技術(shù)指導(dǎo)原則(試行)》���,當(dāng)前沒有單獨(dú)修訂。但參照了EMA的做法����,發(fā)布了針對該指南的一些補(bǔ)充問答,完善指南�,如在2022年11月發(fā)布了《〈已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)〉溶出曲線研究的問答》�,以及在2023年9月發(fā)布了《〈已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)〉原料藥變更的問答(征求意見稿)》
7.針對2021年6月發(fā)布的《已上市生物制品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》,沒有進(jìn)行修訂����。
8.針對特殊藥品相關(guān)藥學(xué)研究技術(shù)指導(dǎo)原則�,高分子化學(xué)藥品、微生態(tài)制劑�、ADC、人源性干細(xì)胞產(chǎn)品�、非處方藥、 特殊劑型比如鼻噴劑���、軟膠囊���、貼劑�、咀嚼片、皮膚外用藥���,2023年2月發(fā)布了《化學(xué)合成多肽藥物藥學(xué)研究技術(shù)指導(dǎo)原則(試行)》���;ADC有研究的指導(dǎo)原則發(fā)布���,未見藥學(xué)的指導(dǎo)原則����;2021年8月發(fā)布了《人源性干細(xì)胞產(chǎn)品藥學(xué)研究與評價(jià)技術(shù)指導(dǎo)原則(征求意見稿)》����,未見正式執(zhí)行����;2020年8月發(fā)布了《化學(xué)藥品非處方藥上市注冊技術(shù)指導(dǎo)原則(征求意見稿)》,未見正式執(zhí)行;2020年10月發(fā)布了《化學(xué)仿制藥透皮貼劑藥學(xué)研究技術(shù)指導(dǎo)原則(試行)》���;2023年2月發(fā)布了《咀嚼片(化學(xué)藥品)質(zhì)量屬性研究技術(shù)指導(dǎo)原則(試行)》;2021年3月發(fā)布了《皮膚外用化學(xué)仿制藥研究技術(shù)指導(dǎo)原則(試行)》�。
9.針對輔料及包材相關(guān)研究技術(shù)指導(dǎo)原則,在2023年2月���,發(fā)布了《非無菌化學(xué)藥品及原輔料微生物限度研究技術(shù)指導(dǎo)原則(試行)》。
10. 未見有中藥提取物相關(guān)的技術(shù)指導(dǎo)原則;未見有醫(yī)療器械相關(guān)的技術(shù)指導(dǎo)原則;未見有原料藥溶媒及原料藥生產(chǎn)過程中物料回收套用的技術(shù)指導(dǎo)原則;未見有制定工藝驗(yàn)證���、清潔驗(yàn)證����、偏差處理等相關(guān)技術(shù)指導(dǎo)原則�。
11.關(guān)于ICH指南的培訓(xùn)小結(jié):在2022年11月�,藥審中心針對ICH Q3D和M7有線上的專題培訓(xùn),進(jìn)行了Q8-Q12指導(dǎo)原則的培訓(xùn)�;在2023年4月,5月和8月���,分別征求了《Q12:藥品生命周期管理的技術(shù)和監(jiān)管考慮》,《Q13:原料藥和制劑的連續(xù)制造》和M7(R2):評估和控制藥物中DNA反應(yīng)性(致突變)雜質(zhì)以限制潛在致癌風(fēng)險(xiǎn)》指導(dǎo)原則正文、問答及附錄實(shí)施建議和中文版意見���。
參考文獻(xiàn)
1.國內(nèi)外藥品技術(shù)指導(dǎo)原則體系對比研究 (藥學(xué)部分》�,國家藥品監(jiān)督管理局藥品審評中心,中國藥品監(jiān)督管理研究會(huì)���,藥品監(jiān)管研究國際交流專業(yè)委員會(huì)����,中國外商投資企業(yè)協(xié)會(huì)藥品研制和開發(fā)工作委員會(huì)(RDPAC)���,2022年11月