在2022年11月�,由RDPAC 的藥學(xué)團(tuán)隊(duì)對中美歐藥學(xué)技術(shù)指導(dǎo)原則和指南進(jìn)行了調(diào)研與對比��,總結(jié)分析了中美歐指南的標(biāo)準(zhǔn)差異及實(shí)施情況差異����,采用了主題詞及分類方式�、深度對比�、報(bào)告撰寫和定稿流程,最后呈現(xiàn)研究報(bào)告����,給到藥審中心參考。
課題組對我國已有的藥學(xué)技術(shù)指導(dǎo)原則(以下簡稱指南)�,F(xiàn)DA 和 EMA 官網(wǎng)上公布的藥學(xué)部分指南進(jìn)行梳理,共對 75 個(gè)中國的藥學(xué)技術(shù)指導(dǎo)原則�、187 個(gè) FDA 指導(dǎo)原則和 76 個(gè) EMA 指導(dǎo)原則進(jìn)行比對,并對歐美有�,我國是否有進(jìn)行分類。具體數(shù)量如表格 1 所示�。
總體特點(diǎn):
通過對指南中的關(guān)鍵詞來對比各國指導(dǎo)原則后,課題組發(fā)現(xiàn)我國的藥學(xué)部分的一個(gè)指南中常常參考或引用了其他多個(gè)國家或多個(gè)指導(dǎo)原則����,雖然數(shù)量上差距較大,但內(nèi)容上有重疊��;而歐美的指南相對比較細(xì)化��,也是專題討論為主����,數(shù)量就會比較多��。
為此��,很難簡單的通過對比指南的數(shù)量來判斷我國的藥學(xué)部分指南是否存在差異��,更適合以問題為導(dǎo)向����,采用指導(dǎo)原則的制定及引導(dǎo)來解決問題��。
課題組在 2022 年 6 月發(fā)起了第一次行業(yè)調(diào)研�,共收集 12 家行業(yè)代表企業(yè)的反饋,這些企業(yè)均有境外及境內(nèi)業(yè)務(wù)����,涉及 86 項(xiàng)相關(guān)行業(yè)問題,41 個(gè)需要通過新制定相關(guān)文件來解決�,76 個(gè)與目前已有的部分指導(dǎo)原則相關(guān),還有部分與目前的指導(dǎo)原則是否仍舊有效相關(guān)����。基于這些問題,課題組開展了深度訪談����,了解其背后的原因����,以及國際上管理模式的差別?;诒敬握{(diào)研,課題組與 2022 年 10 月與藥審中心藥學(xué)專業(yè)部門開展溝通交流����,反饋推薦制定指南的清單及推薦理由。
結(jié)合藥學(xué)專業(yè)部門建議��,以收集本土企業(yè)的研發(fā)問題為目標(biāo)�,課題組在 2022 年 11 月通過問卷調(diào)研進(jìn)行了問題收集。本次調(diào)研共有 119 個(gè)產(chǎn)業(yè)代表提供反饋��,其中國內(nèi)企業(yè)代表 97 位�, 占比 81%,可反映我國制藥企業(yè)的核心訴求����。基于如上兩次調(diào)研的結(jié)果,課題組推薦藥學(xué)相關(guān)推薦制定��、修訂的指南清單��。
對比結(jié)論
我國已形成初具規(guī)模的藥學(xué)指導(dǎo)原則體系��。
我國藥學(xué)研究發(fā)展歷史較長��,近年來工業(yè)現(xiàn)代化進(jìn)程明顯�,同時(shí)中國創(chuàng)新藥研發(fā)以及跨國同步申報(bào)情況增多,藥學(xué)研究基礎(chǔ)日漸成熟����。
在 NMPA 加入 ICH 之前,我國就開展了藥學(xué)相關(guān)技術(shù)指導(dǎo)原則(以下簡稱指南)的制定工作�, 加入 ICH 之后,伴隨 ICH 各項(xiàng)藥學(xué)相關(guān)指導(dǎo)原則的實(shí)施��,以及近期藥審中心連續(xù)發(fā)布的系列藥學(xué)相關(guān)技術(shù)指導(dǎo)原則�,從整體上構(gòu)建了創(chuàng)新藥藥學(xué)研究指南體系。這一體系包括創(chuàng)新藥原料藥�、制劑研究指南,熱點(diǎn)領(lǐng)域(如細(xì)胞基因治療等)的藥學(xué)研究指南��,臨床期間藥學(xué)變更及上 市后藥學(xué)變更指南�,仿制藥及生物類似藥藥學(xué)指南等等����,與 EMA 及 FDA 的技術(shù)要求相似�,為行業(yè)研發(fā)提供了重要的參考依據(jù)。
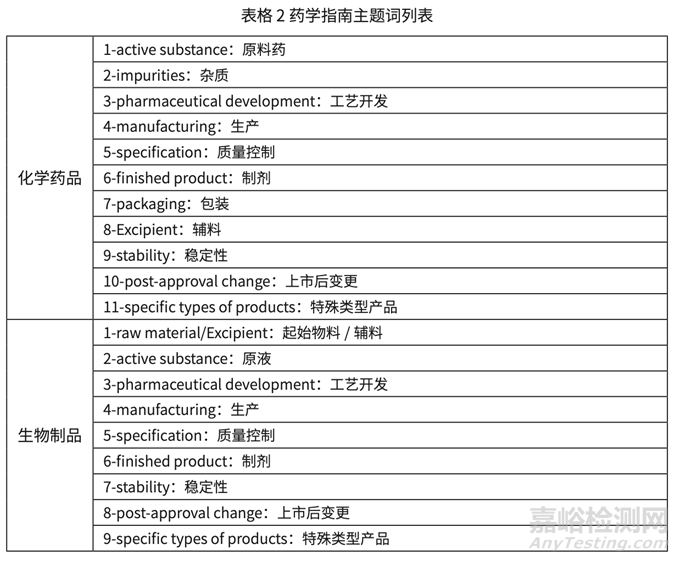
課題組對我國已有的藥學(xué)技術(shù)指導(dǎo)原則(以下簡稱指南)����,F(xiàn)DA 和 EMA 官網(wǎng)上公布的藥 學(xué)部分指南進(jìn)行梳理����。目前我國藥學(xué)指南尚未分類,課題組部分的參考了 EMA 的分類方法�, 結(jié)合當(dāng)前研發(fā)實(shí)踐的需要,推薦按照如下的主題詞對我國藥學(xué)指南進(jìn)行分類����,以方便行業(yè)查找和學(xué)習(xí),具體結(jié)果如下表格 2 所示�。
特別說明
1�、各個(gè)國家制定技術(shù)指導(dǎo)原則的前提均有所不同��,需要基于管理模式�、行業(yè)相狀��、教育水平等等綜合考慮�。而 2022 年 11 月的調(diào)研以收集國內(nèi)研發(fā)問題為目的��,這些問題不一定與境內(nèi)外的技術(shù)指導(dǎo)原則存在差異相關(guān)�,所推薦的指南未必與境外指南存在差異�,或境外有類似指南可以作為制定的參考�。
2��、藥學(xué)專業(yè)要求及管理模式上,我國與歐盟����、美國存在不同�。例如歐盟以上市持有人及質(zhì)量負(fù)責(zé)人(QP)制度為基礎(chǔ)����,通過主體責(zé)任深度落實(shí)的管理手段,弱化了藥品檢驗(yàn)相關(guān)的要求; 美國以核查管理為支持��,通過加強(qiáng)現(xiàn)場檢查的管理手段��,放寬了對部分工藝驗(yàn)證性研究結(jié)果遞交時(shí)限等此類要求,但在包括跨境現(xiàn)場檢查時(shí)對其研究結(jié)果進(jìn)行確認(rèn)�;此外�,基于各國工業(yè)界 的現(xiàn)狀����,藥典檢測項(xiàng)目的方法學(xué)和限度要求也存在差異����。為此,當(dāng)前我國行業(yè)對藥學(xué)研究部分反饋的某些問題��,包括檢驗(yàn)�、工藝驗(yàn)證及藥典協(xié)調(diào)等問題��,無法通過技術(shù)指導(dǎo)原則的統(tǒng)一進(jìn)行解決�。
3��、課題組也對加入 ICH 前��,我國制定的藥學(xué)部分指南進(jìn)行了梳理��,推薦對部分指南進(jìn)行明文廢止,或者中心對不再適用的指導(dǎo)原則��,明確新老版本��,并對社會明確以最新版本為準(zhǔn)。
4�、在未來����,課題組推薦擴(kuò)大研究團(tuán)隊(duì)��,納入更多的本土代表企業(yè)以推進(jìn)相關(guān)領(lǐng)域的問題收集、納入輔料包材企業(yè)或行業(yè)協(xié)會�,調(diào)研對歐美日監(jiān)管機(jī)構(gòu)對于輔料和包材的審評技術(shù)要求, 以推薦后續(xù)我國技術(shù)審評部門考慮如何設(shè)計(jì)及推進(jìn)相關(guān)技術(shù)指南的制定及修訂計(jì)劃����。
學(xué)習(xí)小結(jié):
1. 國內(nèi)的藥學(xué)指南主題數(shù)量目前有限��,還處在上升發(fā)展階段��,相對于美國和歐盟��,還不夠成熟,我國加入ICH時(shí)間相對不長��。歐美藥學(xué)指南體系發(fā)展是在ICH指南之前已經(jīng)有很長一段時(shí)間了。
2. 國內(nèi)藥學(xué)指南的主題不夠?qū)W?,一篇指南常會包含多個(gè)歐美指南的內(nèi)容����。
3. 創(chuàng)新藥和熱點(diǎn)領(lǐng)域的指南相對于仿制藥更稀缺�,這方面的發(fā)展?jié)摿艽?�,ICH指南的采納實(shí)施會越來越多��。
4.國內(nèi)藥學(xué)的監(jiān)管與歐美有差異有相同點(diǎn):美國強(qiáng)調(diào)現(xiàn)場的檢查,歐盟強(qiáng)調(diào)MAH和QP制度����,國內(nèi)三位一體��,審評�,檢驗(yàn)和核查��。
5.國內(nèi)對于輔包的技術(shù)審評指南還較少�,有較大的提升空間��。
6. 參考EMA的指南分類方式��,調(diào)研以主題詞為線索,11個(gè)化學(xué)主題詞和9個(gè)生物制品主題詞��,逐步展開�。國內(nèi)以主題詞分類指南的體系暫未建立
參考文獻(xiàn)
1.國內(nèi)外藥品技術(shù)指導(dǎo)原則體系對比研究 (藥學(xué)部分》�,國家藥品監(jiān)督管理局藥品審評中心,中國藥品監(jiān)督管理研究會�,藥品監(jiān)管研究國際交流專業(yè)委員會��,中國外商投資企業(yè)協(xié)會藥品研制和開發(fā)工作委員會(RDPAC),2022年11月