近年來寡核苷酸藥物成為新藥研發(fā)中備受關(guān)注的分子類型,被認(rèn)為是繼小分子化藥���、抗體藥物之后的第三代治療藥物���。寡核苷酸是指含有約20個堿基的短鏈核苷酸,通過以Watson-Crick堿基互補配對的原理與mRNA互補鏈結(jié)合�����,作用于轉(zhuǎn)錄和翻譯�����。根據(jù)結(jié)構(gòu)和作用機理不同���,分為反義寡核苷酸(ASO)、小干擾RNA(siRNA)����、小激活RNA(saRNA)�����、微小RNA (miRNA)��、適配體(Aptamer)等�。
由于siRNA藥物療效較好且技術(shù)取得突破����,這使得它成為目前最受關(guān)注的核酸藥物之一。siRNA是一類雙鏈RNA分子(反義鏈、正義鏈)����,通過與體內(nèi)相關(guān)酶形成RNA誘導(dǎo)沉默復(fù)合物(RNA-induced silencing complex, RISC)來降解目標(biāo)mRNA,以此來下調(diào)或抑制目標(biāo)基因的表達(dá)。2024年伊始�����,siRNA藥物領(lǐng)域的合作捷報頻傳:1月3日�����,勃林格殷格翰宣布與蘇州瑞博及其瑞典子公司Ribocure達(dá)成合作協(xié)議,共同開發(fā)治療非酒精性或代謝功能障礙相關(guān)脂肪性肝炎的小核酸創(chuàng)新療法���。1月7日����,舶望制藥宣布與諾華就RNAi療法達(dá)成兩項獨家許可合作協(xié)議�����。
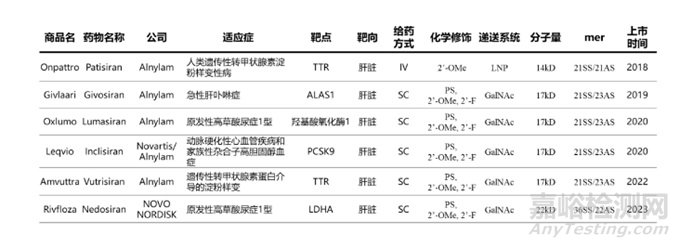
截至目前����,F(xiàn)DA共批準(zhǔn)6款siRNA上市藥物。值得一提的是�����,其中有4款來自Alnylam���,1款來自Alnylam與諾華共同開發(fā)����,1款來自諾和諾德�����,治療領(lǐng)域主要為內(nèi)分泌與代謝��、神經(jīng)���、泌尿、心血管系統(tǒng)��。6款藥物均靶向肝臟�����,并進行了化學(xué)修飾�。除了Onpattro遞送方式為LNP(脂質(zhì)納米粒)�����,并且給藥方式為靜脈輸注外,其它藥物的遞送系統(tǒng)均為GalNAc���,給藥方式均為皮下注射��,詳見表1�。
表1六款siRNA上市藥物(截止2024.1)
由于siRNA自身的物理化學(xué)特性,未經(jīng)修飾的siRNA給藥后不僅會很快被機體清除,同時還有脫靶毒性的風(fēng)險�。因此����,需要同時借助化學(xué)修飾和合適的遞送系統(tǒng)來達(dá)到治療目的���。已上市的6款siRNA藥物均使用了化學(xué)修飾和遞送系統(tǒng)���。第一代化學(xué)修飾是對磷酸骨架的修飾���,如硫代磷酸酯(PS)��。第二代化學(xué)修飾是核糖修飾����,其中2-O-甲基(2-OMe)���、2-O-甲氧基-乙基(2-MOE)和2-氟(2-F)修飾是最常用的類型�。第三代化學(xué)修飾為核糖五元環(huán)改造。經(jīng)過化學(xué)修飾后��,共同的特點是增加了siRNA的穩(wěn)定性����,但同時也存在一些缺點�����,如經(jīng)PS修飾后降低與靶基因結(jié)合的親和力�����,與某些蛋白的非特異性相互作用可能引起細(xì)胞毒性�����。
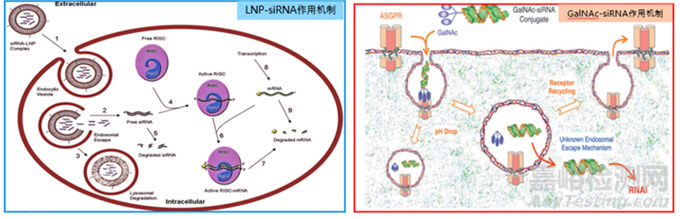
單純通過化學(xué)修飾還是很難使siRNA到達(dá)靶部位。因此���,遞送系統(tǒng)是寡核苷酸藥物研發(fā)中成功的關(guān)鍵因素,也是藥物研發(fā)公司的技術(shù)護城河�。目前已上市的6款siRNA藥物�,只有Patisiran遞送系統(tǒng)是LNP(圖1左)�,其余的遞送系統(tǒng)均為GalNAc(圖1右)��。LNP主要由4部分組成:可電離脂質(zhì)、膽固醇���、輔助磷脂、PEG-脂質(zhì)��。其中,可電離脂質(zhì)是最關(guān)鍵的輔料��,它在不同的pH條件下表現(xiàn)出不同的帶電特征�,酸性pH值條件下帶正電荷����,而在生理pH條件下基本呈中性�����,可離子化特性為siRNA跨越生物屏障提供了智能化的保護�����。5款GalNAc-siRNA偶聯(lián)物均使用L96作為載體����,該結(jié)構(gòu)由三部分組成�����,包括三觸GalNAc靶頭�����、連接臂以及siRNA分子�。GalNAc以三價態(tài)的方式共價偶聯(lián)至核酸3’末端,形成GalNAc-siRNA偶聯(lián)物��。GalNAc是去唾液酸糖蛋白受體(ASGPR)的配體,ASGPR在肝細(xì)胞的膜表面高度特異性表達(dá)�����。GalNAc-siRNA偶聯(lián)物通過特異性結(jié)合ASGPR��,在內(nèi)吞作用下將siRNA從細(xì)胞表面轉(zhuǎn)運至細(xì)胞中���。隨后GalNAc-siRNA偶聯(lián)物與ASPGR分離�����,ASPRGR回到細(xì)胞表面���,而GalNAc-siRNA偶聯(lián)物進一步解離,釋放出的游離siRNA在細(xì)胞質(zhì)中沉默基因以發(fā)揮藥效�����。
圖1 遞送系統(tǒng)LNP, GalNAc及作用機制
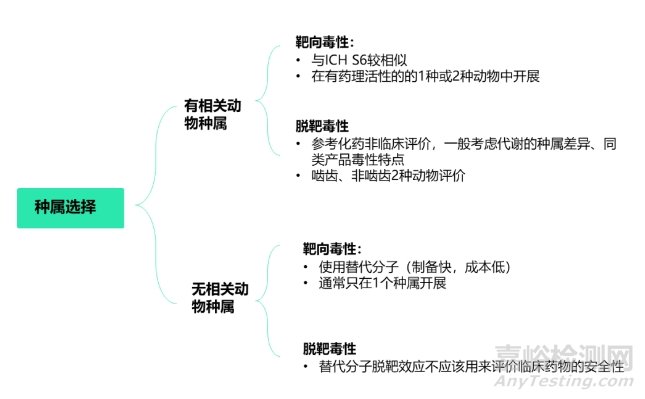
siRNA藥物化學(xué)合成藥物����,雖具備生物制品屬性,但按新化學(xué)實體監(jiān)管。所以不僅在科學(xué)認(rèn)知上存在一些缺口��,也存在一些監(jiān)管指南空缺�����。目前中國尚無相關(guān)指導(dǎo)原則�����。除了ICH系列指導(dǎo)原則外(ICH S6/M3/S7/S2/S8),日本PMDA 2020年發(fā)布了《寡核苷酸治療產(chǎn)品非臨床安全性評價指導(dǎo)原則》可供參考�����;FDA也發(fā)布了用于工業(yè)界的相關(guān)指導(dǎo)原則�,如《寡核苷酸治療藥物開發(fā)的臨床藥理學(xué)考慮》等���。根據(jù)日本PMDA發(fā)布的《寡核苷酸治療產(chǎn)品非臨床安全性評價》指導(dǎo)原則�,siRNA藥物需要2個種屬進行臨床前安全性評價�����,嚙齒類為大鼠或者小鼠����,非嚙齒類一般為食蟹猴�。目前已上市的6款siRNA�,非嚙齒類均是食蟹猴,嚙齒類分別為大鼠(5款)���、小鼠(Nedosiran)��。非嚙齒動物選擇猴的主要原因如下:猴和人的目標(biāo)mRNA具有高度或完全同源性����,而且猴種屬可以更好地評估siRNA放大的藥理學(xué)效應(yīng)��,比如Inclisiran核苷酸序列與人和猴PCSK9中的類似序列完全同源�,且用猴開展藥效。siRNA藥物臨床前評價動物種屬選擇見圖2���。
圖2 siRNA藥物臨床前評價動物種屬選擇
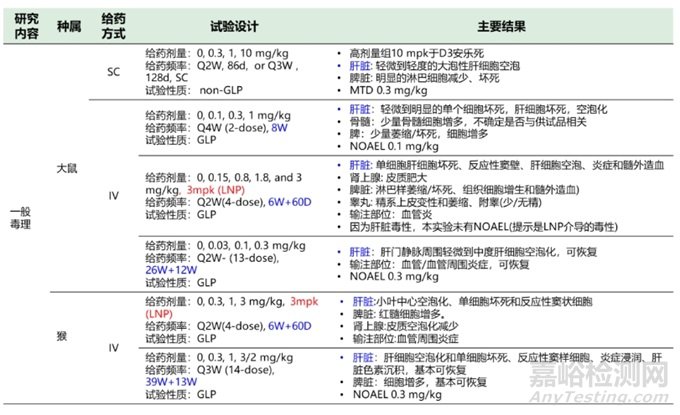
根據(jù)已上市的6款siRNA藥物申報資料�����,臨床前開展的安全性評價試驗總結(jié)如表2��。
表2六款siRNA藥物臨床前安評試驗總結(jié)
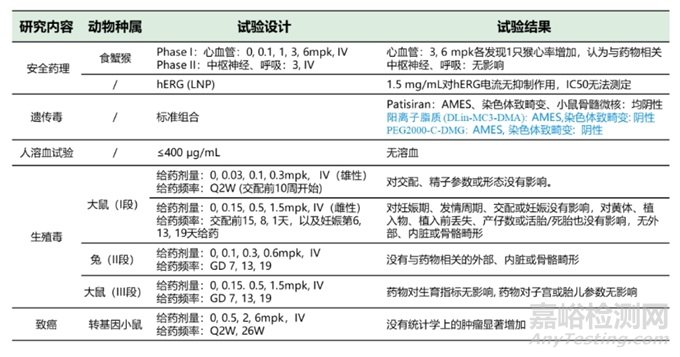
考慮到已上市的6款siRNA藥物臨床前毒理數(shù)據(jù)較多����,僅以遞送系統(tǒng)為LNP的藥物Patisiran,遞送系統(tǒng)為GalNAc的藥物Inclisiran為代表�����,分析臨床前安評結(jié)果����。Patisiran是Alnylam研發(fā)�����,于2018.8 FDA批準(zhǔn)上市的首款siRNA藥物�。適應(yīng)癥為遺傳性轉(zhuǎn)甲狀腺素蛋白淀粉樣變性(hATTR)引起的周圍神經(jīng)病變疾病,靶點TTR(轉(zhuǎn)甲狀腺素蛋白)基因��。臨床給藥為靜脈滴注��,3周一次, 0.3 mg/kg���。遞送載體為LNP��。作用機制是通過RNA干擾引起突變型和野生型TTR mRNA的降解�����,從而導(dǎo)致血清TTR蛋白和組織中TTR蛋白沉積的減少��,達(dá)到治療疾病的目的�����。Patisiran臨床前安評結(jié)果如表3��。
表3 Patisiran臨床前安評總結(jié)(備注:如26W+12W表示26周給藥��,伴隨12周恢復(fù)期)
表3 Patisiran臨床前安評總結(jié)(續(xù))
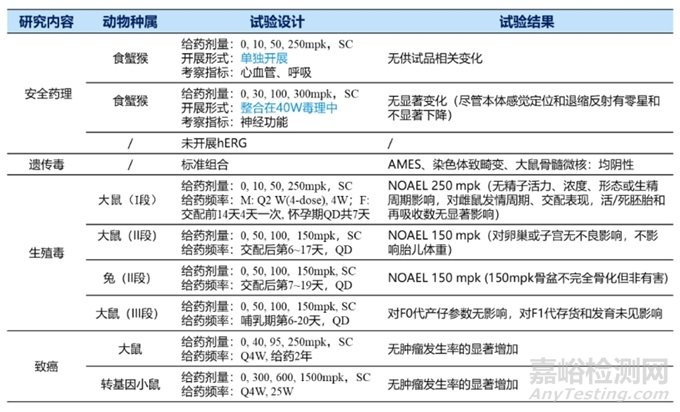
Inclisiran研發(fā)公司Novartis/Alnylam����,于2020.12歐盟首次獲批,全球首個siRNA降膽固醇療法藥物���,適應(yīng)癥原發(fā)性高膽固醇血癥或混合性血脂異常�,靶點PCSK9��。臨床給藥途徑為皮下注射��,第0�����、3個月各給藥一次后,維持期6個月一次�,一年只需2次。遞送系統(tǒng)為GaINAc�,作用機制是與編碼PCSK9蛋白的mRNA結(jié)合,通過RNA的干擾作用來防止肝臟生成PCSK9蛋白�,從而達(dá)到降低血脂的目的。Inclisiran臨床前安評結(jié)果總結(jié)如表4��。
表4 Inclisiran臨床前安評總結(jié)
表4 Inclisiran臨床前安評總結(jié)(續(xù))
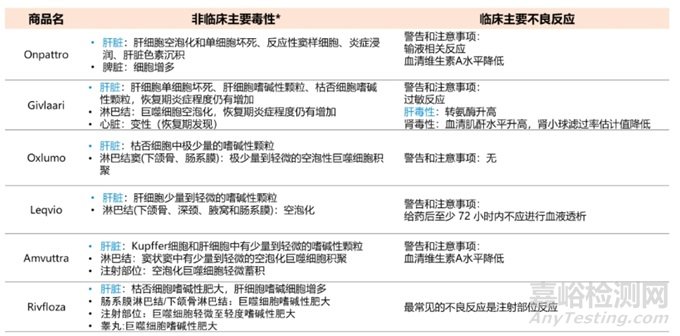
為了探究已上市的6款siRNA非臨床毒性和臨床主要不良反應(yīng)是否有關(guān)聯(lián)性���,通過整理支持NDA的NHP長毒試驗毒性結(jié)果,以及臨床警告和注意事項�����,得出非臨床和臨床關(guān)聯(lián)性較強的是肝臟毒性�,需要關(guān)注血生化一些指標(biāo)變化����,如ALT, AST,可在臨床階段進行密切監(jiān)控�����。具體情況見表5。
表5 六款siRNA藥物非臨床和臨床毒性關(guān)聯(lián)性分析(*:數(shù)據(jù)來源于支持NDA的NHP長毒試驗)
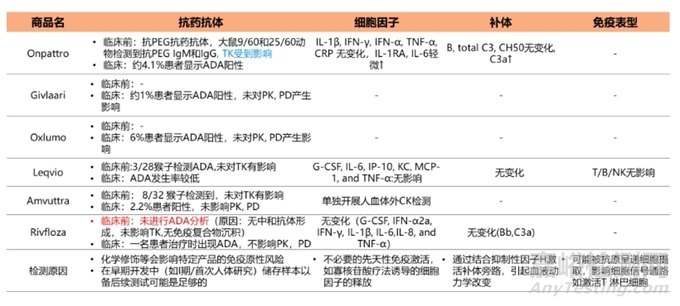
因為siRNA藥物具備大分子藥物屬性��,所以也需要進行免疫毒性考察��。對已上市的6款siRNA藥物免疫毒性進行總結(jié)�����,如抗藥抗體(ADA)��、細(xì)胞因子(CKs)����、補體、免疫表型(IPT)���。具體結(jié)果見表6��。
表6六款上市siRNA藥物免疫毒性總結(jié)(“-”表示未披露)
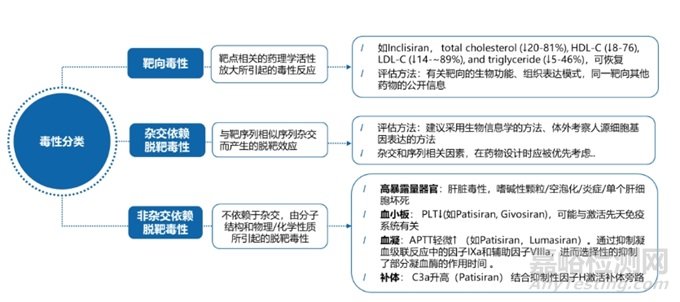
理論上講����,若siRNA和靶mRNA準(zhǔn)確地結(jié)合在一起��,則可成功的沉默靶基因。然而����,許多siRNA都存在脫靶��,并且大多數(shù)siRNA分子可能并不具有靶向性����。siRNA的引入可導(dǎo)致脫靶效應(yīng),即抑制目標(biāo)基因以外的其他基因�,導(dǎo)致非靶基因表達(dá)突變的意外后果。根據(jù)日本藥品醫(yī)療器械管理局(PMDA)發(fā)布的《寡核苷酸治療產(chǎn)品非臨床安全性評價指導(dǎo)原則》���,寡核苷酸的毒性分析分為靶向毒性�、脫靶毒性�,詳細(xì)見圖3����。
圖3 siRNA藥物毒性分類
肝臟是siRNA藥物最關(guān)注的器官�����。關(guān)于肝臟毒性,通過總結(jié)已上市的6款siRNA藥物����,將從藥物特點、藥代��、病理進行綜合性分析����。藥物特點方面,6款siRNA藥物靶點均與肝臟相關(guān)�,在肝臟中合成或表達(dá);均進行了化學(xué)修飾�����,如經(jīng)硫代磷酸脂修飾后可能導(dǎo)致高蛋白結(jié)合的肝毒性����;遞送系統(tǒng)無論是LNP或GalNAc均有肝靶向性�����。目前LNP-siRNA藥物Patisiran靜脈給藥后80%~90%的LNP會進入肝臟���,最終被肝細(xì)胞吸收��;GalNAc-siRNA經(jīng)ASGPR介導(dǎo)發(fā)生細(xì)胞內(nèi)吞而進入靶組織����,ASGPR在肝細(xì)胞上大量表達(dá)���。藥代方面�,組織分布結(jié)果均顯示肝臟濃度最高���,如Lumasiran猴10mg/kg時�����,AUC高達(dá)76700h*μg/mL,且消除半衰期長��,高達(dá)409h�����。用于支持NDA的猴長毒試驗中,組織病理均發(fā)現(xiàn)肝臟變化�����,從輕到重依次是:(1)肝細(xì)胞/枯否細(xì)胞嗜堿性顆粒:可能為供試品或其代謝產(chǎn)物��,也可能是細(xì)胞攝取寡核苷酸的適應(yīng)性改變�����;(2)肝細(xì)胞空泡化:可能為繼發(fā)于胞漿內(nèi)嗜堿性顆粒蓄積的改變��;(3)炎癥浸潤:高濃度藥物分布時�,會激活促炎性通路(4)肝細(xì)胞單細(xì)胞壞死:高劑量下嗜堿性顆粒大量蓄積時可觀察到病理損傷。此外���,大部分藥物還伴隨血生化臨檢指標(biāo)變化����,如ALT, AST升高���。組織的病變是否為有害變化,要根據(jù)組織本身的損傷�����,相關(guān)指標(biāo)的變化,可恢復(fù)情況�����,以及其它的siRNA藥物是否有類似改變等綜合判斷���。
除了肝毒性����,序列相關(guān)引起的脫靶毒性還有免疫刺激反應(yīng)����,其毒性在很大程度上取決于核苷酸序列設(shè)計和化學(xué)修飾�����。siRNA藥物通過激活先天免疫系統(tǒng)��,導(dǎo)致注射部位反應(yīng)(如Patisiran��,Inclisiran)����、血小板(PLT)減少(如Patisiran, Givosiran)�����。免疫刺激評估��,除了體內(nèi)試驗相關(guān)指標(biāo)的檢測����,也可在體外用分離的外周血單核細(xì)胞或全血測定預(yù)測細(xì)胞因子釋放來評估�����。
非雜交相關(guān)的脫靶毒性���,如凝血功能改變�����,siRNA藥物通過抑制凝血級聯(lián)反應(yīng)中的因子IXa和輔助因子VIIIa����,進而選擇性的抑制了部分凝血酶的作用時間,從而以一種與雜交和序列無關(guān)的方式抑制凝血(如Patisiran���,Lumasiran APTT輕微升高)���。此外,siRNA藥物還可以結(jié)合抑制性因子H激活補體旁路�,補體過度激活可使補體功能改變,引發(fā)繼發(fā)性炎癥和血管炎等(如Patisiran C3a升高���,發(fā)現(xiàn)肝臟炎癥浸潤����、輸注部位血管周圍炎癥)�。
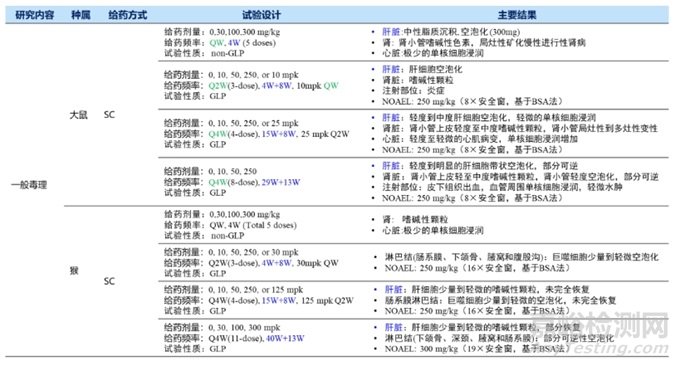
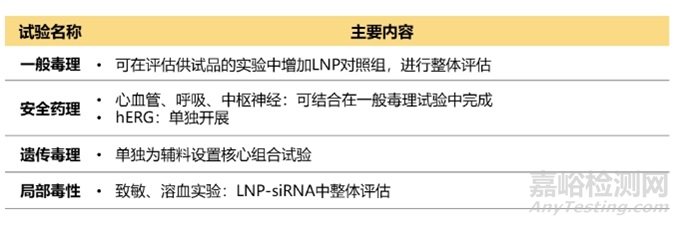
除了關(guān)注siRNA藥物本身外,還要關(guān)注遞送系統(tǒng)毒性�,如LNP���。LNP含有新的輔料����,或成分比例發(fā)生了改變����,需要對LNP進行考察���。雖然沒有專門針對LNP的指導(dǎo)原則,但可以參考相關(guān)指導(dǎo)原則���,如《新藥用輔料非臨床安全性評價指導(dǎo)原則》、《納米藥物非臨床安全性研究技術(shù)指導(dǎo)原則》�、《Guidance for Industry : Liposome Drug Products Chemistry, Manufacturing, and Controls; Human Pharmacokinetics and Bioavailability; and Labeling Documentation》等。此外��,還可以參考Patisiran關(guān)于LNP的考察���。若LNP是按非單獨輔料注冊標(biāo)準(zhǔn)申報,且考慮到siRNA需要兩種動物種屬�,可按與非臨床安全性評價中相同的動物種屬伴隨或單獨考察LNP。IND申報LNP需要開展的毒理試驗推薦見表7���。
表7 LNP毒理IND評價(非單獨輔料注冊標(biāo)準(zhǔn))
據(jù)報道�����,siRNA藥物發(fā)展方向依然主要集中在遞送系統(tǒng)��、修飾、脫靶效應(yīng)�����、適應(yīng)癥拓展方向�����,且相輔相成����。比如在遞送系統(tǒng)方面,Alnylam開發(fā)了一種連接到siRNA的短脂質(zhì)鏈——C16偶聯(lián)物�,使其能被多種類型細(xì)胞吸收(CNS,肺��,眼等)����,從而拓展了siRNA類藥物適應(yīng)癥;新的遞送平臺GalAhead™和PDoV-GalNAc提供了更高的遞送效率����。在修飾方面���,例如增強穩(wěn)定性化學(xué)(ESC)����,很多在研項目已經(jīng)開始使用了��。關(guān)于脫靶應(yīng)在藥物設(shè)計時就考慮�����,而不是通過毒理評估��。如Alnylam公司對siRNA脫靶預(yù)測����,淘汰不符合要求的siRNA序列�����。
2018年�����,第一款siRNA藥物Onpattro的批準(zhǔn)上市對siRNA藥物領(lǐng)域產(chǎn)生了重大影響����,標(biāo)志著諾貝爾獎成果已從理論概念轉(zhuǎn)變?yōu)閷嶋H治療用途,這是一個引人注目的里程碑���。截至2024年1月��,已有6款siRNA藥物上市��。通過對這6款已上市siRNA藥物臨床前安評總結(jié)分析�����,可以為此類藥物臨床前毒理設(shè)計提供參考。相信將來會有更多的siRNA藥物上市�,而相關(guān)的臨床前指導(dǎo)原則也將隨之逐漸完善和發(fā)布。
【參考文獻(xiàn)】
寡核苷酸治療產(chǎn)品非臨床安全性評價指導(dǎo)原則,日本藥品和醫(yī)療器械管理局(PMDA),2020.03
王恒,李華,汪溪潔,等. 小核酸藥物非臨床特點和藥理毒理評價策略[J]. 中國新藥雜志,2022,31(12):1137-1145. DOI:10.3969/j.issn.1003-3734.2022.12.001
余珊珊��、胡曉敏����、王海學(xué)等. 治療用單鏈寡核苷酸藥物的非臨床研究評價概述. 中國新藥雜志, 2018, 27(10): 1122-1129.
周宇,王士奇,孫濤, 等. 日本藥品和醫(yī)療器械管理局《寡核苷酸治療產(chǎn)品非臨床安全性評價指導(dǎo)原則》指南介紹. 中國臨床藥理學(xué)雜志, 2022, 38(22): 2788-2792
Clinical Pharmacology Considerations for the Development of Oligonucleotide Therapeutics Guidance for Industry, FDA, 2022.06
Agrawal, S. & Kandimalla, E. Role of Toll-like receptors in antisense and siRNA [corrected]. Nature biotechnology 22, 1533-1537, (2004).
Henry, S. et al. Activation of the alternative pathway of complement by a phosphorothioate oligonucleotide: potential mechanism of action. The Journal of pharmacology and experimental therapeutics 281, 810-816 (1997).
Sheehan, J. & Phan, T. Phosphorothioate oligonucleotides inhibit the intrinsic tenase complex by an allosteric mechanism. Biochemistry, 40(16), (2001).
Andersson, P. Preclinical Safety Assessment of Therapeutic Oligonucleotides. Methods in molecular biology (Clifton, N.J.) 2434, 355-370, (2022).