今日頭條
恒瑞MOR靶向鎮(zhèn)痛藥獲批上市��。恒瑞醫(yī)藥1類新藥富馬酸泰吉利定注射液(SHR8554)獲國家藥監(jiān)局批準上市,適用于腹部手術后中重度疼痛����。SHR8554可激活μ阿片受體(MOR)�����,選擇性地激活G蛋白偶聯(lián)通路��,具有中樞鎮(zhèn)痛效果的同時,可減輕胃腸道不良反應和減少呼吸抑制不良反應的發(fā)生率����。今年1月,CDE已受理該新藥提交的“骨科手術后鎮(zhèn)痛”新適應癥上市申請����。
國內藥訊
1.和黃「呋喹替尼」獲批香港上市����。和黃醫(yī)藥VEGFR抑制劑呋喹替尼(fruquintinib)獲香港監(jiān)管部門批準上市��,用于治療既往接受過氟尿嘧啶類����、奧沙利鉑和伊立替康為基礎的化療,以及既往接受過或不適合接受抗VEGF治療��、抗EGFR治療(RAS野生型)的轉移性結直腸癌患者�����。在國際III期試驗 (MRCT) FRESCO-2研究中�����,與安慰劑相比,呋喹替尼治療組的mOS延長2.6個月����,mPFS延長1.9個月。
2.科笛引進非那雄胺噴霧劑報產��。科笛集團從Polichem公司引進的外用非那雄胺噴霧劑CU-40102的新藥上市申請(NDA)獲CDE受理,用于治療雄激素性脫發(fā)����。與口服非那雄胺不同��,CU-40102可直接精確地涂抹在頭皮表面,保持用藥部位高濃度并減少藥物全身暴露。在Ⅲ期臨床中��,CU-40102治療組24周時患者的頂部禿發(fā)目標區(qū)域內的總毛發(fā)計數(shù)及終毛計數(shù)的統(tǒng)計較安慰劑顯著改善。
3.輝瑞CD3/BCMA雙抗中國報產。輝瑞CD3/BCMA雙抗Elranatamab(Elrexfio,PF-06863135)的上市申請獲CDE受理����,用于治療復發(fā)或難治性多發(fā)性骨髓瘤(R/R MM)����。在II期研究MagnetisMM-3(NCT04649359)研究中�����,elranatamab在既往至少接受過四種治療的患者中達到61%的客觀緩解率以及56.1%的非常好的部分緩解率��。去年8月����,該產品已獲FDA加速批準上市,成為第二款在美獲批的CD3/BCMA雙抗����。
4.馴鹿BCMA靶向CAR-T見刊PNAS。馴鹿生物靶向BCMA的CAR-T產品伊基奧侖賽注射液(CT103A)在研究者發(fā)起的一項針對免疫介導壞死性肌?����。↖MNM)的探索性研究(NCT04561557)中獲積極結果�����。CT103A回輸18個月后,患者徒手肌力檢查(MMT-8)評分從基線的96分����,改善至137分��;血清肌酸激酶水平從4778 IU/L降至260 IU/L,肌紅蛋白水平從837 ng/mL降至66.2 ng/mL��;臨床中未發(fā)現(xiàn)新的安全性風險����。詳細結果發(fā)表在《美國國家科學院院刊》(PNAS)上。
5.榮昌預計2023年營收10.8億元��。榮昌生物發(fā)布2023年年度業(yè)績預告����,預計2023年度營業(yè)收入約108,000萬元��,較上年同期將增加收入約31,000萬元,同比增加約40%;預計實現(xiàn)歸屬于母公司所有者的凈虧損約155,000萬元�����,較上年同期將增加虧損約55,200萬元��,同比虧損增加約55%;預計歸屬于母公司所有者扣除非經常性損益后的凈虧損約158,000萬元��,較上年同期將增加虧損約46,400 萬元�����,同比虧損增加約42%����。
6.中國生物制藥南方總部開業(yè)運營��。1月31日����,中國生物制藥南方總部在廣州國際生物島正式開業(yè)����。南方總部目前已引入包括治療非酒精性脂肪性肝炎的拉尼蘭諾、軟霧吸入藥械平臺Softhale和新一代腫瘤免疫療法等海外臨床項目�����。未來��,中國生物制藥將通過南方總部和海外子公司invoX��,引進全球領先的藥品管線,并在廣州實現(xiàn)臨床轉化和產業(yè)化��。
國際藥訊
1.BMS靶向CD19自體CAR-T報兩項sBLA�����。FDA受理百時美施貴寶CD19靶向CAR-T療法Breyanzi(Liso-cel)兩項補充生物制品許可申請(sBLA)����,用于治療復發(fā)或難治性濾泡性淋巴瘤(FL)和套細胞淋巴瘤(MCL)經治患者�����。FDA同時授予它們優(yōu)先審評資格,PDUFA日期分別為今年5月23日和5月31日��。在臨床試驗中��,Breyanzi在復發(fā)/難治性FL患者中達到97%(p<0.0001)總緩解率(ORR);在MCL患者達到86.5%的ORR��。
2.強生CD38單抗皮下注射制劑報新適應癥��。強生CD38抗體皮下注射制劑Darzalex Faspro(daratumumab)已向FDA提交補充生物制品許可申請(sBLA)�����,聯(lián)合硼替佐米、來那度胺和地塞米松(D-VRd)用于適合接受自體干細胞移植(ASCT)的新診斷多發(fā)性骨髓瘤成人患者的誘導和鞏固治療,以及之后聯(lián)合來那度胺(D-R)用于維持治療����。在III期PERSEUS研究中,47.5個月隨訪數(shù)據(jù)顯示����,daratumumab聯(lián)合方案使疾病進展風險降低58%�����。
3.NaV1.8抑制劑兩項止痛Ⅲ期臨床積極����。Vertex公司選擇性NaV1.8抑制劑VX-548用于術后(腹部整形手術和拇囊炎切除手術)中重度急性疼痛治療的兩項Ⅲ期臨床均達到主要終點�����。與安慰劑相比����,VX-548組患者48小時內疼痛強度差異的時間加權總和評分(SPID48)顯著降低����,SPID48的平均差異分別為48.4(P<0.0001)和29.3(P=0.0002);但與羥考酮/對乙酰氨基酚(HB/APAP)組合相比����,VX-548組SPID48的改善沒有達到優(yōu)效標準。VX-548總體耐受性良好����。
4.新型反義RNA療法治療DMD的Ⅱ期臨床積極��。Sarepta公司多肽磷酰二胺嗎啉寡聚體(PPMO)療法SRP-5051(vesleteplirsen)治療適于使用外顯子51跳躍治療的杜氏肌營養(yǎng)不良(DMD)患者的國際Ⅱ期臨床MOMENTUM(SRP-5051-201研究)結果積極����。在28周時,SRP-5051(30mg/kg�����,每4周一次)可使抗肌萎縮蛋白的平均表達水平達到5.17%(較基線提高4.53%,P<0.0001)��;平均外顯子跳躍率達到11.11%(較基線提高10.07%)�����。此外��,患者在預防性地接受補充鎂治療后��,未發(fā)生與治療相關的停藥����。
5.SLC6A19別構抑制劑PKU早期臨床積極。Jnana公司靶向苯丙氨酸(Phe)轉運蛋白SLC6A19的潛在“first-in-class”小分子抑制劑JNT-517����,在治療苯丙酮尿癥(PKU)患者的Ⅰ期臨床獲積極結果。與安慰劑相比�����,JNT-517組第28天患者的平均血液Phe水平顯著降低51%(p=0.0019);患者臨床應答率達到88%��;藥物安全性良好��。Jnana計劃在今年下半年與監(jiān)管機構溝通�����,尋求明年直接將JNT-517推進至關鍵Ⅲ期臨床����。
6.賽諾菲布局IL-10R激動劑。賽諾菲宣布與Synthekine公司達成合作許可協(xié)議����,獲得后者專有蛋白質工程平臺優(yōu)化的多種IL-10R激動劑的臨床前、開發(fā)和商業(yè)化權益��,用于治療炎癥性疾病����。工程化蛋白分子可選擇性地激活特定細胞上的細胞因子信號傳導��,從而最大限度地提高療效并降低毒性����。根據(jù)協(xié)議��,Synthekine將獲得4000萬美元的預付款����,臨床前����、開發(fā)、監(jiān)管和商業(yè)里程碑潛在付款����,以及產品的分級特許權使用費。
7.司美格魯肽2023年大賣212億美元��。1月31日�����,諾和諾德發(fā)布2023年Q4及全年業(yè)績��。2023年總銷售額為2322.61億丹麥克朗(約337.01億美元)����,同比增長31%����。司美格魯肽全年總銷售額達到約211.58 億美元:司美格魯肽注射液Ozempic(2型糖尿?����。┦杖?57.18億丹麥克朗(139.17億美元��,+60%)�����;司美格魯肽片劑Rybelsus(2型糖尿?�。┦杖?87.50億丹麥克朗(27.26億美元����,+66%);司美格魯肽注射液Wegovy(肥胖)收入313.43億丹麥克朗(45.57億美元��,+407%)�����。
醫(yī)藥熱點
1.南京鼓樓醫(yī)院互聯(lián)網醫(yī)院服務再升級�����。近日����,南京鼓樓醫(yī)院互聯(lián)網醫(yī)院線上復診醫(yī)保在線支付開通,旨在解決患者因時間����、空間無法到線下醫(yī)院復診開藥的問題,同時醫(yī)保報銷節(jié)省看病費用��?�;颊呤跈噌t(yī)保電子憑證后��,即可享受“在線復診—續(xù)方開藥�����、開檢查—醫(yī)保支付—藥品配送”的一體化醫(yī)療服務��,線上復診的掛號費及后續(xù)藥費����、檢查費均可醫(yī)保線上支付����,切實給患者帶來便利����。
2.浙江報告1例H3N2與H10N5混合感染死亡病例。據(jù)國家疾控局30日通報��,浙江省發(fā)現(xiàn)一例H3N2與H10N5混合感染病例��?���;颊撸?����,63歲����,安徽宣城人,既往有多種基礎性疾病��。2023年11月30日出現(xiàn)咳嗽����、咽痛��、發(fā)熱等癥狀;12月2日因病情加重收入當?shù)蒯t(yī)療機構救治����;12月7日,轉至浙江省醫(yī)療機構住院治療�����,后因病情嚴重于12月16日死亡�����。專家評估認為����,此次疫情為一次偶發(fā)的禽到人的跨種屬傳播。該病毒感染人的風險低��,未發(fā)生人傳人的情況��。
評審動態(tài)
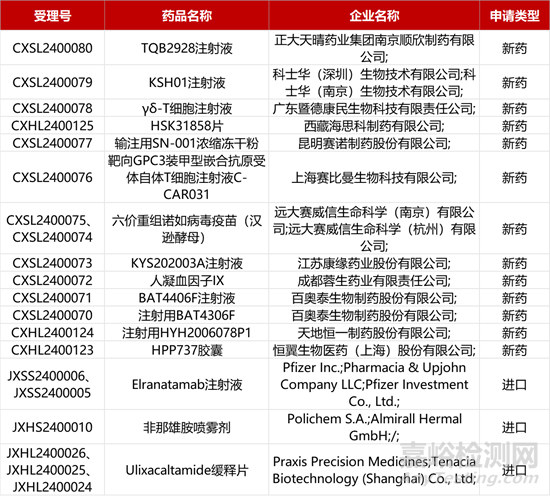
1. CDE新藥受理情況(01月31日)
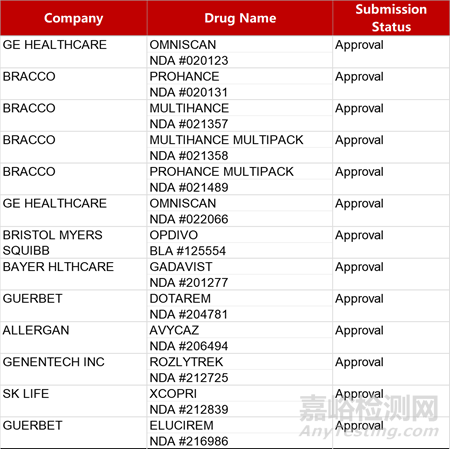
2. FDA新藥獲批情況(北美01月29日)