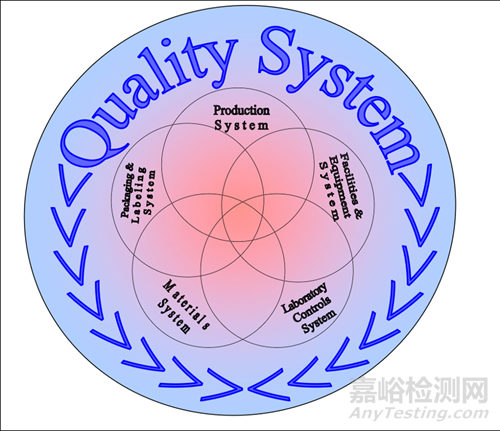
帶著到底應(yīng)該怎樣去看質(zhì)量體系的建立���、體系水平的問(wèn)題���,最近,又開(kāi)始重新研究FDA的《藥品CGMP符合性的質(zhì)量體系方式》指南�����,重新理解質(zhì)量體系,以及六大體系的關(guān)系�����。
FDA提出的這六大體系思路���,并不是建立質(zhì)量體系的指引�����,而是FDA對(duì)藥品生產(chǎn)企業(yè)的檢查框架���。而這六大體系圖,其實(shí)是表明了:從管理上來(lái)說(shuō)�,五大體系的圈圈除了都在質(zhì)量體系內(nèi)以外,任何一個(gè)圈圈都與另外四個(gè)圈圈全部有交疊�����。一個(gè)體系的問(wèn)題�,可能與另外的體系都有關(guān)系。
六大體系檢查程序���,制劑企業(yè)在CPGM7356.002中(最近更新:2022年9月16日)�����。官網(wǎng)鏈接:https://www.fda.gov/media/75167/download?attachment
原料藥企業(yè)在CPGM7356.002F中(最近更新時(shí)間2015年9月11日)�。官網(wǎng)鏈接:
https://www.fda.gov/media/75201/download
今天來(lái)看看最簡(jiǎn)單也最容易出大問(wèn)題的包裝與貼簽體系。
1. 包裝貼簽體系:制劑企業(yè)vs 原料藥企業(yè)
包裝與貼簽���,不論對(duì)制劑企業(yè)還是原料藥企業(yè)�,都是最簡(jiǎn)單也最容易出大問(wèn)題的方面�����。一方面�,因?yàn)榘b貼簽過(guò)程中的差錯(cuò)混淆���,可能直接導(dǎo)致影響藥品對(duì)患者的治療效果和治療安全�。這一點(diǎn)�����,我們都清楚���,但是也不見(jiàn)得都做好了�����。另一方面���,包裝貼簽對(duì)防偽方面的考慮���,也關(guān)系到藥品在分配過(guò)程中被偽造的問(wèn)題。而被偽造�,對(duì)患者來(lái)說(shuō),是安全問(wèn)題�����。對(duì)藥企來(lái)是���,是利益和名譽(yù)風(fēng)險(xiǎn)的問(wèn)題���。
對(duì)包裝容器和密封系統(tǒng)、包裝規(guī)格等的選擇與確定�,影響著藥品貯藏期間的質(zhì)量。這個(gè)問(wèn)題,在包裝工藝開(kāi)發(fā)�、質(zhì)量穩(wěn)定性研究過(guò)程中去確定,在生產(chǎn)體系�、生產(chǎn)包裝過(guò)程中去控制。這是包裝與生產(chǎn)�����、實(shí)驗(yàn)室�����、物料體系之間交叉的地方�����。
而FDA這份對(duì)制劑企業(yè)和原料藥企業(yè)的包裝貼簽體系的檢查重點(diǎn)�,側(cè)重在包裝貼簽的差錯(cuò)控制。包括:
貼簽物料的控制:要正確(內(nèi)容信息�、標(biāo)簽對(duì)應(yīng)與正確的產(chǎn)品)以防止用藥差錯(cuò)、要平衡(發(fā)放數(shù)量�����、使用數(shù)量�、損毀數(shù)量、退回?cái)?shù)量)以防止標(biāo)簽流出被仿冒�;要區(qū)分和檢查(不同產(chǎn)品的相似標(biāo)簽)以防混淆;要可追蹤(每批包裝記錄上貼上當(dāng)批產(chǎn)品的已打印信息內(nèi)容的標(biāo)簽樣本)���。
包裝過(guò)程的防混淆控制:不同產(chǎn)品在同一時(shí)間包裝時(shí)的物理分隔和現(xiàn)場(chǎng)控制���。
防偽的控制。美國(guó)GMP中有專門的一條(21CFR 211.132)�,是針對(duì)OTC人用藥品的防偽的要求。對(duì)于原料藥的仿偽���,雖然在FDA的檢查重點(diǎn)清單中沒(méi)有���,ICH Q7也沒(méi)有特別提到這個(gè)內(nèi)容,但是�����,已經(jīng)有越來(lái)越多的制劑企業(yè)對(duì)原料藥供應(yīng)商提出了這方面的要求���,尤其是在供應(yīng)鏈相對(duì)復(fù)雜�、被替換和仿冒的風(fēng)險(xiǎn)相對(duì)較大的情況下�����。原料藥制造商基于風(fēng)險(xiǎn)的決定包裝仿偽策略,也是在質(zhì)量風(fēng)險(xiǎn)管理過(guò)程中需要考慮的�����。
在這個(gè)體系的所有控制中�����,對(duì)人的要求更高�����,因?yàn)椴铄e(cuò)有很大一部分原因是人造成的�。即使檢查重點(diǎn)清單中第一條依然是一句同樣的“人員培訓(xùn)與資質(zhì)確定”,但是���,對(duì)包裝貼簽體系來(lái)說(shuō)�,人員到底需要培訓(xùn)什么�,要求有什么資質(zhì)的考核,我們需要多一些考慮�����。甚至可以考慮用“故意錯(cuò)誤”來(lái)考核�,看人員是否會(huì)發(fā)現(xiàn)和制止錯(cuò)誤。
2. 制劑企業(yè)檢查重點(diǎn)清單
清單中標(biāo)黃部分為卡瑞法劃重點(diǎn):
1 )人員培訓(xùn)與資質(zhì)確定
2)包裝貼簽物料的認(rèn)可
3)包裝貼簽操作的變更控制系統(tǒng)
4)足夠的標(biāo)簽貯存���,包括批準(zhǔn)的和簽發(fā)后退回的
5)尺寸�����、形狀和顏色相近的不同產(chǎn)品的標(biāo)簽控制
6)沒(méi)有100%電子或目視確認(rèn)或者不是用于專線的���、具有類似外觀的成品直接容器的切割標(biāo)簽
7)除非標(biāo)簽按大小���、形狀或顏色區(qū)分���,否則不進(jìn)行標(biāo)簽鋼印
8)對(duì)將在多個(gè)專用貼簽線上貼簽的已裝填未貼簽容器的控制
9)完善的包裝記錄,包含所有使用的標(biāo)簽的樣本
10)標(biāo)簽發(fā)放的控制�����、發(fā)放標(biāo)簽的檢查���、已用標(biāo)簽的數(shù)量平衡
11)已貼簽成品的檢查
12)到貨標(biāo)簽(打樣)的充分檢查
13)批號(hào)使用�����,對(duì)帶有批號(hào)/控制號(hào)的多余標(biāo)簽的銷毀
14)不同貼簽和包裝線之間的物理/空間分隔
15)與生產(chǎn)線相關(guān)的打印裝置的監(jiān)控
16)清場(chǎng)���、檢查和記錄
17)符合防偽包裝要求(見(jiàn)21CFR 211.132及CPG 450.500某些人用非處方藥的防偽包裝要求)
18)包裝貼簽操作的驗(yàn)證,包括計(jì)算機(jī)化過(guò)程的安全性和驗(yàn)證
19)對(duì)非預(yù)期差異的文件化的調(diào)查
3. 原料藥企業(yè)檢查重點(diǎn)清單
清單中標(biāo)黃部分為卡瑞法劃重點(diǎn):
1)人員培訓(xùn)與資質(zhì)確認(rèn)
2)包裝貼簽物料的認(rèn)可
3)包裝貼簽操作的變更控制系統(tǒng)
4)足夠的標(biāo)簽貯存�,包括批準(zhǔn)的和簽發(fā)后退回的
5)尺寸、形狀和顏色相似的不同原料藥的標(biāo)簽控制
6)完善的包裝記錄���,包含所有使用標(biāo)簽的樣本
7)標(biāo)簽發(fā)放的控制�����、發(fā)放標(biāo)簽的檢查�、已用標(biāo)簽的數(shù)量平衡
8)已貼簽原料藥的檢查
9)標(biāo)簽來(lái)料(打樣)的檢查
10)批號(hào)使用、對(duì)帶有批號(hào)/控制號(hào)的多余標(biāo)簽的銷毀
11)在對(duì)不止一批產(chǎn)品同時(shí)包裝時(shí)充分的分隔與控制
12)標(biāo)簽上的有效期或復(fù)驗(yàn)期
13)包裝貼簽操作的驗(yàn)證���,包括計(jì)算機(jī)化過(guò)程的安全性和驗(yàn)證
14)記錄任何非預(yù)期的差異(關(guān)鍵差異調(diào)查包含在質(zhì)量體系下)
對(duì)原料藥的包裝貼簽體系檢查,參考規(guī)范是ICH Q7的第9章和第17章�。