文章在對藥品生產(chǎn)潔凈環(huán)境監(jiān)測相關(guān)法規(guī)進(jìn)行分析的基礎(chǔ)上,結(jié)合藥品生產(chǎn)企業(yè)潔凈環(huán)境監(jiān)測實(shí)踐,將藥品生產(chǎn)潔凈環(huán)境監(jiān)測注意點(diǎn)劃分為監(jiān)測程序規(guī)定��、監(jiān)測計(jì)劃和監(jiān)測實(shí)施3個(gè)方面���,進(jìn)行要點(diǎn)及注意事項(xiàng)的分析與闡述��。并通過國內(nèi)外藥品檢查時(shí)在藥品生產(chǎn)潔凈環(huán)境方面發(fā)現(xiàn)的缺陷進(jìn)行統(tǒng)計(jì)分析��,對缺陷分布情況及典型問題進(jìn)行介紹�����,為我國藥品生產(chǎn)企業(yè)��,特別是無菌藥品生產(chǎn)企業(yè)�����,進(jìn)一步做好藥品生產(chǎn)潔凈環(huán)境監(jiān)測提供參考與借鑒��,同時(shí)也為各類藥品生產(chǎn)潔凈環(huán)境監(jiān)測的檢查提供思路�����。
藥品完成內(nèi)包裝前的潔凈環(huán)境控制良好���,可有效避免藥品受到微生物和微粒等外來污染�����。2013 至2019 年�����,全球因微生物污染及無菌保證缺乏等因素召回的藥品占召回藥品總量的40.26% [1]���。因此,做好藥品生產(chǎn)潔凈環(huán)境監(jiān)測對保證藥品質(zhì)量有重要意義�����。
潔凈環(huán)境監(jiān)測是制藥企業(yè)污染控制的重要組成部分���,主要用于評估藥品生產(chǎn)中微生物控制的有效性�����,特別是無菌藥品�����。近年的國內(nèi)外藥品檢查中發(fā)現(xiàn)�����,藥品生產(chǎn)企業(yè)潔凈環(huán)境監(jiān)測仍存在問題��,潔凈環(huán)境監(jiān)測實(shí)踐方面仍有不足�����。因此���,有必要就如何有效開展藥品生產(chǎn)潔凈環(huán)境監(jiān)測,進(jìn)行系統(tǒng)分析與要點(diǎn)研究�����。
1���、藥品生產(chǎn)潔凈環(huán)境監(jiān)測法規(guī)指南概述
國內(nèi)外GMP 對于藥品生產(chǎn)環(huán)境監(jiān)測均有明確規(guī)定��,盡管其中對于潔凈級別的分類存在微小差異��,但總體原則與要求是相似的���。我國GMP 附錄《無菌藥品》中將潔凈級別分為A 級�����、B 級���、C 級和D 級,并與國際標(biāo)準(zhǔn)化組織(ISO) 的潔凈室及相關(guān)控制環(huán)境系列標(biāo)準(zhǔn)(ISO 14644) 進(jìn)行了關(guān)聯(lián)��;同時(shí)GMP正文中明確��,非無菌制劑生產(chǎn)的暴露工序區(qū)域應(yīng)當(dāng)參照《無菌藥品》中D 級潔凈區(qū)的要求設(shè)置��,企業(yè)可根據(jù)產(chǎn)品的標(biāo)準(zhǔn)和特性對該區(qū)域采取適當(dāng)?shù)奈⑸锉O(jiān)控措施[2]��。歐盟新修訂的GMP 附錄《無菌藥品生產(chǎn)》中也明確���,潔凈室和潔凈空氣設(shè)備的確認(rèn)可參考ISO 14644 系列標(biāo)準(zhǔn)[3]���。WHO 和美國FDA關(guān)于無菌藥品生產(chǎn)的技術(shù)標(biāo)準(zhǔn)與指南中均有類似的描述[4-5]。
各國GMP 均以ISO 14644 系列標(biāo)準(zhǔn)為基礎(chǔ)���,結(jié)合藥品生產(chǎn)特性�����,將藥品生產(chǎn)環(huán)境分類為4 個(gè)不同等級��。其中��,除塵埃粒子外��,增加了微生物標(biāo)準(zhǔn)(包括浮游菌�����、沉降菌和表面微生物)��,并要求基于設(shè)施設(shè)備���、生產(chǎn)工藝與步驟、操作�����、確認(rèn)數(shù)據(jù)及歷史監(jiān)控?cái)?shù)據(jù)等的風(fēng)險(xiǎn)評估��,制定全面的環(huán)境監(jiān)測計(jì)劃與程序(包括取樣位置���、監(jiān)測頻率��、監(jiān)測方法��、行動(dòng)限與警戒限��、趨勢分析方法�����、異常情況調(diào)查與糾正措施等)���,以保證潔凈室和潔凈空氣設(shè)備能持續(xù)提供符合設(shè)計(jì)和法規(guī)要求的適宜空氣��,并及時(shí)發(fā)現(xiàn)異常和偏離環(huán)境限度的情況��。
除GMP 規(guī)定外���,《中華人民共和國藥典》2020年版(ChP 2020)、《美國藥典》(USP 2022) 及《WHO藥品微生物實(shí)驗(yàn)室管理規(guī)范》(2011 版) 中對潔凈環(huán)境監(jiān)測也有相關(guān)規(guī)定��。其中�����,《WHO 藥品微生物實(shí)驗(yàn)室管理規(guī)范》要求基于風(fēng)險(xiǎn)評估結(jié)果制定環(huán)境監(jiān)測計(jì)劃[6];而ChP 2020 和USP 2022 針對不同潔凈級別均明確了指導(dǎo)性監(jiān)測頻次���,但二者適用范圍并不相同�����,監(jiān)測頻次的差異也較大���?����!睹绹⑸鋭﹨f(xié)會(huì)技術(shù)報(bào)告》中的環(huán)境監(jiān)測計(jì)劃基本原則認(rèn)為�����,環(huán)境監(jiān)測屬于污染控制策略的一部分�����,適用于評估無菌藥品生產(chǎn)中微生物控制的手段[7]�����。從執(zhí)行角度來看,環(huán)境監(jiān)測本身也是一種干預(yù)行為��,并非越多越好��,關(guān)鍵在于基于風(fēng)險(xiǎn)評估結(jié)果�����,確保監(jiān)測行為科學(xué)���、合規(guī)�����、有效��。
2���、藥品生產(chǎn)潔凈環(huán)境監(jiān)測要點(diǎn)
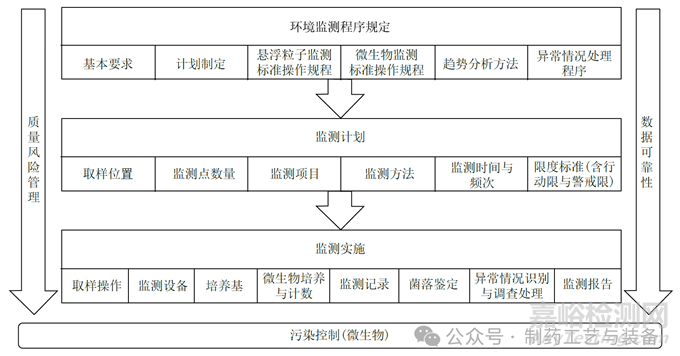
在探討藥品生產(chǎn)潔凈環(huán)境監(jiān)測要點(diǎn)前,需要明確藥品生產(chǎn)潔凈環(huán)境監(jiān)測不是一項(xiàng)孤立的工作���,有著必要的前提條件��,包括有相應(yīng)資質(zhì)的人員��、合理的廠房設(shè)施設(shè)計(jì)與維護(hù)��、適宜的清潔與消毒程序�����、可靠的工藝控制��,以及有效的質(zhì)量管理體系���。本研究主要著眼于暖通空調(diào)系統(tǒng)(heating�����,ventilation and air-conditioning systems,HVAC) 及潔凈區(qū)已完成設(shè)計(jì)���、安裝���、運(yùn)行及性能確認(rèn)后,在常規(guī)生產(chǎn)期間的潔凈環(huán)境監(jiān)測要點(diǎn)(圖1)��。
圖1 藥品生產(chǎn)潔凈環(huán)境監(jiān)測要點(diǎn)圖
質(zhì)量風(fēng)險(xiǎn)管理貫穿藥品生產(chǎn)潔凈環(huán)境監(jiān)測的全過程,數(shù)據(jù)可靠性是藥品生產(chǎn)潔凈環(huán)境監(jiān)測的基礎(chǔ)�����;環(huán)境監(jiān)測計(jì)劃的制定需要基于風(fēng)險(xiǎn)評估��,環(huán)境監(jiān)測的實(shí)施必須保證數(shù)據(jù)可靠性��。根據(jù)藥品生產(chǎn)潔凈環(huán)境監(jiān)測開展的不同階段與邏輯���,可從環(huán)境監(jiān)測程序規(guī)定�����、監(jiān)測計(jì)劃和監(jiān)測實(shí)施3個(gè)方面進(jìn)行分析�����。
2.1環(huán)境監(jiān)測程序規(guī)定
環(huán)境監(jiān)測程序是整個(gè)藥品生產(chǎn)潔凈環(huán)境監(jiān)測工作開展的依據(jù)與指導(dǎo)文件�����,應(yīng)明確不同潔凈級別環(huán)境監(jiān)測的基本標(biāo)準(zhǔn)與要求���,包括:溫度�����、相對濕度���、壓差、懸浮粒子與微生物等���;同時(shí)需要明確環(huán)境監(jiān)測計(jì)劃制定的原則與程序��、懸浮粒子及微生物監(jiān)測標(biāo)準(zhǔn)操作規(guī)程�����、趨勢分析方法與要求���、異常情況處理程序、記錄與定期分析報(bào)告要求等�����。
溫度���、相對濕度��、壓差應(yīng)采取適宜的方式監(jiān)測���。對于壓差梯度是關(guān)鍵性影響因素的房間(如人流與物料的緩沖間、氣鎖間)��,需要考慮進(jìn)行持續(xù)在線監(jiān)測�����,并考慮人員現(xiàn)場進(jìn)入房間前確認(rèn)的方式��。懸浮粒子監(jiān)測標(biāo)準(zhǔn)程序中需重點(diǎn)關(guān)注采樣管長度�����、彎管半徑及采樣體積��。微生物監(jiān)測標(biāo)準(zhǔn)程序需注意浮游菌采樣法���、沉降菌法�����、表面取樣法的細(xì)節(jié)操作�����,如平皿蓋擺放��、平皿編號原則與方式���、沉降菌實(shí)際采樣時(shí)間的折算要求�����、培養(yǎng)方式與條件���、微生物觀察與記錄要求、擦拭取樣面積的保障等�����。趨勢分析及異常情況處理程序中需關(guān)注警戒限與行動(dòng)限的建立原則���、定期(如每季度或每年) 數(shù)據(jù)趨勢分析的要求��、趨勢分析中的判異原則��、出現(xiàn)異常趨勢時(shí)的調(diào)查要求�����、難以去除微生物(如細(xì)菌芽孢或霉菌)的特殊處理程序等��。
2.2環(huán)境監(jiān)測計(jì)劃
潔凈區(qū)環(huán)境監(jiān)測計(jì)劃應(yīng)基于全面的風(fēng)險(xiǎn)評估制定���,包括對實(shí)際生產(chǎn)設(shè)施設(shè)備、生產(chǎn)工藝與步驟�����、涉及操作��、HVAC 系統(tǒng)確認(rèn)期間的數(shù)據(jù)及歷史監(jiān)控?cái)?shù)據(jù)等的全面評估���。風(fēng)險(xiǎn)評估的重點(diǎn)包括:確定懸浮粒子和微生物監(jiān)測的取樣位置�����、監(jiān)測點(diǎn)數(shù)量�����、監(jiān)測項(xiàng)目�����、監(jiān)測或取樣方法��、監(jiān)測時(shí)間��、監(jiān)測頻率��,以及明確的行動(dòng)限與警戒限等內(nèi)容��,并應(yīng)形成質(zhì)量風(fēng)險(xiǎn)評估報(bào)告�����。
取樣位置的選擇需考慮房間布局���、生產(chǎn)工藝和網(wǎng)格化設(shè)計(jì)[8]��,關(guān)注可能導(dǎo)致產(chǎn)品污染的位置與工藝�����、可能發(fā)現(xiàn)微生物污染的位置��、難接近和消毒的位置���,以及必要的輪換或隨機(jī)取樣位置���。監(jiān)測點(diǎn)數(shù)量通常取決于該區(qū)域的潔凈級別�����、開展的工作���、物料和人員流向�����、操作情況�����、區(qū)域面積等因素��。以無菌藥品生產(chǎn)的A 級區(qū)為例��,常見的關(guān)鍵監(jiān)測位置包括灌裝線開關(guān)�����、灌裝容器附近以及關(guān)鍵設(shè)備表面(如敞口小瓶轉(zhuǎn)盤��、灌裝位置��、膠塞料斗��、灌裝針��、操作手套等)��。監(jiān)測項(xiàng)目與監(jiān)測或取樣方法主要是指對懸浮粒子與微生物的監(jiān)測要求��,A 級區(qū)對懸浮粒子的要求最高��,需要全過程監(jiān)測���,B 級區(qū)可以采用略低的監(jiān)測頻率���。對于微生物的監(jiān)測,通常要采用多種方法�����。對A 級區(qū)的關(guān)鍵操作全過程要進(jìn)行浮游菌和(或) 沉降菌監(jiān)測;在生產(chǎn)結(jié)束后��,A 級區(qū)與B 級關(guān)鍵區(qū)域都需要進(jìn)行表面微生物監(jiān)測[如灌裝線�����、控制面板�����、膠塞料斗�����、灌裝針��、門把手�����、墻壁��、限制進(jìn)出屏障系統(tǒng)(restricted access barrier system��,RABS)門及操作手套��、隔離簾等]�����。
值得注意的是��,監(jiān)測或取樣方法的有效性需在風(fēng)險(xiǎn)評估中進(jìn)行論證���。在監(jiān)測時(shí)間與監(jiān)測頻率方面�����,GMP 在無菌藥品生產(chǎn)章節(jié)對部分關(guān)鍵區(qū)域的監(jiān)測時(shí)間與頻率進(jìn)行了規(guī)定���,如:A 級區(qū)關(guān)鍵操作的全過程(含設(shè)備組裝階段),基本要求是應(yīng)能發(fā)現(xiàn)潛在的系統(tǒng)問題及對產(chǎn)品的潛在污染風(fēng)險(xiǎn)�����。在制定時(shí)應(yīng)考慮法規(guī)規(guī)定�����、產(chǎn)品類型與生產(chǎn)工藝��、人員操作與干預(yù)、產(chǎn)品后期是否滅菌�����、歷史監(jiān)測數(shù)據(jù)���、季節(jié)引起的微生物變化(如梅雨季節(jié)的霉菌��、特定區(qū)域不同月份微生物的增長趨勢差異[9]) 等因素�����。注意考慮在生產(chǎn)過程中對關(guān)鍵區(qū)域進(jìn)行監(jiān)控是否會(huì)增加產(chǎn)品污染的可能性;如果可能存在此風(fēng)險(xiǎn)�����,應(yīng)在操作完成后進(jìn)行取樣�����。此外��,如果生產(chǎn)過程中污染的可能性很低(如密閉系統(tǒng)生產(chǎn))���,則可以考慮降低監(jiān)測頻次�����。對于行動(dòng)限與警戒限:通常行動(dòng)限是基于法規(guī)或行業(yè)指南建立的��;而警戒限則是基于對環(huán)境監(jiān)測歷史數(shù)據(jù)的分析結(jié)果建立的��,常見的建立方法包括閾值法��、正態(tài)分布法(盡管環(huán)境監(jiān)測數(shù)據(jù)往往不屬于正態(tài)分布) 和公差限值法��。在監(jiān)測計(jì)劃制定時(shí)���,應(yīng)注意無菌隔離系統(tǒng)的特殊性��,其風(fēng)險(xiǎn)與常規(guī)的無菌生產(chǎn)環(huán)節(jié)不同�����,需要更多關(guān)注破損或泄露導(dǎo)致的污染��。
2.3環(huán)境監(jiān)測的實(shí)施
環(huán)境監(jiān)測計(jì)劃制定后��,需要按照環(huán)境監(jiān)測程序文件規(guī)定和計(jì)劃對藥品生產(chǎn)潔凈環(huán)境實(shí)施監(jiān)測���,此環(huán)節(jié)需重點(diǎn)關(guān)注數(shù)據(jù)的可靠性���。實(shí)施環(huán)節(jié)的取樣操作應(yīng)嚴(yán)格按程序規(guī)定開展,避免任何可能影響監(jiān)測結(jié)果的操作(如取樣時(shí)間不足���、消毒劑與培養(yǎng)基接觸等) �����;使用經(jīng)校準(zhǔn)或確認(rèn)后符合要求的監(jiān)測設(shè)備�����;確保微生物監(jiān)測用培養(yǎng)基的靈敏度�����,在規(guī)定條件下采用適宜的方式進(jìn)行培養(yǎng)(一般考慮在20 ~ 25 ℃培養(yǎng)3 d 后,繼續(xù)在30 ~ 35 ℃培養(yǎng)2 d)���,在培養(yǎng)過程中及結(jié)束時(shí)計(jì)數(shù)��,并對A 級區(qū)和B 級區(qū)檢出的微生物進(jìn)行鑒定�����,必要時(shí)對超出限度標(biāo)準(zhǔn)的C 級區(qū)與D 級區(qū)微生物進(jìn)行分離鑒定��。對于出現(xiàn)超出限度規(guī)定的結(jié)果與異常趨勢�����,均需按程序規(guī)定進(jìn)行調(diào)查���,必要時(shí)采取糾正和預(yù)防措施�����。所有監(jiān)測與調(diào)查操作需要進(jìn)行記錄���,并保證記錄符合ALCOA+ 原則(即可追溯、清晰��、同步���、原始�����、準(zhǔn)確���、完整��、一致���、持久與可獲得)[10],例如環(huán)境微生物監(jiān)測記錄信息至少應(yīng)包括監(jiān)測日期與時(shí)間�����、取樣位置���、取樣方法�����、培養(yǎng)基名稱與批號��、培養(yǎng)條件、培養(yǎng)時(shí)間���、微生物監(jiān)測結(jié)果(菌落單位)��、取樣及檢測人員等���,并注意采樣后培養(yǎng)基平皿標(biāo)識與實(shí)際記錄的關(guān)聯(lián)�����。最終按程序?qū)Νh(huán)境監(jiān)測數(shù)據(jù)進(jìn)行收集���、分析,形成階段性監(jiān)測報(bào)告��。
3��、藥品生產(chǎn)潔凈環(huán)境監(jiān)測的典型問題
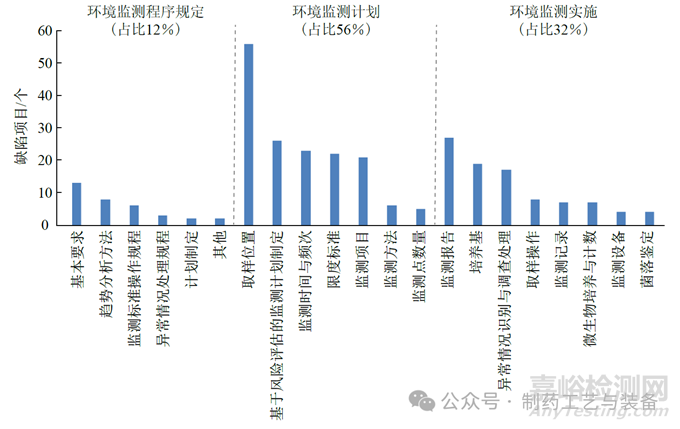
對2019 至2022 年我國國家藥品監(jiān)督管理局�����、美國FDA�����、歐洲藥品質(zhì)量管理局及WHO���,在全球藥品生產(chǎn)企業(yè)檢查中針對藥品生產(chǎn)潔凈環(huán)境監(jiān)測提出的部分缺陷進(jìn)行了收集與整理�����,通過對近300 個(gè)環(huán)境監(jiān)測相關(guān)缺陷的統(tǒng)計(jì)分析���,基于上述潔凈環(huán)境監(jiān)測要點(diǎn)分類��,歸納出當(dāng)前藥品生產(chǎn)企業(yè)在環(huán)境監(jiān)測方面的常見問題分布(圖2)�����。
圖2 藥品生產(chǎn)潔凈環(huán)境監(jiān)測中常見缺陷的分布
藥品生產(chǎn)潔凈環(huán)境監(jiān)測相關(guān)的常見缺陷分布主要是3 個(gè)方面:環(huán)境監(jiān)測程序規(guī)定(12%)���,環(huán)境監(jiān)測計(jì)劃(56%) 和環(huán)境監(jiān)測實(shí)施(32%),其中占比較高的問題依次是取樣位置(19.6%)��、監(jiān)測報(bào)告(9.5%)��、基于風(fēng)險(xiǎn)評估的監(jiān)測計(jì)劃制定(9.1%)��、監(jiān)測時(shí)間和頻次(8%)���、限度標(biāo)準(zhǔn)(7.7%)��、監(jiān)測項(xiàng)目(7.3%)��、培養(yǎng)基(6.6%)�����、異常情況識別與調(diào)查處理(5.9%)���、基本要求(4.6%)、趨勢分析方法(2.8%) 和取樣操作(2.8%)�����,上述缺陷項(xiàng)目總和占全部的80%以上���。
3.1潔凈環(huán)境監(jiān)測程序規(guī)定的典型問題
潔凈區(qū)內(nèi)溫度��、相對濕度和壓差是監(jiān)測的基礎(chǔ)指標(biāo)���,典型問題有以下幾種。(1) 程序中對“關(guān)鍵性”與“非關(guān)鍵性”房間采取不同的監(jiān)測要求���,但二者的定義與區(qū)分不明確�����;(2) 關(guān)鍵生產(chǎn)區(qū)域未進(jìn)行特定指標(biāo)的監(jiān)測���,或監(jiān)測方式存在潛在風(fēng)險(xiǎn)(如缺少持續(xù)監(jiān)測或報(bào)警系統(tǒng)���、現(xiàn)場人員不能確認(rèn)區(qū)域狀態(tài)、限度標(biāo)準(zhǔn)范圍不合理等)�����;(3) 生產(chǎn)現(xiàn)場溫度���、相對濕度或壓差超出標(biāo)準(zhǔn)規(guī)定��。
趨勢分析方法方面主要有以下典型問題��。(1)未規(guī)定如何報(bào)告��、展現(xiàn)�����、分析和執(zhí)行環(huán)境監(jiān)測的趨勢分析��;(2) 相關(guān)程序規(guī)定不詳細(xì)���、不清晰��。
監(jiān)測標(biāo)準(zhǔn)操作規(guī)程和異常程序處理規(guī)程中存在部分規(guī)定不明確或不合理的情況。(1) 規(guī)定沉降菌結(jié)果采用平均值與標(biāo)準(zhǔn)限度進(jìn)行對比���,存在潛在污染風(fēng)險(xiǎn)批次放行的可能�����;(2) 缺少詳細(xì)說明環(huán)境監(jiān)測異常時(shí)的處理���、記錄與調(diào)查要求的程序規(guī)定。
此外�����,還存在監(jiān)測計(jì)劃的制定程序缺少對較低級別區(qū)域監(jiān)測的考慮��、環(huán)境監(jiān)測操作的監(jiān)督���,以及潛在風(fēng)險(xiǎn)評估不足等問題���。
3.2潔凈環(huán)境監(jiān)測計(jì)劃的典型問題
潔凈區(qū)環(huán)境監(jiān)測計(jì)劃中��,取樣位置���、監(jiān)測項(xiàng)目與監(jiān)測點(diǎn)數(shù)量是相互關(guān)聯(lián)的,具體如下��。
首先�����,取樣位置的問題主要是未對關(guān)鍵風(fēng)險(xiǎn)區(qū)域進(jìn)行取樣監(jiān)測�����,以及現(xiàn)有取樣位置不具有代表性�����,典型問題如下��。(1) 無菌連接處�����、延展層流下方、加塞后的傳輸軌道等位置�����,未設(shè)置取樣點(diǎn)���;B 級區(qū)的生產(chǎn)培養(yǎng)室未進(jìn)行取樣監(jiān)測��;監(jiān)測位置遠(yuǎn)離無菌操作或人員干預(yù)區(qū)域;環(huán)境監(jiān)測風(fēng)險(xiǎn)評估文件中未明確具體的取樣位置���。(2) 懸浮粒子監(jiān)測中�����,與A級區(qū)直接相連的B 級區(qū)房間未進(jìn)行監(jiān)測�����;隧道烘箱出口處的小瓶轉(zhuǎn)盤���、膠塞料斗、隧道烘箱冷卻段等位置�����,未設(shè)置監(jiān)測點(diǎn);懸浮粒子采樣器位置不合理���,如正對著玻璃門���、安裝位置高于凍干機(jī)門等。(3)表面微生物監(jiān)測中���,A 級區(qū)人員操作手套手指(包括RABS 上的手套)�����、灌裝區(qū)域人員和物料頻繁接觸的表面(包括延展層流的塑料簾���、RABS 門內(nèi)外表面、B 級區(qū)操作面板��、膠塞料斗�����、灌裝針頭等)、無菌操作人員侵入灌裝線�����、分裝線靠墻的位置與墻壁等位置未進(jìn)行監(jiān)測���;僅針對固定位置進(jìn)行監(jiān)測���,未采用表面擦拭法隨機(jī)檢查難以清潔的點(diǎn);B 級區(qū)地面未進(jìn)行表面微生物監(jiān)測�����;原液車間C 級區(qū),僅要求對設(shè)備面板和層流罩保護(hù)簾外表面進(jìn)行微生物監(jiān)測�����。
其次���,監(jiān)測項(xiàng)目的問題主要是僅對一些關(guān)鍵性區(qū)域進(jìn)行了監(jiān)測�����,典型問題如下��。(1)A 級區(qū)小瓶緩沖區(qū)域���、凍干機(jī)裝置位置等未進(jìn)行浮游菌監(jiān)測�����;(2)A 級區(qū)加塞位置缺少懸浮粒子監(jiān)測或微生物監(jiān)測;(3)B 級區(qū)更衣室及灌裝間未進(jìn)行表面微生物監(jiān)測��;(4) 生產(chǎn)培養(yǎng)室未進(jìn)行沉降菌監(jiān)測��;(5)C 級區(qū)均未進(jìn)行表面微生物監(jiān)測;(6)D 級區(qū)未監(jiān)測懸浮粒子�����;(7) 未設(shè)置在線懸浮粒子監(jiān)測�����。
另外�����,監(jiān)測點(diǎn)數(shù)量方面的問題主要是潔凈區(qū)內(nèi)監(jiān)測點(diǎn)數(shù)量過少,與生產(chǎn)操作和潔凈區(qū)面積等不匹配���,典型問題如下���。(1)B 級區(qū)只有1 個(gè)懸浮粒子采樣點(diǎn);(2) 生產(chǎn)線有16 個(gè)灌裝針頭且覆蓋了較長的表面���,但灌裝位置只有1 個(gè)采樣點(diǎn)���。
風(fēng)險(xiǎn)評估計(jì)劃制定相關(guān)問題的頻次居于環(huán)境監(jiān)測計(jì)劃方面的第二���,典型問題如下。環(huán)境監(jiān)測計(jì)劃標(biāo)準(zhǔn)作業(yè)程序(SOP) 中無正式的風(fēng)險(xiǎn)評估報(bào)告���,包括取樣位置�����、取樣頻次等均未基于正式的風(fēng)險(xiǎn)評估開展,例如層流設(shè)備A 下的懸浮粒子監(jiān)測點(diǎn)的設(shè)置未基于風(fēng)險(xiǎn)評估�����,2 個(gè)監(jiān)測點(diǎn)高于操作水平面并靠墻安裝���。
監(jiān)測時(shí)間與頻次方面的問題主要是環(huán)境監(jiān)測頻次過低�����,以及監(jiān)測期間未能覆蓋關(guān)鍵操作區(qū)間�����,典型問題如下��。(1) 無菌操作最開始�����,即分裝器具組裝時(shí)未進(jìn)行環(huán)境監(jiān)測���;(2) 培養(yǎng)基模擬灌裝試驗(yàn)中,微生物環(huán)境監(jiān)測未覆蓋物料轉(zhuǎn)入RABS 的過程�����;(3)灌裝線組裝結(jié)束后���,未進(jìn)行浮游菌及表面微生物監(jiān)測���;(4) 原液配制過程中未進(jìn)行浮游菌監(jiān)測���,而是在人工無菌操作開始前進(jìn)行監(jiān)測��;(5) 浮游菌檢測僅在生產(chǎn)活動(dòng)結(jié)束后進(jìn)行��;(6)B 級區(qū)的微生物監(jiān)測頻次未考慮操作的差異性���,統(tǒng)一規(guī)定每3 個(gè)月進(jìn)行1 次( 包括對涉及人員操作的無菌灌裝間) ;(7)上游無菌生產(chǎn)工藝的常規(guī)環(huán)境監(jiān)測(包括微生物)每周僅進(jìn)行1 次��;(8) 對灌裝線B 級區(qū)和C 級區(qū)的表面微生物(如設(shè)備面板���、門把手和工作臺(tái)表面)���,僅在性能確認(rèn)時(shí)進(jìn)行監(jiān)測��;(9) 規(guī)定所有C 級區(qū)、D 級區(qū)��,每年僅進(jìn)行1 次環(huán)境監(jiān)測���;(10)B 級灌裝間未規(guī)定浮游菌取樣監(jiān)測的具體時(shí)間要求�����;(11) 分裝過程中�����,未連續(xù)監(jiān)測干熱滅菌柜和手套箱之間的A 級層流罩的懸浮粒子��。
限度標(biāo)準(zhǔn)方面的主要問題集中在環(huán)境監(jiān)測警戒限和行動(dòng)限制定不合理�����,以及對個(gè)別區(qū)域環(huán)境標(biāo)準(zhǔn)適用不當(dāng)���,典型問題如下��。(1) 未制定環(huán)境監(jiān)測的警戒限和行動(dòng)限��;(2) 未基于歷史數(shù)據(jù)制定環(huán)境監(jiān)測的警戒限和行動(dòng)限;(3) 制定的警戒限與行動(dòng)限僅適用于動(dòng)態(tài)條件���,未制定靜態(tài)監(jiān)測的警戒限與行動(dòng)限;(4) 對于懸浮粒子的報(bào)警限度��,未考慮超過5 μm 粒子的連續(xù)低計(jì)數(shù)情況���;(5) 僅針對固定采樣點(diǎn)制定了懸浮粒子的警戒限���,未對B 級區(qū)的移動(dòng)計(jì)數(shù)器采樣點(diǎn)設(shè)置警戒限;(6) 對于緊鄰A 級區(qū)RABS 層流的延展層流區(qū)域(其下人員會(huì)打開RABS 門進(jìn)行個(gè)別干預(yù)操作) 的微生物限度采用B級標(biāo)準(zhǔn)�����,未能基于工藝��、環(huán)境和產(chǎn)品的潛在風(fēng)險(xiǎn)進(jìn)行充分評估��。
監(jiān)測方法的問題主要涉及空氣采樣量和表面擦拭取樣方法2 個(gè)方面��,典型問題如下�����。(1) 對于表面微生物,未建立針對不規(guī)則表面的擦拭取樣方法,或未建立并確認(rèn)擦拭取樣面積的方法�����;(2) 環(huán)境監(jiān)測方案中未補(bǔ)充用于檢測特定微生物(產(chǎn)多糖細(xì)菌) 存在的方法���;(3) 凍干機(jī)開門處空氣采樣量均為1 m3���,未考慮凍干機(jī)門打開時(shí)間延長或者操作員靠近凍干機(jī)開門的時(shí)間��。
3.3潔凈環(huán)境監(jiān)測實(shí)施的典型問題
潔凈環(huán)境監(jiān)測在實(shí)施階段存在的問題���,從發(fā)生頻次的高低來看�����,依次為監(jiān)測報(bào)告��、培養(yǎng)基���、異常情況識別與調(diào)查處理��、取樣操作、監(jiān)測記錄��、微生物培養(yǎng)與計(jì)數(shù)���、監(jiān)測設(shè)備�����、菌落鑒定等方面�����。
監(jiān)測報(bào)告的問題集中在未能對環(huán)境監(jiān)測數(shù)據(jù)開展有效的趨勢分析,典型問題如下��。(1) 企業(yè)未能提供環(huán)境監(jiān)測報(bào)告及趨勢分析���。(2) 缺少環(huán)境監(jiān)測部分項(xiàng)目(如灌裝線A 級區(qū)的懸浮粒子�����、人員表面微生物等) 的趨勢分析。(3) 趨勢分析不充分�����,未考慮同一位置重復(fù)發(fā)現(xiàn)微生物的情況;每年僅進(jìn)行1 次環(huán)境監(jiān)測趨勢分析��,不利于及時(shí)發(fā)現(xiàn)并識別無菌區(qū)的潛在偏移���。(4) 趨勢分析中僅限于將結(jié)果與標(biāo)準(zhǔn)進(jìn)行比較,而未其轉(zhuǎn)化為信息�����,并調(diào)查根本原因。
培養(yǎng)基相關(guān)的問題主要包括表面接觸平皿中和劑的添加��、培養(yǎng)基促生長試驗(yàn)及自制培養(yǎng)基的包裝這3 個(gè)方面�����,典型問題如下���。(1) 表面監(jiān)測用培養(yǎng)基成分中未包括任何中和劑���,未評估設(shè)備及潔凈服表面殘留消毒劑的影響;(2) 培養(yǎng)基促生長試驗(yàn)存在不足�����,如未對環(huán)境監(jiān)測培養(yǎng)基進(jìn)行促生長試驗(yàn)���、未使用企業(yè)實(shí)際環(huán)境中的典型菌、僅使用了金黃色葡萄球菌1 種代表菌等,或未對暴露4 h 的沉降菌監(jiān)測用培養(yǎng)基進(jìn)行促生長試驗(yàn)��;(3) 自制培養(yǎng)基的包裝方式難以保證轉(zhuǎn)入A 級區(qū)后的表面無菌;(4)未對進(jìn)行了接觸平皿采樣后的表面清潔與消毒情況進(jìn)行研究���。
異常情況識別與調(diào)查處理方面的問題主要是對環(huán)境監(jiān)測中的異常趨勢未能進(jìn)行有效識別���、分析、調(diào)查與處理���,典型問題如下���。(1) 對操縱環(huán)境監(jiān)測數(shù)據(jù)的情況��,未啟動(dòng)任何偏差調(diào)查;(2) 針對環(huán)境監(jiān)測異常的根本原因分析不合理�����,且未進(jìn)行記錄�����;(3) 針對B 級區(qū)發(fā)現(xiàn)的2 次芽孢桿菌��,未按其程序規(guī)定啟動(dòng)偏差調(diào)查���;(4) 預(yù)充式灌裝線B 級區(qū)生產(chǎn)期間多次發(fā)現(xiàn)芽孢桿菌���,但由于未超過警戒限���,僅對其進(jìn)行了鑒定�����,未采取其他針對性的消毒措施���;(5)A 級區(qū)、C 級區(qū)的多個(gè)環(huán)境監(jiān)測平皿超出了行動(dòng)限��,但未啟動(dòng)調(diào)查。
取樣操作存在不規(guī)范的行為�����,典型問題如下���。(1) 操作人員未按程序規(guī)定進(jìn)行環(huán)境監(jiān)測取樣�����;(2)沉降菌取樣時(shí)平皿蓋遮擋了部分平皿暴露區(qū)域�����;(3)操作人員使用噴壺噴灑手臂消毒液時(shí)��,緊鄰沉降菌監(jiān)測平皿且噴灑方向朝向平皿���;(4) 擦拭法取樣時(shí),未使用面積模具�����,難以保證有效的取樣面積��。
監(jiān)測記錄的問題主要是記錄信息不完整、不同步�����、不真實(shí)等��,典型問題如下���。(1) 存在操縱環(huán)境監(jiān)測結(jié)果記錄的情況;(2) 環(huán)境監(jiān)測樣品未標(biāo)記采樣日期和時(shí)間���,監(jiān)控顯示樣品實(shí)際采樣時(shí)間與批記錄存在差異���;(3) 環(huán)境監(jiān)測記錄中未記錄懸浮粒子、浮游菌和沉降菌的具體監(jiān)測時(shí)間���;(4) 監(jiān)控顯示���,操作人員未按程序規(guī)定進(jìn)行表面微生物監(jiān)測,但記錄中卻顯示了對應(yīng)項(xiàng)目的監(jiān)測���。
微生物培養(yǎng)與計(jì)數(shù)方面的問題主要涉及操作的規(guī)范性�����,典型問題如下���。(1) 培養(yǎng)平皿計(jì)數(shù)僅用人工肉眼計(jì)數(shù)���,難以保證對細(xì)小菌落的有效識別;(2)未對培養(yǎng)基平皿觀察計(jì)數(shù)情況進(jìn)行復(fù)核��;(3) 對沉降菌監(jiān)測平皿計(jì)數(shù)結(jié)果的折算方式不合理���;(4) 企業(yè)規(guī)定在30 ~ 35 ℃培養(yǎng)至第5 天時(shí)觀察結(jié)果�����,進(jìn)行培養(yǎng)基促生長試驗(yàn)時(shí)真菌是在20 ~ 25 ℃培養(yǎng)���,未評估30 ~ 35 ℃對真菌監(jiān)測結(jié)果的影響;(5) 在使用封口膜密封平皿�����、采用多層塑料袋對培養(yǎng)基平皿裝袋等方式的狀態(tài)下進(jìn)行培養(yǎng)��,未評估該操作可能對需氧菌生長產(chǎn)生的影響;(6) 缺少培養(yǎng)期間的計(jì)數(shù)觀察與記錄��。
監(jiān)測設(shè)備的問題主要集中于懸浮粒子監(jiān)測儀�����,如對懸浮粒子監(jiān)測儀前部管道的半徑與形狀未作要求���,現(xiàn)場發(fā)現(xiàn)個(gè)別管道較長,且呈U 形�����,導(dǎo)致無法有效監(jiān)測實(shí)際懸浮粒子數(shù)量�����;又如�����,采用同一個(gè)便攜式懸浮粒子計(jì)數(shù)器��,對陽性區(qū)域和非陽性區(qū)域進(jìn)行環(huán)境監(jiān)測�����,存在交叉污染風(fēng)險(xiǎn)。
菌落鑒定方面的問題主要是未對A 級區(qū)���、B 級區(qū)環(huán)境監(jiān)測中發(fā)現(xiàn)的微生物進(jìn)行鑒定��。
4���、結(jié)語
藥品生產(chǎn)潔凈環(huán)境監(jiān)測是藥品生產(chǎn)污染控制策略的重要組成部分[11],顯示出藥品生產(chǎn)企業(yè)在無菌保證���、質(zhì)量風(fēng)險(xiǎn)管理��、統(tǒng)計(jì)分析等方面的能力���,也體現(xiàn)了企業(yè)對其藥品生產(chǎn)工藝與步驟、廠房設(shè)施與設(shè)備��、清潔與消毒等方面潛在風(fēng)險(xiǎn)情況的理解程度�����,是無菌藥品檢查的關(guān)鍵內(nèi)容[12]�����。特別是對于參數(shù)放行的無菌藥品,潔凈環(huán)境監(jiān)測更是影響藥品能否放行上市的直接因素之一[13]�����。
藥品生產(chǎn)企業(yè)(特別是無菌藥品生產(chǎn)企業(yè)) 必須高度重視潔凈環(huán)境監(jiān)測��。本研究對藥品生產(chǎn)潔凈環(huán)境監(jiān)測各階段的要點(diǎn)進(jìn)行了探討�����,并對近年來國內(nèi)外檢查中針對潔凈環(huán)境監(jiān)測各方面的典型問題進(jìn)行了分析與舉例�����,內(nèi)容涵蓋藥品生產(chǎn)潔凈環(huán)境監(jiān)測的核心內(nèi)容���。藥品生產(chǎn)企業(yè)可以借鑒本研究的相關(guān)內(nèi)容,結(jié)合實(shí)際情況��,對潔凈環(huán)境監(jiān)測工作進(jìn)行全面評估�����,進(jìn)一步完善相關(guān)措施,確保對潔凈環(huán)境監(jiān)測的有效性與適宜性��,進(jìn)而更好地保證藥品質(zhì)量���。
在各類藥品檢查(包括企業(yè)自檢與外部審計(jì))中���,可以將藥品生產(chǎn)潔凈環(huán)境監(jiān)測質(zhì)量風(fēng)險(xiǎn)評估報(bào)告作為切入點(diǎn),結(jié)合企業(yè)現(xiàn)場廠房設(shè)施與設(shè)備布局��、生產(chǎn)工藝與實(shí)際操作等���,評估生產(chǎn)潔凈環(huán)境監(jiān)測計(jì)劃的合理性��,并對相關(guān)程序規(guī)定與環(huán)境監(jiān)測實(shí)施情況進(jìn)行抽查��。參考本研究列舉的要點(diǎn)與典型問題��,可進(jìn)一步提高檢查工作的有效性��。
參考文獻(xiàn)
[1] 武雅文, 王 瑩, 車 陽, 等.國際微生物污染相關(guān)藥品召回回顧分析(2013—2019)[J].中國現(xiàn)代應(yīng)用藥學(xué), 2021,38(15): 1870-1877.
[2] 中華人民共和國衛(wèi)生部.藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)[EB/OL].(2011-01-17)[2023-03-04].http://www.linjec.com/download/2013121838310173.pdf.
[3] EMA.The rules governing medicinal products in the european unionvolume 4 EU guidelines for good manufacturing practice for medicinal products forhuman and veterinary use [EB/OL].(2022-08-22)[2023-03-04].h t t p s : / / h e a l t h.ec.europa.eu/system/files/2022-08/20220825_gmp-an1_en_0.pdf.
[4] WHO.TRS 1010-annex 8: guidelines on heating, ventilation and air-conditioning systems for non-sterile pharmaceutical products [EB/OL].(2018-10-10)[2023-03-04].https://www.who.int/publications/m/item/Annex-8-trs-1010.
[5] FDA.Guidance for industry: sterile drug products produced by aseptic processing——current good manufacturing practice [EB/OL].(2020-05-04)[2023-03-04].https://www.fda.gov/regulatory-information/search-fdaguidance-documents/sterile-drug-products-produced-asepticprocessing-current-good-manufacturing-practice.
[6] WHO.Good practices for pharmaceutical microbiology laboratories [EB/OL].(2011-06-10)[2023-03-04].https://www.who.int/docs/default-source/medicines/norms-and-standards/guidelines/quality-control/trs961-annex2-goodpractices-pharmaceutical-microbiologylaboratories.pdf?sfvrsn=ebd1845e_0.
[7] PDA.Technical report No.13(revised 2014) fundamentals of an environmental(2022 R)[EB/OL].(2022-05-05)[2023-03-04].https://849364ddf2a1c16b9b3c-d2fc8da97f4d917d0e12a6d71ff7e4b1.ssl.cf2.rackcdn.com/PDA/Technical%20Report%20Portal/index.html.
[8] 任杏珠.醫(yī)藥潔凈廠房空調(diào)系統(tǒng)確認(rèn)和環(huán)境監(jiān)測取樣點(diǎn)選取探討[J].煤炭與化工, 2022, 45(1): 144-150.
[9] 黃慧思, 崔碧玲, 洪嘉敏.藥品潔凈區(qū)環(huán)境微生物監(jiān)測分析報(bào)告[J].廣東化工, 2021, 48(23): 154-156.
[10] 顏若曦, 曹 軼.藥品生產(chǎn)企業(yè)數(shù)據(jù)可靠性缺陷分析[J].中國藥物警戒, 2018, 15(1): 20-23.
[11] 李國瓊, 翁賢坤, 梁玉琴.凍干粉針劑生產(chǎn)過程的污染控制策略[J].中國醫(yī)藥工業(yè)雜志, 2022, 53(1): 155-162.
[12] 顏若曦.世界衛(wèi)生組織生物制品檢查要點(diǎn)與典型問題研究[J].中國醫(yī)藥工業(yè)雜志, 2022, 53(7): 1049-1055.
[13] 尚 悅.無菌藥品參數(shù)放行國際實(shí)施歷程及我國現(xiàn)狀淺析[J].中國醫(yī)藥工業(yè)雜志, 2021, 52(9): 1248-1252.
本文作者顏若曦���,國家藥品監(jiān)督管理局食品藥品審核查驗(yàn)中心,來源于中國醫(yī)藥工業(yè)雜志,僅供交流學(xué)習(xí)�����。