摘 要 / Abstract
我國目前已初步建立了處方藥與非處方藥分類管理制度��,但在法律法規(guī)層面長期沒有明確中藥飲片處方藥與非處方藥管理屬性��,造成醫(yī)藥實踐中產(chǎn)生一系列監(jiān)管難��、處罰難��、執(zhí)行難的問題��。在推進中醫(yī)藥傳承與創(chuàng)新時代背景下��,在《處方藥與非處方藥分類管理辦法》修訂的特殊時期��,系統(tǒng)考慮中藥飲片分類管理的特殊性��、可行性��、必要性以及制度設(shè)計科學(xué)性等問題��。建議根據(jù)《藥品管理法》規(guī)定的保障公眾用藥安全和合法權(quán)益以及藥品經(jīng)營許可應(yīng)當(dāng)遵循方便群眾購藥的原則��,按照藥品分類管理規(guī)定��,在新修訂的《處方藥與非處方藥分類管理辦法》中明確中藥飲片實行處方藥與非處方藥分類管理屬性和要求��。
While China has established a preliminary classification management system for prescription and nonprescription drug, there has been a long-term lack of clear regulatory attributes for prescription and nonprescription drug in traditional Chinese medicine at the legal and regulatory levels. This has resulted in a series of challenges in supervision, punishment, and enforcement in pharmaceutical practices. In the context of promoting the inheritance and innovation of Chinese medicine, and during the special period of revising the Classification and Management Measures for Prescription and Nonprescription drug, this paper systematically considers the feasibility, necessity, and scientific design of the classification management of Chinese medicine decoction pieces. It is recommended to clarify the attributes and requirements of classified management for prescription and nonprescription Chinese medicine decoction pieces in the newly revised Classification Management Measures for Prescription and Nonprescription drug. This should align with the principles of "ensuring the safety and legitimate rights and interests of the public in drug use" and "facilitating the purchase of drug by the public" stipulated in the Drug Administration Law, and adhere to the principles of drug classification management.
關(guān) 鍵 詞 / Key words
中藥飲片��;處方藥��;非處方藥��;分類管理��;技術(shù)評價
Chinese medicine decoction pieces; prescription drug; nonprescription drug; classification management; technical review
將藥品分別按處方藥和非處方藥分類方式建立相應(yīng)法規(guī)和管理規(guī)定并實施監(jiān)督管理��,是藥品監(jiān)督管理的一項重要制度��,也是國際普遍采用的藥品管理模式[1]��。我國以《藥品管理法》為依據(jù)��,在相關(guān)法律法規(guī)和部門規(guī)章形成的分類管理法律規(guī)范體系支撐下��,初步建立起了處方藥與非處方藥分類管理制度��。但是我國藥品分類管理制度中長期沒有明確中藥飲片在處方藥與非處方藥分類管理中的管理屬性��。在藥品監(jiān)管和檢查實踐中都將中藥飲片按照處方藥進行監(jiān)管。對這種管理情況��,實務(wù)界和學(xué)術(shù)界一直存在爭議��。近期��,本研究團隊對中藥飲片的處方藥與非處方藥分類管理的可行性��、必要性以及制度設(shè)計等問題進行了比較系統(tǒng)的調(diào)研和分析��,希望明確中藥飲片的分類管理內(nèi)涵和管理原則��,完善中藥飲片處方藥與非處方藥管理制度��,促進中藥傳承與創(chuàng)新以及高質(zhì)量發(fā)展��。
1��、我國中藥分類管理政策分析與評價
1.1 處方藥與非處方藥分類管理和轉(zhuǎn)換評價機制
自1999 年起��,我國先后發(fā)布了《處方藥與非處方藥分類管理辦法(試行)》《關(guān)于印發(fā)處方藥與非處方藥流通管理暫行規(guī)定的通知》《非處方藥注冊審批補充規(guī)定》《關(guān)于印發(fā)非處方藥說明書規(guī)范細則的通知》等規(guī)章和規(guī)范性文件��,發(fā)布了《處方藥轉(zhuǎn)換為非處方藥評價指導(dǎo)原則(試行)》《非處方藥適應(yīng)癥范圍確定原則》《含毒性藥材中成藥轉(zhuǎn)換為非處方藥評價處理原則》《乙類非處方藥確定原則》《非處方藥適應(yīng)癥范圍(中成藥部分)》《非處方藥適應(yīng)癥范圍(化學(xué)藥品部分)》《處方藥轉(zhuǎn)換非處方藥申請資料及要求》等藥品分類管理技術(shù)文件��,明確了處方藥與非處方藥分類管理制度內(nèi)容��,確定根據(jù)藥品品種��、規(guī)格��、適應(yīng)癥��、劑量及給藥途徑不同��,對藥品分別按處方藥與非處方藥進行管理��,并根據(jù)藥品的安全性��,對非處方藥進一步分為甲��、乙兩類��。
非處方藥的技術(shù)評價工作��,在過去的20 多年中具體經(jīng)歷了遴選與轉(zhuǎn)換兩大階段��。1999 年發(fā)布第一批非處方藥目錄��,2004年以前是由政府部門組織專家進行非處方藥遴選��;2004 年開始按照原國家食品藥品監(jiān)督管理局藥品分類管理的具體要求開展處方藥與非處方藥轉(zhuǎn)換工作��。截至2022 年10 月,國家遴選和轉(zhuǎn)換非處方藥品共計5056 個(按品規(guī)計)��,包括化學(xué)藥1086 個��,中成藥3970 個[2]��。
2020 年��, 新修訂的《藥品注冊管理辦法》發(fā)布��, 其中第三十六條明確規(guī)定了可以直接提出非處方藥上市許可申請的情形��,第三十八條規(guī)定了非處方藥上市許可申請審評時��,還應(yīng)當(dāng)轉(zhuǎn)藥品評價中心進行非處方藥適宜性審查��。藥品注冊申請符合要求的��,藥品上市后將直接認(rèn)定為非處方藥��。2023 年9 月27 日��,國家市場監(jiān)督管理總局公布的《藥品經(jīng)營和使用質(zhì)量監(jiān)督管理辦法》(自2024 年1 月1 日起施行)��,規(guī)定經(jīng)營處方藥��、甲類非處方藥者��,應(yīng)當(dāng)按規(guī)定配備與經(jīng)營范圍和品種相適應(yīng)的依法經(jīng)過資格認(rèn)定的藥師或者其他藥學(xué)技術(shù)人員��。只經(jīng)營乙類非處方藥者,可以配備經(jīng)設(shè)區(qū)的市級藥品監(jiān)督管理部門組織考核合格的藥品銷售業(yè)務(wù)人員��。
1.2 中藥處方藥與非處方藥分類管理和轉(zhuǎn)換評價機制
總體分析我國處方藥與非處方藥分類管理的政策文件和技術(shù)要求,可以發(fā)現(xiàn)我國從第一批遴選的非處方藥開始��,中藥非處方藥只遴選了中成藥��。藥品管理法律法規(guī)中一直沒有對中藥飲片的處方藥與非處方藥管理屬性進行明確規(guī)定��。根據(jù)當(dāng)時相關(guān)文件和報道��,暫不遴選中藥飲片的原因如下:中成藥是祖國醫(yī)藥遺產(chǎn)的重要組成部分��,是我國歷代醫(yī)學(xué)家經(jīng)過千百年來的臨床經(jīng)驗總結(jié)出的有效方劑��,多半以湯劑(即水煎成的湯藥)來治療各類病癥��。隨著制劑技術(shù)的發(fā)展,中藥除了傳統(tǒng)劑型(如丸劑��、散劑��、煎劑等)外��,又研制出糖漿劑��、片劑、顆粒劑��、膠囊劑等新劑型��,服用時更為方便��,能達到吸收好��、療效高的目的。選用中成藥為非處方藥��,能更好地發(fā)揮自我醫(yī)(藥)療的作用��。中藥飲片是組成中藥處方的藥材原料,患者患病后需經(jīng)醫(yī)生望、聞、問��、切的診斷后開方��,將中藥飲片配方后煎成湯藥服用來治病��。若離開醫(yī)生開處方和藥店專業(yè)人員按處方抓藥的流程��,患者將無法完全解決自我藥療的問題��。因此��,第一批非處方藥目錄中的中藥只收載中成藥��,暫不收載中藥飲片[3]��。
正是因為現(xiàn)在非處方藥目錄中沒有收載中藥飲片��,按照處方藥與非處方藥分類管理制度,藥品分類管理采用排除法��,即遴選和轉(zhuǎn)換進入國家非處方藥目錄的為非處方藥,其余藥品均按照處方藥進行管理��。所有中藥飲片在藥品經(jīng)營中應(yīng)按照處方藥進行管理。但是綜合分析中藥飲片內(nèi)在的安全��、有效和質(zhì)量可控屬性,絕大多數(shù)中藥飲片的安全性和用藥風(fēng)險并不及處方藥的級別��。將所有中藥飲片界定為處方藥��,并不符合藥品安全風(fēng)險管理的基本原則��。
2023 年1 月��,國家藥監(jiān)局發(fā)布《關(guān)于進一步加強中藥科學(xué)監(jiān)管促進中藥傳承創(chuàng)新發(fā)展的若干措施》��,提出要完善中藥處方藥與非處方藥分類管理��,優(yōu)化非處方藥上市注冊與上市后轉(zhuǎn)換相關(guān)技術(shù)指導(dǎo)原則體系和要求��,規(guī)范開展中藥處方藥轉(zhuǎn)換為非處方藥技術(shù)評價��,研究制定中藥非處方藥審評技術(shù)要求[4]。處方藥與非處方藥分類管理制度實施20 多年��,中藥非處方藥目錄只收載中成藥的問題需要重新考慮��,構(gòu)建和完善中藥飲片處方藥與非處方藥分類管理體系工作應(yīng)當(dāng)盡快列入《處方藥與非處方藥分類管理辦法》修訂的工作范疇��。
2��、中藥飲片分類管理面臨的問題與挑戰(zhàn)
中藥飲片處方藥與非處方藥管理缺乏系統(tǒng)明確的法律法規(guī)規(guī)定。如果長期不明確中藥飲片的分類管理屬性或者把所有中藥飲片都按照處方藥進行管理��,可能在監(jiān)管實踐中會面臨諸多問題和挑戰(zhàn)��。
2.1 中藥飲片分類管理政策執(zhí)行處于兩難困境
醫(yī)藥實踐中無處方銷售中藥飲片的現(xiàn)象時有發(fā)生��。如果將所有的中藥飲片都界定為處方藥��,可能導(dǎo)致行業(yè)大面積不合規(guī)現(xiàn)象存在,政策執(zhí)行將處于兩難境地��。如果嚴(yán)格執(zhí)行必須憑處方銷售中藥飲片,可能會影響公眾用藥可及性和實施自我藥療��,也不完全符合《藥品管理法》第五十一條規(guī)定的藥品監(jiān)管部門實施藥品經(jīng)營許可“還應(yīng)當(dāng)遵循方便群眾購藥的原則”的要求��;如果不執(zhí)行必須憑處方銷售中藥飲片,會造成政策規(guī)定得不到廣泛有效遵守,影響國家政策法規(guī)的科學(xué)性��、規(guī)范性和嚴(yán)肅性。
2.2 監(jiān)管實踐中出現(xiàn)監(jiān)管難��、處罰難��、執(zhí)行難等問題
中藥飲片的處方藥與非處方藥管理缺乏系統(tǒng)明確規(guī)定��,職業(yè)打假人常以此舉報藥品零售企業(yè)超范圍經(jīng)營中藥飲片、違規(guī)銷售處方藥��、開架銷售中藥飲片等問題,藥品經(jīng)營企業(yè)和消費者或打假人對所爭議中藥產(chǎn)品在處方藥與非處方藥分類界定上認(rèn)識不一致��,容易引發(fā)爭議或糾紛��。同時,藥品監(jiān)管部門對這類案子的定性和處罰也會存有困難��。比如,藥品零售企業(yè)無處方銷售香菇��、木耳��、靈芝��、人參��、山楂��、黃芪、生姜��、白茅根、菊花��、薏苡仁、甘草、花椒等普通中藥飲片��,如果按照超范圍經(jīng)營藥品和無處方銷售處方藥進行嚴(yán)格處罰��,在某種程度上不能體現(xiàn)“過罰相當(dāng)原則”[5]��。監(jiān)管實踐和司法實踐中也可能因此出現(xiàn)處罰難、執(zhí)行難等問題��,并容易引發(fā)新的糾紛或司法訴訟。
2.3 社會多方呼吁明確和調(diào)整相關(guān)規(guī)定
不少專家學(xué)者曾提出加強中藥飲片分類管理,將如藥食兩用類等低風(fēng)險��、安全有效的中藥飲片按照非處方藥進行管理��,健全法律法規(guī)和制度體系��,加強中藥飲片質(zhì)量管理和監(jiān)督[6]��。2021年,某藥品經(jīng)營企業(yè)向藥品監(jiān)管部門申請��,希望將精制包裝中藥飲片按非處方中成藥管理銷售[7]��。甘肅��、福建等省級藥品監(jiān)督管理局曾就放開藥食同源等中藥飲片開架銷售發(fā)布過相關(guān)通知或意見,允許零售藥店經(jīng)營少量藥食同源��、滋補中藥材以及地方習(xí)用的單味中藥飲片開架銷售,允許進入藥食同源目錄的精包裝中藥飲片可不憑處方開架銷售[8-9]��。2019 年,國家藥監(jiān)局就全國工商聯(lián)提出的“關(guān)于藥食同源目錄范圍內(nèi)中藥飲片單品允許開架銷售的提案”也曾給出明確答復(fù)��,明確對于藥食同源目錄范圍內(nèi)的產(chǎn)品��,應(yīng)本著既方便群眾購買又保證藥品使用安全的原則進行管理��;如果僅是簡單的凈制��、切片��、包裝��,且包裝標(biāo)簽上不標(biāo)明“炮制規(guī)范��、功能主治��、用法用量”��,就可以按照“中藥材”進行分類��、管理��,藥店可開架銷售��,群眾在藥店選購時無需處方即可購買[10]��?�?v觀國際上與我國中藥飲片有一定可類比性的“植物藥”或“草藥”��,大多是根據(jù)其安全性和風(fēng)險程度按照處方藥��、非處方藥和天然健康產(chǎn)品進行分類管理��。日本漢方藥也是依據(jù)風(fēng)險程度分為醫(yī)療用漢方制劑和一般用漢方制劑進行分類管理��。明確中藥飲片按照處方藥與非處方藥進行分類管理��,并制定目錄和轉(zhuǎn)換機制��,符合社會客觀需要��。
3��、問卷調(diào)查與分析
為系統(tǒng)調(diào)研中藥飲片處方藥與非處方藥分類管理政策和調(diào)整方案��,本研究團隊對中藥飲片處方藥與非處方藥分類管理政策進行了調(diào)查問卷研究��。
3.1 問卷基本情況說明
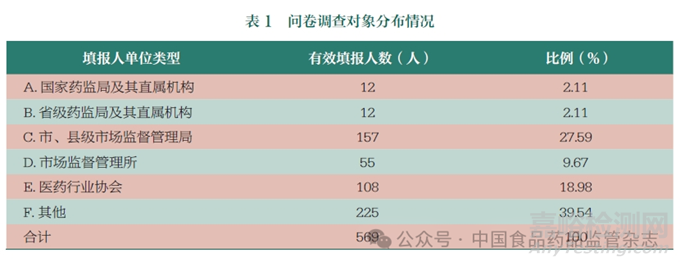
本課題組在專家研討和文獻研究基礎(chǔ)上��,確定了中藥飲片處方藥與非處方藥分類管理政策相關(guān)問卷��,涉及“單味中藥飲片分類管理方案”“中藥飲片復(fù)方分類管理方案”“精制包裝中藥飲片分類管理方案”“小劑量精制包裝中藥飲片開架銷售政策”“藥食同源中藥飲片分類管理方案”“藥食同源中藥飲片的經(jīng)營管理要求”6個問題��。問卷調(diào)查采用線上發(fā)放問卷星的方式��,針對性發(fā)送到藥品檢查員��、藥品流通相關(guān)行業(yè)協(xié)會和藥品流通企業(yè)��, 共收集到569 份問卷��。調(diào)查對象覆蓋了北京、江蘇��、廣東等31 個?�。ㄗ灾螀^(qū)��、直轄市)。單位包括國家藥監(jiān)局及其直屬機構(gòu)��,省級藥監(jiān)局及其直屬機構(gòu)��,市��、縣級市場監(jiān)督管理局��,市場監(jiān)督管理所��,醫(yī)藥行業(yè)協(xié)會��,藥品經(jīng)營企業(yè)��。被調(diào)查的企業(yè)背景描述性統(tǒng)計見表 1。問卷填報的569 人中��,有藥品檢查員236 人��,醫(yī)藥行業(yè)協(xié)會人員108 人��,藥品經(jīng)營企業(yè)的管理人員或藥師225 人��。
3.2 單味中藥飲片分類管理政策與調(diào)整方案
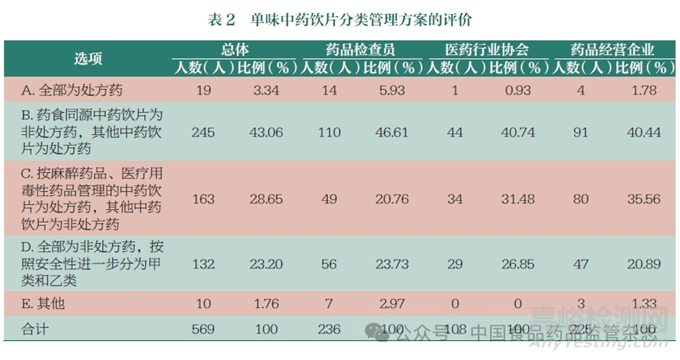
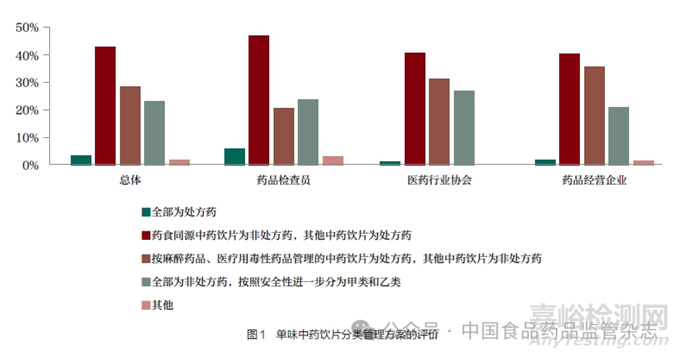
我國非處方藥目錄中未收載中藥飲片��,實踐中認(rèn)為中藥飲片是處方藥��。從本次問卷情況來看��,藥品檢查員��、醫(yī)藥行業(yè)協(xié)會和藥品經(jīng)營企業(yè)認(rèn)同這種管理方式的人員很少��,其中認(rèn)同比例最高的藥品檢查員��,也只有5.93%��,總體上只有3.34% 的人員認(rèn)為中藥飲片可以全部按處方藥進行管理��。43.06% 的人員認(rèn)為可以將藥食同源中藥飲片確定為非處方藥��,其他中藥飲片為處方藥;28.65% 的人員(藥品檢查員只有20.76%��,而藥品經(jīng)營企業(yè)達到35.56%)認(rèn)為可以將按麻醉藥品��、醫(yī)療用毒性藥品管理的中藥飲片作為處方藥��,其他中藥飲片為非處方藥��;23.20% 的人員認(rèn)為可以將中藥飲片全部按非處方藥進行管理��,并按照安全性進一步分為甲類和乙類(表 2 和圖1)��。由此可見��,雖然對中藥飲片的管理屬性有一定分歧��,但是絕大多數(shù)人員都認(rèn)為從中藥飲片的內(nèi)在安全風(fēng)險屬性來分析��,將中藥飲片全部按處方藥進行管理��,并不符合科學(xué)監(jiān)管的要求��,應(yīng)該進一步按照中藥飲片的內(nèi)在安全風(fēng)險和藥品分類管理原則��,對中藥飲片進一步開展處方藥與非處方藥分類管理��。
3.3 中藥飲片復(fù)方分類管理政策與調(diào)整方案
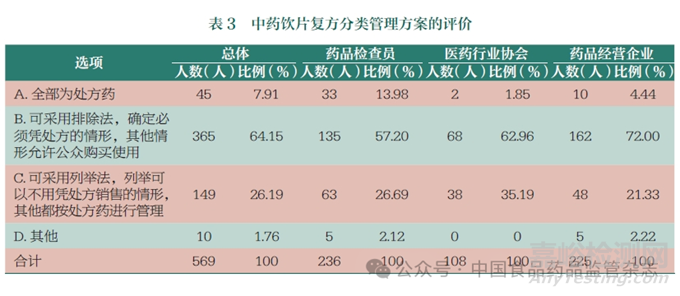
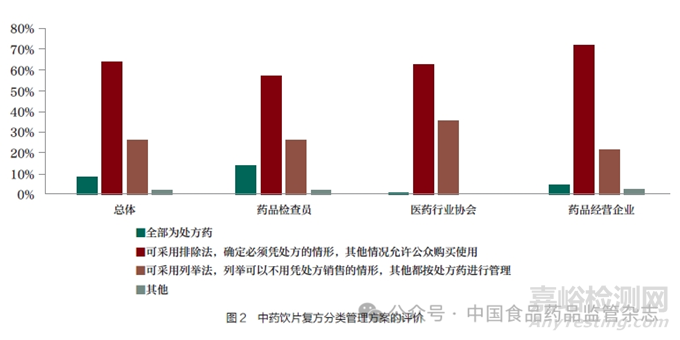
通過調(diào)查問卷發(fā)現(xiàn)��,即使針對中藥飲片復(fù)方��,認(rèn)為應(yīng)全部按處方藥管理的比例��,在總體上也只有7.91%��,3 個具體領(lǐng)域的人員對這個問題的認(rèn)識和評價差異比較大��;13.98% 藥品檢查員認(rèn)為可以全部為處方藥��,但藥品經(jīng)營企業(yè)中認(rèn)為全部按處方藥管理的只有4.44%��,醫(yī)藥行業(yè)協(xié)會的人員持相同觀點的就更少了��, 比例只有1.85%��。絕大多數(shù)人員認(rèn)為“可采用排除法��,確定必須憑處方的情形��, 其他情形允許公眾購買使用”��,總體上有64.15% 支持這一觀點��, 藥品檢查員、醫(yī)藥行業(yè)協(xié)會和藥品經(jīng)營企業(yè)持相應(yīng)觀點的比例分別是57.20%��、62.96% 和72.00%��。支持“ 可采用列舉法��,列舉可以不用憑處方銷售的情形��,其他都按處方藥進行管理”的群體也有一定的比例��,總體上是26.19%��, 藥品檢查員��、醫(yī)藥行業(yè)協(xié)會和藥品經(jīng)營企業(yè)持相應(yīng)觀點的比例分別是26.69%��、35.19% 和21.33%( 表3 和圖2)��。
3.4 精制包裝中藥飲片分類管理政策與調(diào)整方案
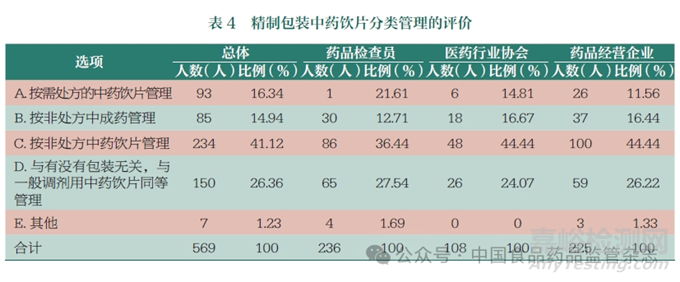
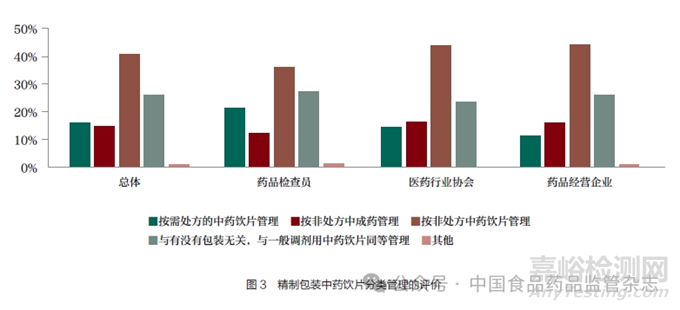
精制包裝中藥飲片��,是指選用道地藥材��,按照傳統(tǒng)炮制方法加工并采用罐��、盒或袋整體包裝銷售的精選中藥飲片��。2021 年7月��,湖北省藥品監(jiān)督管理局針對某藥房連鎖有限公司申請將精制包裝中藥飲片按非處方中成藥管理銷售的答復(fù)中��,明確中藥飲片如果屬于尚未實行批準(zhǔn)文號管理的滋補保健類中藥材可以開架銷售��,且不需要取得藥品經(jīng)營許可證��;如果屬于定型包裝的藥食同源中藥飲片��,可以不按照中藥處方調(diào)劑開架銷售��。同時湖北省發(fā)布了《湖北省社會藥房監(jiān)督管理辦法(試行)》《湖北省社會藥房質(zhì)量和服務(wù)管理指南(試行)》等��,明確對定型包裝中藥飲片可以不配備中藥飲片斗柜等設(shè)施陳列��,但涉及非藥食同源中藥飲片要憑處方調(diào)劑和銷售��。本次對精制包裝中藥飲片的分類管理方案的調(diào)研��,41.12% 的人員認(rèn)為可按非處方中藥飲片管理��,26.36% 的人員認(rèn)為與有沒有包裝無關(guān)��,精制包裝也與一般調(diào)劑用中藥飲片同等管理(表4 和圖3)��。另外,認(rèn)為按需處方的中藥飲片管理和按非處方中成藥管理的人員占比均在15% 左右��。
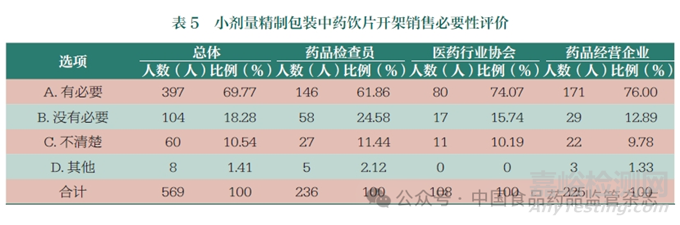
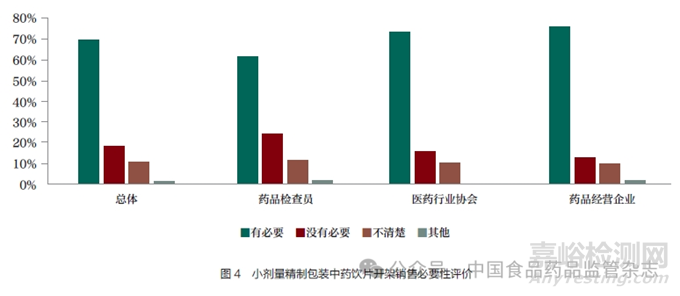
對于小劑量( 小于50g)的��、不屬于麻醉藥品和醫(yī)療用毒性藥品的精制包裝中藥飲片��,有69.77% 的人員認(rèn)為有必要在政策上允許藥品零售企業(yè)開架銷售��,其中藥品檢查員支持“藥品零售企業(yè)開架銷售”的比例相對較低��,但也超過了六成��,達到61.86%(表 5 和圖4)��。
3.5 藥食同源中藥飲片分類管理政策與調(diào)整方案
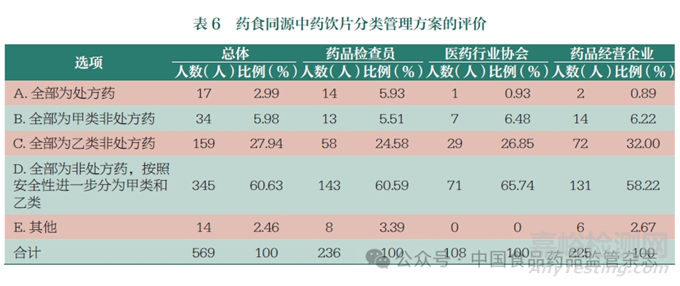
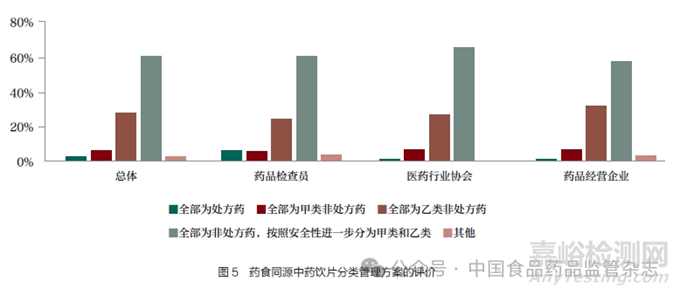
按照傳統(tǒng)既是食品又是中藥材的列入“食藥物質(zhì)目錄”的藥食同源中藥材和中藥飲片��,前幾年各地爭議比較多��,藥品經(jīng)營企業(yè)界對藥食同源產(chǎn)品開架銷售的政策訴求比較強烈��,江西��,北京��、甘肅��、蘇州��、常州��、福州等地出臺政策��,放寬藥店中藥飲片經(jīng)營��,允許開架銷售藥食同源品種��。部分省市先后提出支持藥食同源產(chǎn)品開架銷售��,允許進入藥食同源目錄的精包裝中藥飲片可不憑處方開架銷售��。零售藥店僅銷售藥食同源類的定型包裝中藥飲片��,且不進行處方飲片調(diào)配的��,經(jīng)縣級以上藥品監(jiān)管部門同意��,在過渡期(2025 年底前)��,可暫不配備執(zhí)業(yè)中藥師和中藥飲片藥柜��,但應(yīng)配備中藥學(xué)技術(shù)人員��,其經(jīng)營范圍標(biāo)注為“僅限定型包裝中藥飲片”。本次調(diào)查結(jié)果顯示��,藥食同源中藥飲片的分類管理方案��,60.63% 的人員認(rèn)為可全部為非處方藥��,并按照安全性進一步分為甲類和乙類��,甚至有27.94%的人員認(rèn)為應(yīng)全部為乙類非處方藥(表6 和圖5)��。
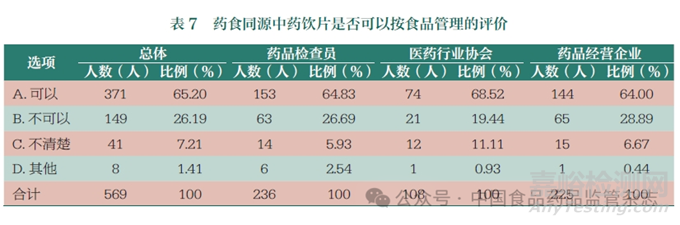
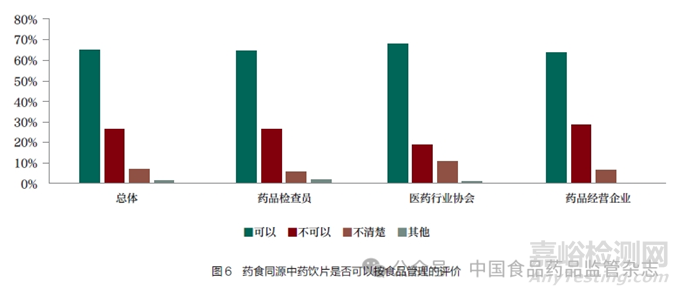
對藥食同源中藥飲片(不屬于麻醉藥品��、醫(yī)療用毒性藥品)的經(jīng)營管理要求��,65.20% 的人員認(rèn)為可以按食品管理��,26.19% 認(rèn)為不能按食品管理(表7 和圖6)��。
4��、典型案例分析
藥品零售企業(yè)的藥品經(jīng)營活動中��,除了典型多發(fā)的無處方銷售處方藥��、藥師不在崗銷售處方藥��、銷售處方藥沒有留存處方憑證��、沒有制作或者偶爾制作處方藥銷售臺賬等經(jīng)營問題以外��,銷售中藥飲片還存在更為復(fù)雜的制度和機制層面的問題?�,F(xiàn)列舉部分典型案例��,進一步分析中藥分類管理特殊問題��。
4.1 藥房違規(guī)銷售毒性中藥飲片
最高人民法院于2022 年4月28 日發(fā)布10 個涉藥品安全的刑事��、行政和民事典型案例��,其中案例八——鐘某某��、杜某甲��、杜某乙與某藥房��、袁某某生命權(quán)糾紛案��,是關(guān)于藥房違規(guī)銷售中藥飲片導(dǎo)致患者死亡的案例[11]��。具體的案情:杜某某于2017 年7 月6 日到某藥房購買香加皮150g,并于當(dāng)晚將150g 香加皮煎水服用��,出現(xiàn)胸悶��、惡心��、嘔吐��,被家人送往醫(yī)院��,經(jīng)搶救無效死亡��。市場和質(zhì)量監(jiān)督管理部門委托檢驗機構(gòu)對涉案的香加皮抽樣檢驗��,檢驗結(jié)果為質(zhì)量合格產(chǎn)品��。某司法鑒定研究所出具《尸檢鑒定意見書》��,證明杜某某符合過量服用香加皮導(dǎo)致中毒致死��,為死亡的主要原因��;其自身所患冠心病的潛在疾病對死亡起輔助促進作用��。杜某某的妻子鐘某某��,兒子杜某甲、杜某乙以某藥房在無執(zhí)業(yè)醫(yī)師��、營業(yè)員無上崗證的情況下出售香加皮給杜某某而未告知煎服方法及注意事項導(dǎo)致其中毒死亡為由訴至法院��,要求某藥房及其股東袁某某承擔(dān)侵權(quán)責(zé)任��。
法院經(jīng)審理認(rèn)為��,《藥品管理法》(2015 年修正)第十九條規(guī)定“藥品經(jīng)營企業(yè)銷售藥品必須準(zhǔn)確無誤��,并正確說明用法��、用量和注意事項……”��。鑒定報告指出杜某某主要因為過量服用香加皮中毒致死��,某藥房是香加皮銷售方��,《藥品經(jīng)營質(zhì)量管理規(guī)范》(2016 年修正)第一百六十七條規(guī)定“銷售藥品應(yīng)當(dāng)符合以下要求:(四)銷售中藥飲片做到計量準(zhǔn)確��,并告知煎服方法及注意事項��;提供中藥飲片代煎服務(wù)��,應(yīng)當(dāng)符合國家有關(guān)規(guī)定��。”某藥房在銷售香加皮時負有告知杜某某煎服香加皮的方法及注意事項的義務(wù)��,現(xiàn)有證據(jù)不足以證明某藥房盡到了告知義務(wù)��,某藥房負有告知義務(wù)而未作為��,具有過錯��,構(gòu)成侵權(quán)��;本案的損害結(jié)果是杜某某的死亡��,某藥房的過錯行為與杜某某的死亡具有因果聯(lián)系��,某藥房應(yīng)當(dāng)承擔(dān)過錯責(zé)任��,判決藥房和杜某某應(yīng)各承擔(dān)50% 的責(zé)任��。
從該案件可以發(fā)現(xiàn)��,實踐中違規(guī)銷售處方藥��,無處方銷售中藥飲片現(xiàn)象常見��。將所有中藥飲片和中藥材都作為處方藥會出現(xiàn)大量的違規(guī)銷售中藥飲片處方藥的違法案件��。但將所有中藥飲片都作為非處方藥也不合適,毒性中藥飲片等不宜自我藥療的品種必須作為處方藥進行管理��。
4.2 超范圍經(jīng)營中藥飲片案件的處罰
2022 年2 月25 日��,某區(qū)市場監(jiān)督管理局執(zhí)法人員對某藥店進行日常監(jiān)督檢查��,在該藥店陰涼區(qū)儲存藥品的抽屜內(nèi)發(fā)現(xiàn)7 罐三七粉和5 罐西洋參��。經(jīng)初步核查��,該藥店辦理有藥品經(jīng)營許可證��,無中藥飲片經(jīng)營范圍��。當(dāng)事人將上述中藥飲片置于經(jīng)營場所陰涼區(qū)的貨架抽屜內(nèi)��,涉嫌違反了《藥品流通監(jiān)督管理辦法》第十七條第二款“藥品經(jīng)營企業(yè)應(yīng)當(dāng)按照《藥品經(jīng)營許可證》許可的經(jīng)營范圍經(jīng)營藥品”的規(guī)定��,執(zhí)法人員依法對上述三七粉和西洋參采取了扣押的強制措施��,并決定立案調(diào)查��。
后經(jīng)查證��,涉事藥房共購進了11 筆中藥飲片(含上述三七粉和西洋參)��,進銷存管理系統(tǒng)均未查到入庫及銷售記錄��,當(dāng)事人也無法提供銷售臺賬��,無法查清對外銷售數(shù)額��,違法所得無法計算��, 貨值金額為1617.50 元��。當(dāng)事人的上述行為��,違反了《藥品流通監(jiān)督管理辦法》第十七條第二款“藥品經(jīng)營企業(yè)應(yīng)當(dāng)按照《藥品經(jīng)營許可證》許可的經(jīng)營范圍經(jīng)營藥品”的規(guī)定��,應(yīng)按照2019 年修訂的《藥品管理法》第一百一十五條“未取得藥品生產(chǎn)許可證��、藥品經(jīng)營許可證或者醫(yī)療機構(gòu)制劑許可證生產(chǎn)��、銷售藥品的��,責(zé)令關(guān)閉��,沒收違法生產(chǎn)��、銷售的藥品和違法所得��,并處違法生產(chǎn)、銷售的藥品(包括已售出和未售出的藥品��,下同)貨值金額十五倍以上三十倍以下的罰款��;貨值金額不足十萬元的��,按十萬元計算”的規(guī)定��。但是最后監(jiān)管部門鑒于當(dāng)事人涉案數(shù)量較少��,社會危害性較小��,決定對其減輕處罰��,沒收涉案中藥飲片��,罰款10 000 元[12]��。
該案件的啟示��,藥品零售企業(yè)無處方或者超范圍銷售中藥飲片現(xiàn)象常見��,如果按照2019 年修訂的《藥品管理法》進行處罰��,難以執(zhí)行��,并容易引發(fā)進一步糾紛和訴訟��。有必要從平衡藥品安全和方便群眾購藥的關(guān)系��,對中藥飲片和中藥材做科學(xué)分類管理��,需平衡好中藥安全管理和方便群眾購藥的關(guān)系��,提升中藥流通監(jiān)管政策的科學(xué)性��、規(guī)范性��、嚴(yán)肅性��。
5��、政策建議
中藥處方藥與非處方藥分類管理缺乏系統(tǒng)明確的專門規(guī)定��,亟需進一步完善中藥飲片處方藥與非處方藥分類管理制度��?�!短幏剿幣c非處方藥分類管理辦法》修訂中��,建議充分考慮中藥在處方藥與非處方藥分類管理中的特殊性��,對中藥分類管理作為單獨一章進行專門規(guī)定,在其中除完善已有的中成藥分類管理制度外��,進一步系統(tǒng)考慮中藥飲片管理的特殊性��,對中藥飲片分類管理做系統(tǒng)和具體的科學(xué)規(guī)定��。
5.1 單味中藥飲片的分類管理
從中藥飲片的內(nèi)在安全風(fēng)險屬性和實踐要求來分析��,將中藥飲片全部按處方藥進行管理��,不符合藥品分類管理原則和要求��,也不符合科學(xué)監(jiān)管的要求��,應(yīng)該進一步按照中藥飲片的內(nèi)在安全風(fēng)險和藥品分類管理原則要求��,對中藥飲片進一步科學(xué)管理��,將中藥飲片分為處方藥與非處方藥管理��。“是藥三分毒”��,有必要將按麻醉藥品��、醫(yī)療用毒性藥品管理的中藥飲片確定為處方藥��;把納入《實施審批管理的中藥飲片目錄》的中藥飲片和治療急癥��、重癥以及消費者不宜自我藥療的中藥飲片列為處方藥��;其他中藥飲片根據(jù)安全性進一步評價轉(zhuǎn)換為甲類非處方藥或乙類非處方藥��。
5.2 中藥配方顆粒的分類管理
中藥配方顆粒是由單味中藥飲片經(jīng)水提��、分離��、濃縮��、干燥��、制粒而成的顆粒��,在中醫(yī)藥理論指導(dǎo)下��,按照中醫(yī)臨床處方調(diào)配后��,供患者沖服使用��。中藥配方顆粒的質(zhì)量監(jiān)管納入中藥飲片管理范疇��,不實施批準(zhǔn)文號管理,實施標(biāo)準(zhǔn)管理��、備案管理��,產(chǎn)品需向省級藥品監(jiān)管部門備案后方可上市��。按照《國家藥監(jiān)局 國家中醫(yī)藥局 國家衛(wèi)生健康委 國家醫(yī)保局關(guān)于結(jié)束中藥配方顆粒試點工作的公告》��,中藥配方顆粒不得在醫(yī)療機構(gòu)以外銷售[13]��。為此��,建議對實施品種備案管理的中藥配方顆粒確定為處方藥��。
5.3 中藥飲片復(fù)方的分類管理
中藥飲片復(fù)方不是簡單的單味中藥飲片的幾何數(shù)量加減��,中藥以毒攻毒的法則顯示中藥并非都是溫和而緩效的��,中藥各味處方的配伍也都是有考究和有專業(yè)要求��。中藥飲片復(fù)方分類管理需要考慮更多因素��。中藥飲片復(fù)方管理��,參照上面的調(diào)查研究結(jié)果��,建議采用排除法��,確定必須憑處方的情形��,其他情形可以按照非處方藥管理��。具體排除條件��,可以參考目前的中成藥分類管理的結(jié)果��,總結(jié)出一套中藥飲片復(fù)方管理的經(jīng)驗��,確定必須憑處方的情形��。例如��,含處方藥的��,中西藥聯(lián)合使用的��,日服用量超過標(biāo)準(zhǔn)規(guī)定范圍的��,兒科用藥的��,妊娠期��、哺乳期用藥的,療程超過7 天的��,大面積外用藥等��。
5.4 條文修訂建議
完善中藥飲片處方藥與非處方藥分類管理��,結(jié)合上面的分析和建議方案��,建議《處方藥與非處方藥分類管理辦法》修訂時能體現(xiàn)以下條文內(nèi)容��。
第一��,中藥飲片實行處方藥與非處方藥分類管理制度��。
第二��,有下列情形之一的��,納入處方藥管理:①按麻醉藥品��、醫(yī)療用毒性藥品管理的��;②納入《實施審批管理的中藥飲片目錄》的��;③實施品種備案管理的中藥配方顆粒��;④治療急癥、重癥所需的��;⑤其他不宜自我藥療的��。
第三��,有下列情形之一的中藥飲片復(fù)方��,應(yīng)憑處方銷售和調(diào)配:①處方中含毒性藥味或處方藥��;②中西藥聯(lián)合使用��;③用法��、用量超過《中國藥典》規(guī)定標(biāo)準(zhǔn)��;④兒科用藥��;⑤妊娠期��、哺乳期用藥��;⑥療程超過7 天的��;⑦大面積外用藥��;⑧國務(wù)院規(guī)定的其他情形��。
6��、結(jié) 語
中藥處方藥與非處方藥分類管理缺乏系統(tǒng)明確的專門規(guī)定��,制度缺乏統(tǒng)一性和系統(tǒng)性��,在管理實踐中容易產(chǎn)生一系列問題��。為貫徹落實《“十四五”國家藥品安全及促進高質(zhì)量發(fā)展規(guī)劃》提出的“保障藥品安全��,促進藥品高質(zhì)量發(fā)展��,推進藥品監(jiān)管體系和監(jiān)管能力現(xiàn)代化��,保護和促進公眾健康”的規(guī)劃要求��,正確把握保障藥品安全與促進產(chǎn)業(yè)發(fā)展的關(guān)系��,亟需進一步完善中藥飲片處方藥與非處方藥分類管理制度��,增強分類管理體系的科學(xué)性和明確性��,提升法規(guī)和政策的執(zhí)行效果[14]��。本文是對中藥飲片處方藥與非處方藥分類管理的初步思考,后續(xù)還需要進一步結(jié)合《處方藥與非處方藥分類管理辦法》總體修訂方案統(tǒng)籌考慮��,充分考量分類管理制度的科學(xué)性��、統(tǒng)一性和協(xié)調(diào)性��,并進一步做好系統(tǒng)制度銜接��,包括與藥品分類管理總體方案��、執(zhí)業(yè)藥師配備制度��、藥品信息和廣告管理等制度銜接��,進一步完善處方藥與非處方藥制度��,提升法規(guī)和政策的執(zhí)行效果��。