隨著歐盟MDR法規(guī)的實施推進��,風險管理流程與醫(yī)療器械的其他基本流程(如設(shè)計和開發(fā)��、臨床評估��、上市后監(jiān)督等)之間的相互聯(lián)系正變得日益緊密����,而ISO/TR 24971正是使用風險管理流程提高醫(yī)療器械質(zhì)量�、安全性和有效性的寶貴工具����,被視為實施ISO 14971:2019的指南����。
本期將深入探討ISO/TR 24971����,重點介紹有效的風險管理流程實施的關(guān)鍵要求和方法,該流程符合質(zhì)量管理體系法規(guī)(如ISO 13485�、21 CFR 820)和相關(guān)的適用的法規(guī)要求(如歐盟MDR)��。
1����、ISO/TR 24971的風險分析流程
■ 預(yù)期用途描述
■ 與安全有關(guān)的醫(yī)療器械特性
■ 識別與醫(yī)療器械相關(guān)的危害和危險
■ 評估風險和危險情況
2��、ISO/TR 24971中合理可預(yù)見的誤用
醫(yī)療器械的描述應(yīng)包含“合理可預(yù)見的誤用識別”的相關(guān)內(nèi)容。
誤用被定義為“以非制造商預(yù)期的方式使用醫(yī)療器械��,但可能由易預(yù)測的人類行為導(dǎo)致”��,其可能與使用錯誤��、特定誤用或故意將醫(yī)療器械用于其他醫(yī)療目的有關(guān),例如:超出預(yù)期用途��。
誤用可能由不同的原因引發(fā)�,例如:對風險認知不佳、使用說明不夠清晰等����。
3�、ISO/TR 24971與安全有關(guān)設(shè)備特征
為幫助制造商識別危險情況下的設(shè)備特征,ISO/TR 24971 在附件A中提供完整的問題列表��,以支持識別可能影響安全的設(shè)備特征�。
4����、ISO/TR 24971識別危險的過程
識別危險是風險分析過程的第一步��。危險是潛在的傷害源�,可能與醫(yī)療器械的使用或產(chǎn)品本身(設(shè)計)有關(guān)����。
通常,醫(yī)療器械只有在發(fā)生一系列導(dǎo)致危險情況的事件時才會造成或?qū)е聜Α?/span>
與故障相關(guān)危險情況����,可設(shè)想以下不同場景:
但當未發(fā)生故障,或可能與醫(yī)療器械相關(guān)特定療法具有內(nèi)在關(guān)聯(lián)時����,也可能出現(xiàn)危險情況�。
5�、ISO/TR 24971風險評估的過程
1.每個已被識別的風險都需要根據(jù)特定風險的排名進行評估����,評估內(nèi)容如下:
· 傷害發(fā)生的概率;
· 傷害的嚴重程度�。
2.對發(fā)生概率的估計�,可使用2種不同的方法:定量和定性。當具備充足的數(shù)據(jù)�、具備充足的可信度����,用于估計傷害發(fā)生的概率時,應(yīng)使用定量方法�。否則�,定性方法的估計結(jié)果比具有高度不確定性的定量方法更為可信��。
應(yīng)高度關(guān)注無法估計發(fā)生概率的情況,例如:軟件故障或誤用情況����。
當無法估計傷害發(fā)生概率時�,有必要僅根據(jù)傷害的嚴重程度作評估風險。
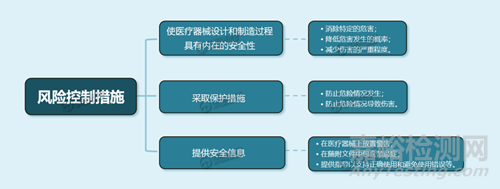
6��、ISO/TR 24971風險控制的策略
實行風險控制措施時����,優(yōu)先順序至關(guān)重要�。
有關(guān)風險控制選項的概述��,參閱以下方案:
7��、ISO/TR 24971的總體剩余風險評估
1.對整體剩余風險的評估是風險管理過程的重要時刻,包括總體剩余風險評估�,即實行風險控制措施后的風險。
2.ISO/TR 24971 提供不同的輸入��,可用作評估剩余風險的起點(包括但不限于以下情況):
· 不同的事件序列可能導(dǎo)致不同的危險情況和風險����,每種都會導(dǎo)致整體剩余風險;
· 特定的傷害可能來自不同的危險情況����;
· 對醫(yī)療器械所有操作說明進行全面審查,可能發(fā)現(xiàn)說明的不一致或難以遵循��。
3.ISO/TR 24971列出剩余風險評估的不同方法示例:
· 與醫(yī)療器械預(yù)期用途相關(guān)的收益同整體剩余風險進行權(quán)衡����;
· 剩余風險的可視化表示��;
· 與市場上可用的類似醫(yī)療器械做比較�;
· 聽取專家意見��,以支持與醫(yī)療器械預(yù)期收益相關(guān)的總體剩余風險評估��。
注意:將所有單個剩余風險相加的方式,不可能用于總體剩余風險評估����。評估總體剩余風險并無首選方法����,應(yīng)當由制造商負責確定適當?shù)姆椒ā?/span>