本文導(dǎo)讀
本文收集了美國FDA批準(zhǔn)上市鼻噴霧劑產(chǎn)品中鼻腦給藥相關(guān)產(chǎn)品的說明書信息���,并對(duì)比分析了不同品種說明書信息間的共性和差異�����,為未來國內(nèi)鼻用制劑的開發(fā)提供參考���。
1�����、 FDA說明書的主要內(nèi)容
美國FDA在藥品說明書和標(biāo)簽等方面的監(jiān)管要求較為完善,處方藥說明書由要點(diǎn)���、目錄和處方信息3個(gè)部分構(gòu)成�����。處方信息中的臨床藥理和臨床試驗(yàn)部分是新藥研發(fā)的關(guān)鍵信息�����,產(chǎn)品獲批后上市后臨床試驗(yàn)的相關(guān)信息也應(yīng)更新補(bǔ)充于說明書中��。
需注意的是,F(xiàn)DA已批準(zhǔn)的鼻腦給藥相關(guān)鼻噴霧劑產(chǎn)品中�����,特殊人群除常規(guī)的孕婦及哺乳期婦女、兒童�����、老人和肝腎功能不全人群外,還包括呼吸功能受損人群��。此外�����,產(chǎn)品說明書的最后一部分提供了詳細(xì)的藥物準(zhǔn)備、給藥��、操作、貯存和處理等信息���,并附有關(guān)于使用方法的詳細(xì)圖文解釋,便于患者了解使用��。
2、 FDA批準(zhǔn)的鼻腦給藥相關(guān)鼻噴霧劑產(chǎn)品
經(jīng)對(duì)FDA藥品數(shù)據(jù)庫檢索發(fā)現(xiàn)���,截至2023年8月�����,共有15個(gè)鼻腦給藥相關(guān)的鼻噴霧劑產(chǎn)品���。
FDA批準(zhǔn)的鼻腦給藥相關(guān)鼻噴霧劑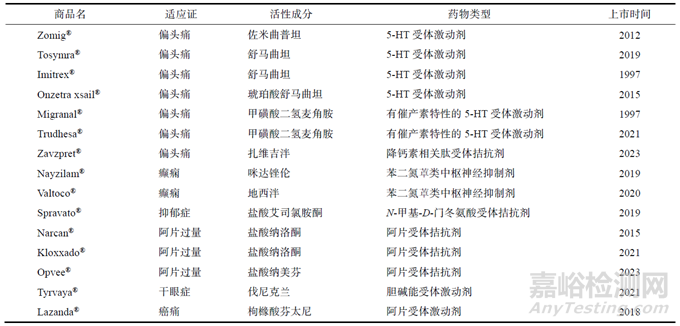
3�����、非臨床安全性評(píng)價(jià)與說明書中載錄信息
在已獲FDA批準(zhǔn)的鼻腦給藥途徑相關(guān)鼻噴霧劑產(chǎn)品中�����,1個(gè)產(chǎn)品屬于新分子實(shí)體���,1個(gè)屬于新活性成分���,其他均為已有活性成分的改劑型或新制劑/新生產(chǎn)商產(chǎn)品��。通過說明書載錄信息可以看出�����,對(duì)于不同類型的產(chǎn)品,非臨床安全性評(píng)價(jià)的策略與研究?jī)?nèi)容各有差異���。
Zavzpret®是采用新分子實(shí)體的一類NDA鼻腦給藥制劑,其非臨床評(píng)價(jià)較完整���。說明書中載錄的非臨床毒理信息包括鼻內(nèi)給藥的致癌性試驗(yàn)���、體內(nèi)和體外遺傳毒性試驗(yàn)��,在生殖毒性試驗(yàn)中為增加系統(tǒng)暴露量采用了皮下給藥。在該品種的毒性評(píng)價(jià)中���,由于鼻內(nèi)給藥后系統(tǒng)暴露量低���,因此在大鼠和猴中增加了皮下給藥途徑���,同時(shí)使用了鼻表面積歸一劑量(局部毒性)與血漿暴露系統(tǒng)毒性確定安全范圍���。
Spravato®是采用新活性成分的二類NDA鼻腦給藥制劑�����,活性成分為鹽酸艾司氯胺酮�����,其注射劑作為全身麻醉劑已有長(zhǎng)期用藥歷史�����。在Spravato®的非臨床安全性評(píng)價(jià)中包括了安全藥理學(xué)�����、大鼠與犬中的長(zhǎng)期鼻內(nèi)給藥毒性試驗(yàn)、鼻內(nèi)給藥生殖毒性評(píng)價(jià)�����、體外和體內(nèi)遺傳毒性試驗(yàn)、神經(jīng)毒性試驗(yàn)(鼻內(nèi)與皮下給藥)���、致癌性試驗(yàn)等���,其中致癌性試驗(yàn)分別使用了鼻內(nèi)給藥(大鼠)與皮下給藥(轉(zhuǎn)基因小鼠)���。
相對(duì)于新分子實(shí)體��,改劑型產(chǎn)品的非臨床評(píng)價(jià)更加遵循“具體問題具體分析(case by case)”原則�����,可以引用活性分子原劑型品種的已有信息���,但仍需要根據(jù)品種特性開展針對(duì)性評(píng)價(jià)�����。FDA《改變制劑處方和變更給藥途徑的非臨床安全性評(píng)價(jià)技術(shù)指導(dǎo)原則》中提出,對(duì)于改變給藥途徑的鼻內(nèi)給藥品種推薦進(jìn)行擬用途徑開展單次和/重復(fù)給藥毒性試驗(yàn)���,包括完全的組織病理學(xué)檢查�����,其中短期研究(2~4周)應(yīng)包括2個(gè)物種���,包括至少1種非嚙齒類��,在最合適物種中進(jìn)行長(zhǎng)期(可達(dá)6個(gè)月)研究��,具體給藥時(shí)間一般遵循ICH M3或ICH S9的建議。本文以近年批準(zhǔn)的伐尼克蘭、鹽酸納美芬為例��,分析其非臨床評(píng)價(jià)與說明書載錄信息。
鼻噴霧劑伐尼克蘭Tyrvaya®的活性成分為酒石酸伐尼克蘭。作為新分子實(shí)體,酒石酸伐尼克蘭片Chantix于2006年獲批(現(xiàn)已退市)用于尼古丁成癮的輔助治療。在Tyrvaya®的非臨床評(píng)價(jià)中���,遺傳毒性、致癌性�����、生殖毒數(shù)據(jù)均引用了Chantix的已有數(shù)據(jù),另開展了兔28 d重復(fù)經(jīng)鼻給藥��、大鼠28 d重復(fù)經(jīng)鼻給藥��、兔6個(gè)月鼻內(nèi)滴注給藥伴隨毒代分析��,并在長(zhǎng)期給藥毒性試驗(yàn)中同時(shí)評(píng)價(jià)了眼���、鼻毒性�����。
鹽酸納美芬鼻噴霧劑Opvee®的活性成分為鹽酸納美芬���,其注射劑Revex®于1995年作為NME獲批(現(xiàn)已退市)���。申請(qǐng)人在犬中評(píng)價(jià)了鼻內(nèi)給藥對(duì)心血管系統(tǒng)和呼吸系統(tǒng)的安全藥理學(xué),分析了口服(大鼠)與靜脈(兔)重復(fù)給藥的藥動(dòng)學(xué)(pharmacokinetics,PK)特征��,在犬中進(jìn)行了單次鼻內(nèi)給藥的毒性和毒代分析�����,在大鼠與犬中開展了28 d重復(fù)經(jīng)鼻給藥伴隨毒代分析,并在重復(fù)給藥試驗(yàn)中評(píng)價(jià)了局部耐受性���。通過PK數(shù)據(jù),橋接了Revex®的生殖和發(fā)育毒性數(shù)據(jù)�����,Opvee®說明書中載錄的生殖毒性數(shù)據(jù)包括了大鼠與兔口服、兔靜脈給藥數(shù)據(jù)��,未開展致癌性評(píng)價(jià)(該品為單次給藥)。由于Opvee®中使用了新輔料十二烷基麥芽糖苷���,申請(qǐng)人還根據(jù)指導(dǎo)原則開展了對(duì)新輔料的相關(guān)評(píng)價(jià),部分?jǐn)?shù)據(jù)引用自新輔料的藥物主文件(drug master file��,DMF)。
由上述分析可以發(fā)現(xiàn),對(duì)于改變給藥途徑的新制劑�����,由于靶點(diǎn)和作用機(jī)制等信息較為明確���,可以借鑒�����、引用或橋接具有相同活性成分藥品的已有研究資料�����,同時(shí)對(duì)于新的給藥途徑的新制劑則需開展必要的毒理學(xué)研究���,并評(píng)價(jià)局部刺激性��,局部刺激性評(píng)價(jià)可以在重復(fù)給藥等試驗(yàn)中伴隨開展�����。
4�����、臨床研究情況
通過對(duì)FDA批準(zhǔn)的不同類型鼻腦遞送產(chǎn)品的臨床研究開展情況的分析�����,可以看出申報(bào)類型為新分子實(shí)體及新活性成分時(shí)都進(jìn)行了相對(duì)完整的安全性和有效性研究,而在已有活性成分改劑型品種的臨床研究中��,均會(huì)引用已有制劑的研究數(shù)據(jù)�����。
新分子實(shí)體Zavzpret®說明書中詳細(xì)列出了支持其安全性和有效性的4項(xiàng)臨床研究數(shù)據(jù)?����;谄贩N對(duì)藥物本身特性��、內(nèi)在和外在影響因素進(jìn)行了有效性和安全性的綜合評(píng)價(jià)��。
對(duì)于含有新活性成分的Spravato®�����,雖然消旋體氯胺酮注射液在臨床上已被廣泛使用��,但Spravato®與原有品種在適應(yīng)證�����、劑型��、規(guī)格�����、用法用量���、給藥途徑��、使用人群等方面均不同�����,對(duì)不同角度的PK、藥效學(xué)(pharmacodynamics,PD)��、多個(gè)內(nèi)在和外在安全性影響因素均進(jìn)行了獨(dú)立的臨床藥理研究�����。Spravato®說明書中除了“藥物濫用”和“依賴性”部分引用氯胺酮注射液的已有數(shù)據(jù)外���,其余數(shù)據(jù)資料均來源于自身的臨床試驗(yàn)。
改良型新藥因具有研發(fā)風(fēng)險(xiǎn)低,回報(bào)率高和生命周期長(zhǎng)等優(yōu)勢(shì)�����,已成為新藥研發(fā)的熱點(diǎn)方向。其中��,鼻噴霧劑伐尼克蘭Tyrvaya®正是以原研藥酒石酸伐尼克蘭片的3類NDA途徑申報(bào)獲批���。該品種基于與口服制劑的相對(duì)生物等效性試驗(yàn)結(jié)果,在直接鼻內(nèi)噴霧制劑和口服制劑之間建立了PK橋接���。在該品種的臨床藥理研究中,除了上述生物利用度研究���,進(jìn)一步開展了2項(xiàng)多劑量���、隨機(jī)對(duì)照研究,對(duì)1個(gè)主要終點(diǎn)(淚試驗(yàn)評(píng)分)和2個(gè)次要終點(diǎn)(眼干燥評(píng)分���、角膜熒光素染色評(píng)分)進(jìn)行評(píng)估,以實(shí)現(xiàn)劑量探索研究并對(duì)有效性和安全性進(jìn)行了驗(yàn)證�����;還針對(duì)主要終點(diǎn)(淚試驗(yàn)評(píng)分)開展了12周的長(zhǎng)期安全性臨床評(píng)價(jià)��。
另外�����,Opvee®鼻噴霧劑和Revex®注射劑之間建立臨床數(shù)據(jù)橋接后�����,申請(qǐng)人圍繞劑量與給藥途徑、起始治療���、持續(xù)時(shí)間及穩(wěn)定阿片類藥物激動(dòng)作用下的藥物效應(yīng)開展了2項(xiàng)PK和1項(xiàng)PD研究��。
不同申報(bào)類型及同一類型但不同品種間鼻腦給藥鼻噴霧劑說明書中臨床研究數(shù)據(jù)的來源均存在差異���。具體情況與活性成分的藥理數(shù)據(jù)、已有研究的可橋接性、產(chǎn)品的安全性和風(fēng)險(xiǎn)可控性等因素有關(guān)。
5、與給藥方式相關(guān)的不良反應(yīng)
藥物在體內(nèi)的吸收��、分布和起效時(shí)間隨給藥方式的變化而變化�����,因此除藥物的藥理作用、劑量和劑型等因素外���,藥品的不良反應(yīng)也與給藥方式密切相關(guān)���。鼻腔給藥是一種非侵入式給藥方式��,但其在患者體內(nèi)的PK特性與靜脈給藥相似���,因此可作為一種注射給藥的替代方法,用來改善患者的用藥依從性���,同時(shí)可以避免與注射點(diǎn)反應(yīng)有關(guān)的不良反應(yīng)���,以舒馬曲坦為例,見下表�����。
說明書載錄的舒馬曲坦不同給藥方式的不良反應(yīng)
與口服制劑相比���,鼻腦給藥制劑的腦部靶向性更好,生物利用度更高�����,能降低藥物的肝腎毒性和全身不良反應(yīng)��,以佐米曲普坦為例,見下表�����。
說明書載錄的不同給藥方式佐米曲普坦的不良反應(yīng)
味覺異常、鼻腔不適和鼻腔/鼻竇功能紊亂等鼻腔反應(yīng)是鼻腦給藥制劑所特有的不良反應(yīng)�����。除了這些與鼻局部功能有關(guān)的不良反應(yīng)外,鼻腦給藥制劑的不良反應(yīng)一般與其已上市的注射或口服制劑產(chǎn)品相似��。
值得注意的是,與口服片劑相比���,佐米曲普坦的鼻腦制劑新增了胸痛�����、胸悶�����、胸緊和胸口沉重等心血管不良反應(yīng),但根據(jù)舒馬曲坦說明書�����,其鼻腦制劑避免了其皮下和口服劑型的相關(guān)心血管不良反應(yīng)���。
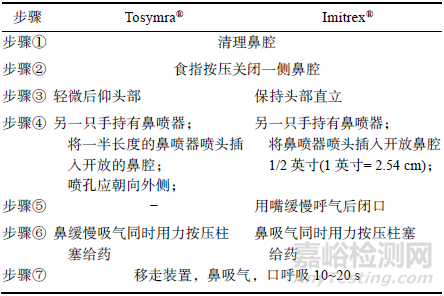
另一方面,同一藥物不同產(chǎn)品的鼻腔不良反應(yīng)存在不同���,見上表���。這可能與不同鼻噴裝置的噴霧特性有關(guān),也可能與給藥操作步驟中呼吸配合要求和噴頭朝向要求的不同有關(guān)�����,見下表。
舒馬曲坦鼻腦制劑關(guān)鍵給藥操作要求對(duì)比
6��、小結(jié)
鼻噴霧劑在技術(shù)上屬于藥械組合產(chǎn)品,與傳統(tǒng)口服制劑相比��,其給藥方式更加復(fù)雜�����,需在說明書中加入額外的裝置使用指導(dǎo)信息。本文對(duì)FDA批準(zhǔn)的鼻腦給藥途徑相關(guān)鼻噴霧劑的說明書內(nèi)容進(jìn)行了匯總分析�����,對(duì)比了不同注冊(cè)類型的非臨床和臨床研究信息內(nèi)容和不良反應(yīng),以期為未來國內(nèi)鼻腦制劑的開發(fā)及說明書撰寫提供參考�����。鼻腦制劑的研究者或注冊(cè)申請(qǐng)人在開展相關(guān)研究前,應(yīng)根據(jù)相關(guān)法規(guī)和指導(dǎo)原則進(jìn)行科學(xué)試驗(yàn)設(shè)計(jì)���,還可參考已上市同類藥品的說明書信息�����,必要時(shí)向?qū)徳u(píng)部門申請(qǐng)溝通交流�����,以制定更加科學(xué)合理的研究計(jì)劃��。
來源:鄭淇文,高靜,梅蕾蕾,崔雪子,陳一飛.美國FDA批準(zhǔn)鼻腦給藥相關(guān)的鼻噴霧劑說明書分析[J].中國現(xiàn)代應(yīng)用藥學(xué),2023,40(20):2872-2877.