目的:探究我國與加拿大在生產(chǎn)質(zhì)量管理規(guī)范體系中對中藥質(zhì)量的把控情況�����,并探索兩國中藥藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)的差異�����。
方法:對我國中藥制劑GMP文件與加拿大天然健康產(chǎn)品GMP指導(dǎo)文件進(jìn)行比較研究��,主要從指導(dǎo)文件的框架�����、方向和文件細(xì)則等方面進(jìn)行對比�����,分析我國中成藥GMP質(zhì)量管理體系與加拿大天然健康產(chǎn)品質(zhì)量規(guī)范各自的特點(diǎn)���。
結(jié)果:我國GMP文件和加拿大GMP文件在中藥產(chǎn)品的管理結(jié)構(gòu)�����、機(jī)構(gòu)和人員的設(shè)置���、中藥原材料及產(chǎn)品等方面均存在區(qū)別。
結(jié)論:我國GMP文件與加拿大GMP文件存在差異���,可為我國中藥GMP管理體系的進(jìn)一步合理應(yīng)用提供參考。
自21世紀(jì)以來��,中醫(yī)藥逐漸走出國門���,并在國際上取得了一定影響力���。加拿大作為積極引進(jìn)針灸、中藥等中醫(yī)藥技術(shù)和產(chǎn)品的國家���, 將中藥納入天然健康產(chǎn)品的范疇中�����,使得中藥在當(dāng)?shù)匕l(fā)揮治療與保健的作用[1]�����。然而�����,因中藥存在藥味數(shù)量多�����、炮制復(fù)雜��、成分多樣等特點(diǎn)[2]���,使得中藥在生產(chǎn)���、加工及應(yīng)用等流程都應(yīng)當(dāng)有專門的規(guī)定,以保證中藥的質(zhì)量和療效�����。基于此��,我國與加拿大均對中藥在生產(chǎn)���、加工及應(yīng)用方面制定了相應(yīng)的規(guī)定�����,具體規(guī)定分別是我國的《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂) 》中藥制劑附錄(以下簡稱《附錄》)[3] 和加拿大《天然健康產(chǎn)品GMP(Good Manufacturing Practice) 指導(dǎo)文件》[4]�����。本文將以上2 份規(guī)定從中藥管理規(guī)范��、框架和具體內(nèi)容進(jìn)行比較分析�����,以各部分的異同點(diǎn)來顯示兩國GMP中對中藥管理的特點(diǎn),以期能對我國中藥GMP管理體系提供參考與建議��。
1�����、兩國中藥產(chǎn)品管理法規(guī)概況
目前我國《附錄》是由原國家食品藥品監(jiān)督管理局于2011年3月1日頒布施行。在文件中��,中藥制劑附錄將中成藥與普通藥品進(jìn)行區(qū)分�����,對中藥材���、中藥提取物以及中成藥的生產(chǎn)質(zhì)量管理做出了細(xì)致要求�����,在滿足GMP主體文件的條件下進(jìn)一步強(qiáng)調(diào)按照中藥材及中成藥的特點(diǎn)對產(chǎn)品進(jìn)行約束���,能夠有效地進(jìn)行中成藥質(zhì)量控制[5]。
加拿大衛(wèi)生部則將中藥及相關(guān)制劑納入天然健康產(chǎn)品范圍進(jìn)行管理��。該范疇主要包括2020年9月28日最新修訂的《天然健康產(chǎn)品規(guī)范》(Natural Health Product Regulation) 第三部分���,同時衛(wèi)生部還發(fā)布了這部分對應(yīng)的解讀文件《天然健康產(chǎn)品GMP 指導(dǎo)文件》(以下簡稱《指導(dǎo)文件》)[6]�����,由這2份文件共同對天然健康產(chǎn)品的質(zhì)量進(jìn)行規(guī)范管理��。由于加拿大當(dāng)?shù)貙μ烊唤】诞a(chǎn)品進(jìn)行了專門的定義�����,并規(guī)定其管理貼近非處方藥但是不作為藥物來對待�����,因此對于中藥產(chǎn)品的生產(chǎn)質(zhì)量管理方面與普通藥品的GMP作出了區(qū)分[7]��。
2��、兩國中藥產(chǎn)品管理結(jié)構(gòu)比較
我國《附錄》共計(jì)十四個章節(jié)三百一十三條法規(guī)�����,包括范圍�����、原則��、機(jī)構(gòu)與人員等部分��,主要特點(diǎn)是劃分中藥產(chǎn)品的類型���,如中藥原材���、中藥提取以及中藥制劑,針對不同類型的中藥產(chǎn)品規(guī)定了從該類型產(chǎn)品生產(chǎn)過程中的各組成要素出發(fā)���,分析這些要素在生產(chǎn)階段的重要程度以及所發(fā)揮的作用[8]�����,進(jìn)而得出該類型中藥產(chǎn)品在生產(chǎn)全階段中應(yīng)當(dāng)注意的環(huán)節(jié)和可能存在的問題���。
加拿大《指導(dǎo)文件》全文包括概述、天然健康產(chǎn)品GMP規(guī)范條例及其意圖與要求�����、參考文獻(xiàn)���、術(shù)語表與附錄���,同時《指導(dǎo)文件》有較多介紹說明條目��, 提出要求詳細(xì)明確���,部分以具體參數(shù)與限制條件作為證據(jù)示例, 對于生產(chǎn)企業(yè)來說具有很強(qiáng)的參考性��?����!吨笇?dǎo)文件》核心內(nèi)容是第二部分��,它對一般天然健康產(chǎn)品GMP規(guī)范條例��,包括場所�����、人員�����、過程���、產(chǎn)品4個章節(jié)��,與我國《附錄》相比邏輯與結(jié)構(gòu)不協(xié)調(diào)���。此外,《指導(dǎo)文件》附錄1對由多種有毒原料構(gòu)成的順勢療法藥物GMP進(jìn)行補(bǔ)充�����,規(guī)定順勢療法藥物除了滿足第二部分GMP的要求以外��,還需要滿足附錄1中的規(guī)定[9]��。
3���、兩國GMP內(nèi)容的比較
3.1機(jī)構(gòu)和人員的比較
在機(jī)構(gòu)和人員方面��,我國GMP在總體層面上要求生產(chǎn)企業(yè)應(yīng)當(dāng)建立與藥品生產(chǎn)相適應(yīng)的管理機(jī)構(gòu)并有相應(yīng)的組織機(jī)構(gòu)圖�����,企業(yè)可以根據(jù)自身需要設(shè)立不同的質(zhì)量管理部門�����,一般包括質(zhì)量保證和質(zhì)量控制部門[10]��。在具體人員職責(zé)設(shè)立上�����,各部門都應(yīng)當(dāng)配備相應(yīng)資質(zhì)和數(shù)量的管理和操作人員��,同時明確規(guī)定各部門和各崗位的職責(zé)���,文件中具體將生產(chǎn)活動中的關(guān)鍵人員分為企業(yè)負(fù)責(zé)人���、生產(chǎn)管理負(fù)責(zé)人、質(zhì)量管理負(fù)責(zé)人和質(zhì)量受權(quán)人��,各類人員具體的資質(zhì)要求與重要職責(zé)見表1[11]�����。
表1 我國企業(yè)藥品生產(chǎn)關(guān)鍵人員的職責(zé)與資質(zhì)要求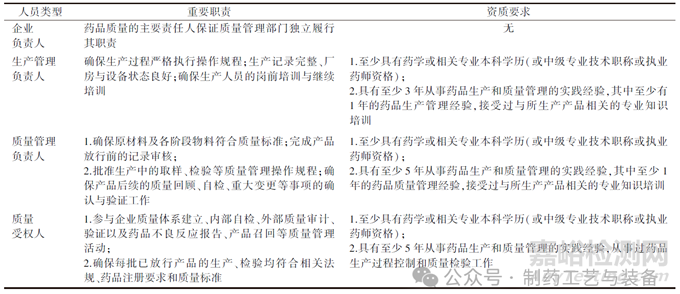
在滿足以上人員要求的基礎(chǔ)上��,《附錄》中還針對中藥材和中藥飲片的質(zhì)量管理人員提出要求[12]��,首先要求企業(yè)的質(zhì)量管理部門有專人來負(fù)責(zé)中藥材和中藥飲片的質(zhì)量管理��,具體的人員職責(zé)與資質(zhì)要求見表2。
表2 我國企業(yè)中藥材和中藥飲片質(zhì)量管理人員的職責(zé)與資質(zhì)要求
加拿大《指導(dǎo)文件》對機(jī)構(gòu)沒有提出要求��,人員設(shè)定與我國有區(qū)別��,僅劃分為工作人員(生產(chǎn)���、包裝、貼標(biāo)�����、儲存) 與質(zhì)量保證人員�����, 突出了質(zhì)量控制與保證在生產(chǎn)質(zhì)量管理中的重要作用[13]�����。其中文件規(guī)定各崗位的工作人員要有滿足崗位的教育���、培訓(xùn)和經(jīng)驗(yàn)等條件�����,應(yīng)當(dāng)提供符合崗位描述的個人履歷或?qū)W歷���、員工培訓(xùn)計(jì)劃或出勤情況��、完工證書等材料來證明���。質(zhì)量保證人員與我國GMP中所提到的質(zhì)量受權(quán)人相似,即把控各階段產(chǎn)品質(zhì)量以及批準(zhǔn)產(chǎn)品放行��、撤回或轉(zhuǎn)售的重要質(zhì)量控制人員��,主要職責(zé)包括建立各項(xiàng)流程應(yīng)當(dāng)遵守的規(guī)范書面程序���,同時確保每項(xiàng)程序都符合規(guī)范要求后再放行[14]�����。
比較發(fā)現(xiàn)�����,我國與加拿大均強(qiáng)調(diào)了對人員資質(zhì)和工作職責(zé)的規(guī)定���,對各類人員的工作職責(zé)與應(yīng)具備的專業(yè)技能都做出了要求��,但我國《附錄》在中藥相關(guān)專業(yè)人員資質(zhì)方面明確說明了相應(yīng)的學(xué)歷與工作經(jīng)驗(yàn)要求�����,加拿大《指導(dǎo)文件》則未明確說明��。在對生產(chǎn)過程進(jìn)行質(zhì)量控制的方面���,我國對于與中藥有關(guān)的生產(chǎn)質(zhì)量管理人員的分類比加拿大更加具體且詳細(xì)��,同時還有針對中藥材和中藥飲片方面的專業(yè)人才的要求�����,對中藥產(chǎn)品的生產(chǎn)�����、質(zhì)量管理以及質(zhì)量控制都要求有專門的工作人員來完成��。
3.2原材料與產(chǎn)品的比較
我國GMP根據(jù)產(chǎn)品加工進(jìn)度將原材料或產(chǎn)品分為原輔料��、中間產(chǎn)品和待包裝產(chǎn)品��、包裝材料、成品及特殊管理的原材料和產(chǎn)品等多個方面�����,并對其作出貯存�����、標(biāo)識��、后續(xù)操作等具體的要求��。對于不合格的產(chǎn)品有明確規(guī)定�����,要求置放在固定且有明確標(biāo)志的隔離區(qū)�����,且有相關(guān)質(zhì)量管理人員批準(zhǔn)處理的記錄[15]��。同時我國在中藥材的種植�����、采集、炮制等方面有豐富的經(jīng)驗(yàn)�����,規(guī)定中有詳細(xì)的說明��,如我國《附錄》中第五章“物料” 對中藥材���、中藥飲片以及中藥提取物的接收���、儲存、養(yǎng)護(hù)��、運(yùn)輸都有嚴(yán)格的要求[16-17]�����。
加拿大《指導(dǎo)文件》中沒有對中藥材提出特殊要求�����,但同樣根據(jù)加工進(jìn)度將生產(chǎn)對象分為樣品��、成品以及待包裝或待貼包括標(biāo)的半成品��,均在《指導(dǎo)文件》GMP內(nèi)容的第四章“產(chǎn)品” 中闡述���?�?梢钥闯觥吨笇?dǎo)文件》對這一章節(jié)的描述更偏向于對產(chǎn)品質(zhì)量控制上的規(guī)定��,文件中提到產(chǎn)品穩(wěn)定性���、純度檢測等產(chǎn)品質(zhì)量控制檢測規(guī)范應(yīng)當(dāng)參考《天然健康產(chǎn)品質(zhì)量指南》來進(jìn)行,確保企業(yè)有準(zhǔn)確的測量規(guī)范體系來確保產(chǎn)品合格[18]�����。
對比發(fā)現(xiàn)��,我國對中藥材管理涵蓋的內(nèi)容全面��,包括中藥原材料���、中藥飲片以及中藥提取物��,并且對每種類型的中藥都制定了相應(yīng)的管理流程�����;加拿大《指導(dǎo)文件》中還未有像我國這樣明確劃分中藥的類型��,而僅是將中藥作為一種天然健康產(chǎn)品從而制定了產(chǎn)品在不同階段相應(yīng)的質(zhì)量管理規(guī)范���。
3.3文件管理及內(nèi)容的比較
我國《附錄》將文件管理的內(nèi)容放在文中的第六章進(jìn)行統(tǒng)一闡述��,要求在產(chǎn)品生產(chǎn)質(zhì)量的控制過程中�����,要對生產(chǎn)工藝規(guī)程及相關(guān)標(biāo)準(zhǔn)��、生產(chǎn)過程及質(zhì)量管理情況都有相關(guān)的記錄文件���。
加拿大《指導(dǎo)文件》中也有關(guān)于文件記錄的相關(guān)要求,但是并沒有同我國《附錄》中以獨(dú)立章節(jié)單獨(dú)列出��,而是在場所��、人員��、過程��、產(chǎn)品每個部分的規(guī)范或者規(guī)范解讀指南中相應(yīng)提出��。例如在對場所的GMP要求證據(jù)示例中���,“通風(fēng)過濾器更換記錄” “每日溫度�����、相對濕度和光照(根據(jù)需要) 控制記錄”“與房屋維護(hù)相關(guān)的相關(guān)標(biāo)準(zhǔn)操作程序(SOPs) 和相關(guān)空白記錄模板” 等都是對文件管理的具體體現(xiàn)[19-20]��。
比較發(fā)現(xiàn)��,我國《附錄》強(qiáng)調(diào)了中藥產(chǎn)品在生產(chǎn)過程中核對生產(chǎn)標(biāo)準(zhǔn)�����,并要對生產(chǎn)過程中的操作資料進(jìn)行記錄�����,避免出現(xiàn)因生產(chǎn)失誤而導(dǎo)致的藥品安全問題�����,而加拿大《指導(dǎo)文件》中除了對生產(chǎn)操作��、產(chǎn)品記錄有所要求��,有關(guān)場所�����、設(shè)備的條件約束也在規(guī)范或要求證據(jù)示例中有所闡述���。
3.4生產(chǎn)與衛(wèi)生管理的比較
我國GMP對于生產(chǎn)過程及衛(wèi)生的管理體現(xiàn)在多個方面�����,分章節(jié)對人員衛(wèi)生的要求��、對廠房的清潔以及對設(shè)備的調(diào)試維護(hù)等進(jìn)行闡述���,均以最大限度地避免污染的原則做出了相應(yīng)的規(guī)范,除了在我國GMP正文中提出的對生產(chǎn)操作過程及工藝的控制以外[21]�����,我國《附錄》根據(jù)中藥材的特點(diǎn)在第七章“生產(chǎn)管理” 中提出了細(xì)致的要求���,包括中藥材的揀選���、整理、炮制等��,同時要求中藥制劑在生產(chǎn)過程中要采取一系列措施來防止微生物的污染[22]���,具體內(nèi)容見表3��。
表3 我國與加拿大GMP 相關(guān)文件對生產(chǎn)與衛(wèi)生要求對比
加拿大《指導(dǎo)文件》中GMP部分第一章對生產(chǎn)場所及設(shè)備提出要求���,第三章從“過程” 衛(wèi)生操作的角度集中對衛(wèi)生方案與操作提出了要求,并建立可供問題產(chǎn)品迅速且完全地召回的控制系統(tǒng)��,見表3�����。
兩者比較發(fā)現(xiàn)��,我國GMP及《附錄》對中成藥產(chǎn)品的生產(chǎn)及衛(wèi)生要求可以落實(shí)到生產(chǎn)的各個方面��,從生產(chǎn)要素作為分類依據(jù)對人員�����、廠房、設(shè)備分別提出操作過程與衛(wèi)生方面的要求���,加拿大《指導(dǎo)文件》則是將衛(wèi)生方案單獨(dú)作為一個部分詳細(xì)說明�����,同時《指導(dǎo)文件》更加強(qiáng)調(diào)對程序或記錄的標(biāo)準(zhǔn)化�����,反復(fù)提及某步驟或程序需要相應(yīng)的空白記錄模板或運(yùn)行計(jì)劃���,一定程度上可以對生產(chǎn)進(jìn)行事前控制,確保產(chǎn)品的質(zhì)量與安全��。
3.5兩國風(fēng)險(xiǎn)管理內(nèi)容的比較
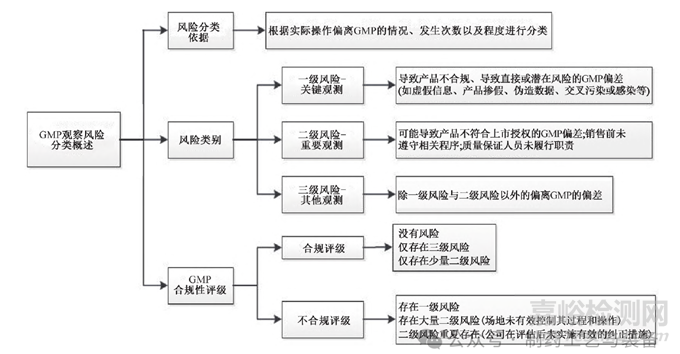
對于中藥產(chǎn)品的風(fēng)險(xiǎn)管理���,我國《附錄》提出“應(yīng)當(dāng)根據(jù)科學(xué)知識及經(jīng)驗(yàn)對質(zhì)量風(fēng)險(xiǎn)進(jìn)行評估�����,以保證產(chǎn)品質(zhì)量” “管理過程所采用的方法���、措施�����、形式及形成的文件應(yīng)當(dāng)與存在風(fēng)險(xiǎn)的級別相適應(yīng)”[23],此外并未有更多詳細(xì)介紹�����。加拿大《指導(dǎo)文件》作了分類概述���,見圖1���。
圖1 加拿大GMP觀察風(fēng)險(xiǎn)分類概述
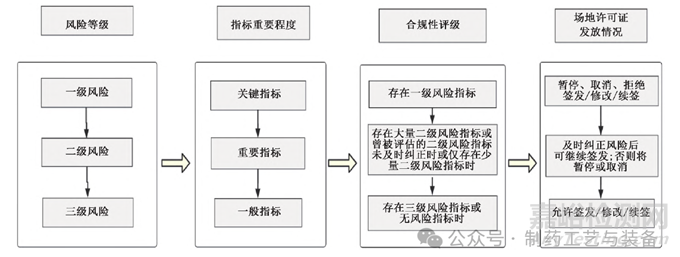
該文件以具體的風(fēng)險(xiǎn)管理分類協(xié)助產(chǎn)品的質(zhì)量管理工作,通過風(fēng)險(xiǎn)等級直觀顯示產(chǎn)品生產(chǎn)質(zhì)量合規(guī)程度�����,可作為產(chǎn)品場地許可證評估檢查或?qū)徲?jì)的依據(jù)�����,也能夠?yàn)槠髽I(yè)提供參考���?����!吨笇?dǎo)文件》涉及的場地�����、人員���、過程���、產(chǎn)品會影響產(chǎn)品質(zhì)量風(fēng)險(xiǎn)分類,見圖2��,按照偏離GMP要求的性質(zhì)以及偏離發(fā)生的次數(shù)與程度將風(fēng)險(xiǎn)分為三等��。同時根據(jù)風(fēng)險(xiǎn)等級對產(chǎn)品的場地許可作出合規(guī)性評級��,進(jìn)而決定這一產(chǎn)品是否取得場地許可證���。
圖2 加拿大GMP風(fēng)險(xiǎn)管理評估流程
3.6質(zhì)量保證內(nèi)容比較
我國《附錄》在第二章對質(zhì)量保證提出2條規(guī)定�����,明確質(zhì)量保證是質(zhì)量管理體系的一部分�����,要求企業(yè)必須建立質(zhì)量保證系統(tǒng)�����。質(zhì)量保證系統(tǒng)規(guī)定藥品的設(shè)計(jì)與研發(fā)當(dāng)體現(xiàn)我國GMP要求���,從原材料的采購和使用的原輔料以及包裝材料均需正確無誤。中間產(chǎn)品質(zhì)量需要有效控制�����,生產(chǎn)管理和質(zhì)量控制活動符合我國GMP的要求��,嚴(yán)格按照規(guī)程進(jìn)行生產(chǎn)��、檢查��、檢驗(yàn)和復(fù)核�����。生產(chǎn)出的每批產(chǎn)品需經(jīng)質(zhì)量受權(quán)人批準(zhǔn)后方可放行;最后按照自檢操作規(guī)程���,定期檢查評估質(zhì)量保證系統(tǒng)的有效性和適用性���。加拿大GMP文件中第51節(jié)規(guī)定了質(zhì)量保證人員的要求和責(zé)任。該文件要求制造商���、包裝商�����、貼標(biāo)商��、進(jìn)口商和經(jīng)銷商應(yīng)有質(zhì)量保證人員���,且需建立書面程序,以確保產(chǎn)品符合規(guī)范和法規(guī)要求�����。
對比發(fā)現(xiàn)���,我國政策是對企業(yè)總體提出質(zhì)量保證人員要求�����,側(cè)重點(diǎn)為藥品生產(chǎn)質(zhì)量檢測合格與否��,而加拿大要求每個制造商���、包裝商和貼標(biāo)商等都需要具備質(zhì)量保證人員���,即從藥品的生產(chǎn)到上市,到銷售均需要具備質(zhì)量保證人員��,并且由質(zhì)量保證人員建立書面程序��。加拿大在質(zhì)量控制上比我國要求更嚴(yán)格�����,各個環(huán)節(jié)的分工更細(xì)致��。
4��、總結(jié)與展望
我國《附錄》文件整體上對企業(yè)指導(dǎo)性不強(qiáng)��,僅從宏觀層面闡述各階段要求�����,而加拿大《指導(dǎo)文件》基于各項(xiàng)管理?xiàng)l例所列出的具體要求或參數(shù)��、預(yù)計(jì)的證據(jù)示例等都細(xì)分到生產(chǎn)管理過程��,可為企業(yè)提供自檢自查參考���。
4.1應(yīng)提高我國GMP規(guī)范的可參考性
目前我國暫無解讀GMP的文件���,企業(yè)沒有參考依據(jù),因此出現(xiàn)違反GMP規(guī)定的現(xiàn)象�����。因此提升我國GMP文件嘗試提供類似加拿大《指導(dǎo)文件》中證據(jù)示例的參考列表�����,供企業(yè)進(jìn)行自檢自查��,能夠提前對可能存在的問題及時糾正���,提升監(jiān)管效率��。
4.2應(yīng)幫助國外完善中藥制劑有關(guān)的GMP規(guī)范
我國對于中藥制劑生產(chǎn)質(zhì)量管理是從中成藥的特點(diǎn)出發(fā)���,對中藥材�����、中藥提取物或中藥飲片的獲得�����、加工��、儲存��、生產(chǎn)等過程都有專業(yè)規(guī)定���。而國際上大部分國家對中藥一系列規(guī)定都偏向于當(dāng)做一般藥品的質(zhì)量控制���,未能根據(jù)中藥特殊性來制定針對性的質(zhì)量控制舉措��,難以保證中藥在當(dāng)?shù)氐陌踩耘c有效性��。因此建議國家有關(guān)部門推動且?guī)椭渌麌彝晟飘?dāng)?shù)刂兴幹苿┫嚓P(guān)的GMP規(guī)范��,用符合中藥特色的方式衡量中藥產(chǎn)品的安全性和有效性��,確保中成藥獲得國際認(rèn)可�����。
4.3形成標(biāo)準(zhǔn)化原則以管理藥品生產(chǎn)質(zhì)量
加拿大《指導(dǎo)文件》提出了較多類風(fēng)險(xiǎn)管理體系�����、產(chǎn)品召回控制系統(tǒng)以及各環(huán)節(jié)的標(biāo)準(zhǔn)操作程序�����,如果將這種標(biāo)準(zhǔn)化方式引入我國中藥生產(chǎn)質(zhì)量管理工作中�����,就能使各環(huán)節(jié)管理工作形成一定的監(jiān)管機(jī)制與標(biāo)準(zhǔn)程序�����。如此��,一方面企業(yè)的生產(chǎn)質(zhì)量管理工作可以規(guī)范開展��,互相可以借鑒優(yōu)秀經(jīng)驗(yàn),實(shí)現(xiàn)行業(yè)內(nèi)積極聯(lián)動��;另一方面也為相關(guān)部門的監(jiān)管工作提供便利�����,標(biāo)準(zhǔn)化流程使得藥品工作環(huán)節(jié)中存在的問題更容易暴露���,并且能及時與標(biāo)準(zhǔn)流程進(jìn)行對照���,便于監(jiān)管主體對管理規(guī)范進(jìn)行修改與完善。
參考文獻(xiàn)
[ 1 ] Du H B. Traditional Chinese medicine education in Canada[J].Chin J Integr Med���, 2015���, 21(3):173?175.
[ 2 ] Zeng P J, Li J���, Chen Y L, et al. The structures and biological functions of polysaccharides from traditional chinese herbs[J].Prog Mol Biol Transl Sci�����, 2019, 163:423?444.
[ 3 ] 叢駱駱. 藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂) 檢查指南[J]. 首都醫(yī)藥���, 2014���, 21(23):54?56.
[ 4 ] 魏 鋒, 林瑞超. 加拿大天然健康產(chǎn)品管理概況[J]. 中國藥事�����, 2007�����, 21(3):214?216.
[ 5 ] 國家藥品監(jiān)督管理局. 關(guān)于發(fā)布《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂) 》無菌藥品等5 個附錄的公告[EB/ OL].https:/ / www. nmpa. gov. cn/ xxgk/ ggtg/ qtggtg/20110224164501312. html.
[ 6 ] Natural and Non?prescription Health Products Directorate [EB/OL] ( 2015?12?01). https:/ / www. canada. ca/ en/ health?canada/ services/ drugs?health?products/ natural?non?prescription/ legislation?guidelines/ guidance?documents/ good?manufacturi?ng?practices. html.
[ 7 ] 彭胡麟玥���, 許煜晨��, 胡雪凌���, 等. 2020 年版《中國藥典》收載的含麝香、牛黃中藥制劑的質(zhì)量標(biāo)準(zhǔn)探討[J]. 中國實(shí)驗(yàn)方劑學(xué)雜志�����, 2022, 28(23):205?213.
[ 8 ] 李 樂�����, 趙紅菊���, 楊 牧���, 等. 中藥飲片生產(chǎn)企業(yè)實(shí)施GMP 存在的問題[J]. 中國藥事, 2017���, 31(6):604?607.
[ 9 ] 趙勝楠��, 趙士杰���, 屠佳峰, 等. 加拿大天然藥品上市許可制度的研究與實(shí)踐[J]. 中國藥事���, 2021�����, 35(2):215?220.
[10] 李年蘇�����, 譚順洪. 美國��、歐盟���、加拿大和中國發(fā)布的藥品GMP 合規(guī)檢查信息簡介及啟示[J]. 中南藥學(xué), 2019�����, 17(9):1583?1587.
[11] 范琳琳���, 梁 毅. 藥品生產(chǎn)企業(yè)GMP 組織結(jié)構(gòu)合理化問題的探討[J]. 中國食品藥品監(jiān)管��, 2020(4):50?53.
[12] 徐麗敏. 基于新版GMP 要求的制藥企業(yè)設(shè)備管理研究[D].石家莊:河北科技大學(xué)�����, 2014.
[13] 樊小花. “加拿大天然健康產(chǎn)品許可證申請指導(dǎo)文件” 的翻譯報(bào)告[D]. 蘭州:西北師范大學(xué)��, 2014.
[14] 田 明���, 趙靜波��, 張孜儀. 加拿大天然健康產(chǎn)品管理的模式及啟示[J]. 食品工業(yè)科技���, 2019, 40(10):355?359�����;368.
[15] 陳 巖�����, 張 婧���, 付艷紅. 中藥制劑質(zhì)量控制管理影響因素的研究[J]. 中國衛(wèi)生產(chǎn)業(yè)���, 2017, 14(13):153?154.
[16] 陳楊明�����, 傅榮權(quán)�����, 黃江紅. 中藥飲片質(zhì)量與調(diào)劑誤差問題的分析與對策[ J]. 中醫(yī)藥管理雜志, 2022��, 30 ( 6):158?160.
[17] 徐紅琴. 中藥飲片處方質(zhì)量監(jiān)控在提高臨床用藥安全性中的作用[J]. 中醫(yī)藥管理雜志��, 2022��, 30(2):155?156.
[18] 樊小花. “加拿大天然健康產(chǎn)品許可證申請指導(dǎo)文件” 的翻譯報(bào)告[D]. 蘭州:西北師范大學(xué)��, 2014.
[19] 趙勝楠�����, 趙士杰�����, 屠佳峰�����, 等. 加拿大天然藥品上市許可制度的研究與實(shí)踐[ J]. 中國藥事�����, 2021���, 35 ( 2 ):215?220.
[20] 何 毅�����, 趙利斌�����, 葉正良�����, 等. 歐盟��、美國和加拿大植物藥管理異同剖析[ J]. 中國中藥雜志��, 2011��, 36 ( 19):2747?2750.
[21] 胡慧敏���, 楊龍會, 譚 勇��, 等. 中藥在加拿大注冊天然健康產(chǎn)品流程介紹與分析[J]. 國際中醫(yī)中藥雜志, 2022�����, 44(3):246?250.
[22] 翟鐵偉��, 丁恩峰���, 高海燕. 加拿大GMP 檢查缺陷評價(jià)體系介紹[J]. 醫(yī)藥工程設(shè)計(jì), 2013��, 34(3):25?32.
[23] 申 琦���, 李年蘇��, 梁 毅. 中美兩國藥品GMP 合規(guī)檢查信息及相關(guān)數(shù)據(jù)庫的比較研究[ J]. 中國藥房�����, 2019�����, 30(22):3035?3041.
本文作者林林���、朱詩宇��、譚勇�����、溫博�����、魏嘉茵�����、馮小玉�����、夏玉文�����、王湘鵬�����、譚佳妮���、楊龍會�����,中國中醫(yī)科學(xué)院中醫(yī)臨床基礎(chǔ)醫(yī)學(xué)研究所���、北京中醫(yī)藥大學(xué)管理學(xué)院、北京中醫(yī)藥大學(xué)中藥學(xué)院��、湘潭大學(xué)文學(xué)與新聞學(xué)院���,來源于中成藥,僅供交流學(xué)習(xí)���。