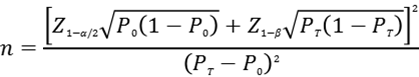剛剛�,國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心發(fā)布《結(jié)直腸癌篩查用體外診斷試劑臨床評(píng)價(jià)注冊(cè)審查指導(dǎo)原則(征求意見稿)》,內(nèi)容如下:
結(jié)直腸癌篩查用體外診斷試劑臨床評(píng)價(jià)注冊(cè)審查指導(dǎo)原則
(征求意見稿)
本指導(dǎo)原則旨在指導(dǎo)注冊(cè)申請(qǐng)人對(duì)結(jié)直腸癌篩查試劑注冊(cè)申報(bào)資料的準(zhǔn)備及撰寫�,同時(shí)也為技術(shù)審評(píng)部門對(duì)注冊(cè)申報(bào)資料的技術(shù)審評(píng)提供參考。
本指導(dǎo)原則是針對(duì)結(jié)直腸癌篩查試劑注冊(cè)審查的一般要求�,申請(qǐng)人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用,若不適用����,需具體闡述理由及相應(yīng)的科學(xué)依據(jù),并依據(jù)產(chǎn)品的具體特性對(duì)注冊(cè)申報(bào)資料的內(nèi)容進(jìn)行充實(shí)和細(xì)化。
本指導(dǎo)原則是供注冊(cè)申請(qǐng)人和技術(shù)審評(píng)人員使用的指導(dǎo)性文件����,但不包括審評(píng)審批所涉及的行政事項(xiàng),亦不作為法規(guī)強(qiáng)制執(zhí)行��,應(yīng)在遵循相關(guān)法規(guī)的前提下使用本審評(píng)要點(diǎn)��。如果有能夠滿足相關(guān)法規(guī)要求的其他方法����,也可以采用,但是需要提供詳細(xì)的研究資料和驗(yàn)證資料����。
本審評(píng)要點(diǎn)是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制定,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善�,以及科學(xué)技術(shù)的不斷發(fā)展,相關(guān)內(nèi)容也將適時(shí)進(jìn)行調(diào)整��。
一�、適用范圍
本指導(dǎo)原則適用于對(duì)來源于糞便樣本中的相關(guān)標(biāo)志物進(jìn)行體外定性檢測(cè),用于結(jié)直腸癌篩查的體外診斷試劑��。陽性結(jié)果提示存在結(jié)直腸癌或進(jìn)展期腺瘤的風(fēng)險(xiǎn)較高,應(yīng)進(jìn)行診斷性結(jié)腸鏡檢查。產(chǎn)品檢測(cè)結(jié)果不能替代腸鏡����。對(duì)于其他樣本類型��,可能部分要求不完全適用或本文所述內(nèi)容不夠全面,申請(qǐng)人可以參照本指導(dǎo)原則�,根據(jù)產(chǎn)品特性對(duì)適用部分進(jìn)行評(píng)價(jià)或補(bǔ)充其他的評(píng)價(jià)資料進(jìn)行相應(yīng)驗(yàn)證。
二����、臨床試驗(yàn)注冊(cè)審查要點(diǎn)
開展結(jié)直腸癌篩查試劑臨床試驗(yàn)應(yīng)符合《體外診斷試劑注冊(cè)與備案管理辦法》《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》以及《體外診斷試劑臨床試驗(yàn)技術(shù)指導(dǎo)原則》的要求�,如相關(guān)法規(guī)、規(guī)章����、規(guī)范性文件有更新,臨床試驗(yàn)應(yīng)符合更新后的要求��。
申請(qǐng)人應(yīng)根據(jù)產(chǎn)品特點(diǎn)及預(yù)期用途����,綜合不同地區(qū)發(fā)病情況等因素選擇具有代表性的臨床試驗(yàn)機(jī)構(gòu)開展臨床試驗(yàn),保證入組人群對(duì)篩查目標(biāo)人群總體具有良好的代表性����。應(yīng)選擇不少于3家(含3家)符合法規(guī)要求的臨床試驗(yàn)機(jī)構(gòu)開展多中心臨床試驗(yàn)。
參與臨床試驗(yàn)的人員經(jīng)培訓(xùn)后應(yīng)熟悉相關(guān)檢測(cè)技術(shù)的原理、適用范圍�、操作方法等,并能夠?qū)z測(cè)結(jié)果進(jìn)行正確判讀��。在整個(gè)試驗(yàn)中��,試驗(yàn)體外診斷試劑和對(duì)比試劑/方法都應(yīng)處于有效的質(zhì)量控制下����,最大限度保證試驗(yàn)數(shù)據(jù)的準(zhǔn)確性及可重復(fù)性。
臨床試驗(yàn)應(yīng)包括:對(duì)目標(biāo)人群的篩查性能評(píng)價(jià)�;對(duì)結(jié)直腸癌診斷的靈敏度和特異度評(píng)價(jià);被測(cè)標(biāo)志物的檢測(cè)性能評(píng)價(jià)等����。
(一)對(duì)目標(biāo)人群的篩查性能評(píng)價(jià)
1.受試者入組
篩查臨床試驗(yàn)在預(yù)期適用的目標(biāo)人群中按照臨床試驗(yàn)方案設(shè)定的入組標(biāo)準(zhǔn)前瞻性、順序入組受試者����。
應(yīng)明確人群的判定依據(jù)。根據(jù)《中國(guó)結(jié)直腸癌篩查與早診早治指南(2020,北京)》�,結(jié)直腸癌高風(fēng)險(xiǎn)人群包括有結(jié)直腸癌病史、腺瘤性息肉病史����、炎癥性腸病史��、有提高結(jié)直腸癌罹患風(fēng)險(xiǎn)的已知疾病史或家族遺傳疾病史(如林奇綜合征或家族性腺瘤樣息肉?。?�、一級(jí)親屬結(jié)直腸癌病史以及糞便隱血試驗(yàn)陽性的人群�。一般風(fēng)險(xiǎn)人群為40-74歲之間的無結(jié)直腸癌高風(fēng)險(xiǎn)因素的人群。有關(guān)高風(fēng)險(xiǎn)人群和一般風(fēng)險(xiǎn)人群的定義建議按照現(xiàn)行有效的篩查指南執(zhí)行����。
受試者有無高風(fēng)險(xiǎn)因素等臨床背景可采用問卷方式獲得,并在臨床試驗(yàn)數(shù)據(jù)表中針對(duì)每一項(xiàng)風(fēng)險(xiǎn)因素單獨(dú)設(shè)一列��,填寫問卷結(jié)果�。
2.試驗(yàn)方法
采用試驗(yàn)體外診斷試劑與結(jié)直腸癌和進(jìn)展期腺瘤臨床診斷參考標(biāo)準(zhǔn)����,即結(jié)腸鏡結(jié)合病理檢查結(jié)果進(jìn)行比較研究,評(píng)價(jià)試驗(yàn)體外診斷試劑在適用人群中篩查結(jié)直腸癌和進(jìn)展期腺瘤的靈敏度����、特異度和陽性/陰性預(yù)測(cè)值等指標(biāo)。
如臨床已有相同適用人群的篩查方法����,應(yīng)同時(shí)采用已有方法進(jìn)行篩查��,評(píng)價(jià)現(xiàn)有方法的臨床性能����,并與試驗(yàn)體外診斷試劑進(jìn)行比較��。
受試者入組后采用試驗(yàn)體外診斷試劑和現(xiàn)行指南推薦的篩查方法分別進(jìn)行檢測(cè)/檢查��,之后進(jìn)行結(jié)腸鏡檢查����,必要時(shí)進(jìn)行病理檢查。試驗(yàn)體外診斷試劑與已有篩查方法的樣本采集應(yīng)在結(jié)腸鏡檢查之前完成�,與結(jié)腸鏡檢查的時(shí)間間隔建議不超過12周。結(jié)腸鏡檢查質(zhì)量應(yīng)符合高質(zhì)量檢查標(biāo)準(zhǔn)(良好的腸道準(zhǔn)備率應(yīng)>85%�;盲腸插鏡率>95%;退鏡時(shí)間應(yīng)至少保證6min)����。
3.樣本量
應(yīng)根據(jù)預(yù)期靈敏度水平,采用單組目標(biāo)值法樣本量公式估算最低結(jié)直腸癌樣本例數(shù)��。
公式中��,n為陽性樣本量����;Z1-α/2�、Z1-β為顯著性水平和把握度的標(biāo)準(zhǔn)正態(tài)分布的分位數(shù)�,P0為評(píng)價(jià)指標(biāo)的臨床可接受標(biāo)準(zhǔn),PT為試驗(yàn)體外診斷試劑評(píng)價(jià)指標(biāo)預(yù)期值�。
基于現(xiàn)有認(rèn)知,結(jié)直腸癌靈敏度P0建議不低于85%�。
按照估算的最低結(jié)直腸癌樣本例數(shù)和預(yù)期適用人群中結(jié)直腸癌患病率估算總樣本量,同時(shí)考慮可能的受試者脫落比例�,確定需要入組的受試者最低總樣本量��,脫落率建議不高于20%��。
4.評(píng)價(jià)指標(biāo)和統(tǒng)計(jì)學(xué)分析
首先應(yīng)對(duì)入組人群基線信息進(jìn)行總結(jié)分析,包括人口學(xué)信息��,如年齡、性別�、地域(農(nóng)村��,城市)�,以及風(fēng)險(xiǎn)因素分布等����。
其次建議采用流程圖的形式說明入組人群�、脫落人群�、納入統(tǒng)計(jì)人群的情況�,并對(duì)所有脫落病例進(jìn)行分析�,解釋脫落原因和脫落率可接受的理由����。
最后對(duì)篩查試驗(yàn)的各項(xiàng)臨床性能指標(biāo)進(jìn)行分析,一般包括臨床靈敏度����、臨床特異度�、陽性預(yù)期值��、陰性預(yù)期值����、相對(duì)風(fēng)險(xiǎn)值等�。其中臨床靈敏度應(yīng)針對(duì)結(jié)直腸癌和進(jìn)展期腺瘤病例組分別評(píng)價(jià),臨床特異度應(yīng)針對(duì)非結(jié)直腸癌且非進(jìn)展期腺瘤受試者進(jìn)行評(píng)價(jià)����。應(yīng)針對(duì)各項(xiàng)評(píng)價(jià)指標(biāo)進(jìn)行點(diǎn)估計(jì)值及95%置信區(qū)間計(jì)算����。同時(shí)計(jì)算入組人群中結(jié)直腸癌患者占比��,包括各分期患者占比,應(yīng)與同時(shí)期流行病學(xué)調(diào)查結(jié)果相符�。
臨床試驗(yàn)結(jié)果匯總和各項(xiàng)指標(biāo)計(jì)算方法參見表1��。
表1臨床試驗(yàn)檢測(cè)結(jié)果總結(jié)
|
試驗(yàn)體外診斷試劑檢測(cè)結(jié)果
|
結(jié)腸鏡結(jié)合組織病理學(xué)檢查結(jié)果
|
|
|
結(jié)直腸癌
|
進(jìn)展期腺瘤
|
中風(fēng)險(xiǎn)腺瘤
|
低風(fēng)險(xiǎn)腺瘤
|
無發(fā)現(xiàn)
|
合計(jì)
|
|
陽性
|
a
|
b
|
c
|
d
|
e
|
a+b+c+d+e
|
|
陰性
|
f
|
g
|
h
|
i
|
j
|
f+g+h+i+j
|
|
合計(jì)
|
a+f
|
b+g
|
c+h
|
d+i
|
e+j
|
N
|
注:1.結(jié)直腸癌:I-IV期結(jié)腸直腸癌����。
2.進(jìn)展期腺瘤:高級(jí)別瘤變或10個(gè)以上腺瘤��;管絨毛腺瘤;≥10毫米的管狀腺瘤����;≥10毫米的傳統(tǒng)的鋸齒狀腺瘤。
3.中風(fēng)險(xiǎn)腺瘤:≥10毫米的增生性息肉或SSL��;<10毫米的5-9個(gè)腺瘤(TA + SSL)��;<10毫米的3-4個(gè)腺瘤(TA + SSL)。
4.低風(fēng)險(xiǎn)腺瘤:1-2個(gè)5-9毫米的腺瘤(TA + SSL)��;1-2個(gè)<5毫米的腺瘤(TA + SSL)�。
5.無發(fā)現(xiàn):<10毫米的增生性息肉等陰性病變或結(jié)腸鏡檢查無病變��。
結(jié)直腸癌臨床靈敏度=a/(a+f)×100%
進(jìn)展期腺瘤臨床靈敏度=b/(b+g)×100%
非進(jìn)展期腺瘤臨床靈敏度=(c+d)/(c+d+h+i)×100%
臨床特異度=(h+i+j)/(c+d+e+h+i+j)×100%
陽性預(yù)測(cè)值=(a+b)/(a+b+c+d+e)×100%
陰性預(yù)測(cè)值=(h+i+j)/(f+g+h+i+j)×100%
相對(duì)風(fēng)險(xiǎn)=陽性預(yù)測(cè)值/(1-陰性預(yù)測(cè)值)
如適用人群為滿足一定年齡��、性別要求的全人群�,建議針對(duì)其中的一般風(fēng)險(xiǎn)人群和高風(fēng)險(xiǎn)人群進(jìn)行分層分析����,確認(rèn)不同人群的篩查性能均滿足臨床要求。
產(chǎn)品如包括不同的標(biāo)志物�,應(yīng)包括不同標(biāo)志物的篩查靈敏度分析����,確認(rèn)不同標(biāo)志物聯(lián)合檢測(cè)的意義(如適用)。如果試驗(yàn)體外診斷試劑不適用與此項(xiàng)評(píng)價(jià)��,應(yīng)有充分的理由�。
同步開展的已有篩查方法檢測(cè)/檢查,應(yīng)參照上述方法同步評(píng)價(jià)各項(xiàng)臨床性能指標(biāo)�。
最后應(yīng)將試驗(yàn)體外診斷試劑在適用人群中篩查結(jié)直腸癌和進(jìn)展期腺瘤的各項(xiàng)臨床性能指標(biāo)與已有篩查方法各項(xiàng)臨床性能指標(biāo)進(jìn)行比較,并分析申報(bào)產(chǎn)品臨床性能指標(biāo)能否滿足臨床需求�。
(二)結(jié)直腸癌及癌前病變?cè)\斷的靈敏度和特異度評(píng)價(jià)
1.受試者入組
為更加充分的評(píng)價(jià)試驗(yàn)體外診斷試劑的靈敏度和特異度,還應(yīng)對(duì)腫瘤組和非腫瘤組的重要亞組分別進(jìn)行分層入組��,并與相關(guān)結(jié)直腸癌的臨床參考標(biāo)準(zhǔn)進(jìn)行對(duì)比��,從而使臨床性能評(píng)價(jià)更加全面地覆蓋目標(biāo)人群中的各種特征����,包括不同分期的腫瘤病例,和不同干擾因素的非腫瘤病例等�。此部分試驗(yàn)可將(一)篩查性能評(píng)價(jià)中順序入組的所有樣本納入�,如某些亞組樣本量不足可進(jìn)一步富集入組。
1.1腫瘤疾病組
腫瘤疾病組人群應(yīng)包括結(jié)直腸癌不同分期(Ⅰ�、Ⅱ�、Ⅲ����、Ⅳ期)、結(jié)直腸進(jìn)展期腺瘤����。應(yīng)特別關(guān)注進(jìn)展期腺瘤及早期癌癥組的臨床靈敏度是否滿足要求����。
1.2非腫瘤疾病組
為對(duì)產(chǎn)品臨床特異度進(jìn)行充分評(píng)價(jià),應(yīng)納入消化道良性疾病患者(腸息肉����、腸腺瘤、腸炎等)和其他消化道腫瘤患者包括胃癌��、肝癌��、食管癌、膽管癌����、胰腺癌等。非結(jié)直腸癌腫瘤疾病患者的診斷依據(jù)相關(guān)疾病診療規(guī)范執(zhí)行��。
2.試驗(yàn)方法
采用試驗(yàn)體外診斷試劑與結(jié)直腸癌和進(jìn)展期腺瘤臨床診斷參考標(biāo)準(zhǔn)進(jìn)行比較研究,評(píng)價(jià)試驗(yàn)體外診斷試劑針對(duì)結(jié)直腸癌各分期��、進(jìn)展期腺瘤疾病組的臨床靈敏度����,以及消化道良性疾病、其他腫瘤亞組的臨床特異度等指標(biāo)��。
3.樣本量
可采用單組目標(biāo)值法公式估算最低樣本量��,應(yīng)分別估算結(jié)直腸癌患者例數(shù)、進(jìn)展期腺瘤患者例數(shù)��、消化道良性疾病患者例數(shù)和其他癌癥患者例數(shù)等)以及腸道無占位性病變病例數(shù)。各組目標(biāo)值設(shè)定建議參考表2中相關(guān)指標(biāo)的最低可接受標(biāo)準(zhǔn)。
根據(jù)已有文獻(xiàn)數(shù)據(jù)����,經(jīng)統(tǒng)計(jì)學(xué)估算�,建議結(jié)直腸癌病例不少于300例�,其中各分期病例建議I期不少于80例����,其他各期分別不少于50例��;進(jìn)展期腺瘤不少于200例�;腸道良性疾病患者中,腸息肉患者不少于200例��;其他各種癌癥病例建議分別不少于30例,無腸道異常病例不少于230例����。
4.臨床評(píng)價(jià)指標(biāo)和統(tǒng)計(jì)學(xué)分析
對(duì)臨床試驗(yàn)結(jié)果進(jìn)行總結(jié)�。計(jì)算靈敏度、特異度并計(jì)算95%置信區(qū)間�;同時(shí)應(yīng)針對(duì)結(jié)直腸癌不同分期、以及進(jìn)展期腺瘤患者分別計(jì)算靈敏度��;針對(duì)不同類型腸道良性疾病患者��、其他不同癌種病例以及腸道無占位性病變患者分別分析特異度�。
依據(jù)臨床需求和已報(bào)道研究數(shù)據(jù)�,部分關(guān)鍵亞組臨床性能評(píng)價(jià)指標(biāo)推薦的最低可接受標(biāo)準(zhǔn)(95%置信區(qū)間下限)參下表:
表2部分亞組臨床性能評(píng)價(jià)指標(biāo)推薦最低可接受標(biāo)準(zhǔn)
|
亞組
|
評(píng)價(jià)指標(biāo)
|
預(yù)期可接受標(biāo)準(zhǔn)
|
|
CRC
|
臨床靈敏度
|
85%
|
|
進(jìn)展期腺瘤
|
臨床靈敏度
|
50%
|
|
腸道良性疾病
|
臨床特異度
|
80%
|
|
其他惡性腫瘤
|
臨床特異度
|
80%
|
|
無腸道異常
|
臨床特異度
|
90%
|
對(duì)于檢測(cè)結(jié)果與臨床診斷結(jié)論不一致的樣本,應(yīng)結(jié)合患者疾病背景信息��、其他臨床實(shí)驗(yàn)室檢驗(yàn)結(jié)果等對(duì)差異原因進(jìn)行合理分析����。
(三)被測(cè)標(biāo)志物檢測(cè)性能評(píng)價(jià)
1.試驗(yàn)方法
根據(jù)被測(cè)標(biāo)志物的特征,應(yīng)采用試驗(yàn)體外診斷試劑與已上市同類產(chǎn)品或?qū)嶒?yàn)室參考方法進(jìn)行對(duì)比試驗(yàn)��,評(píng)價(jià)試驗(yàn)體外診斷試劑針對(duì)被測(cè)標(biāo)志物的檢測(cè)性能��。如被測(cè)標(biāo)志物為DNA甲基化或者基因突變�,可以采用測(cè)序方法作為實(shí)驗(yàn)室參考方法,進(jìn)行對(duì)比試驗(yàn)�,如選擇同類產(chǎn)品,應(yīng)確認(rèn)具有良好的可比性。實(shí)驗(yàn)室參考方法應(yīng)進(jìn)行充分的性能驗(yàn)證�,包括最低檢出限、準(zhǔn)確性�、精密度等,確認(rèn)與試驗(yàn)體外診斷試劑具有良好的可比性��。并提供詳細(xì)的方法建立和性能驗(yàn)證資料�。如測(cè)序試驗(yàn)委托第三方實(shí)驗(yàn)室或檢測(cè)機(jī)構(gòu)完成,應(yīng)提供臨床試驗(yàn)機(jī)構(gòu)委托該試驗(yàn)的委托協(xié)議,并確認(rèn)第三方檢測(cè)機(jī)構(gòu)有相應(yīng)的檢測(cè)資質(zhì)��。
當(dāng)試驗(yàn)體外診斷試劑包含多項(xiàng)被測(cè)物時(shí),原則上應(yīng)針對(duì)所有標(biāo)志物分別進(jìn)行檢測(cè)性能評(píng)價(jià)����。如不適用,應(yīng)提供充分的理由和依據(jù)�,并采用合理的方法進(jìn)行檢測(cè)性能評(píng)價(jià)����。
2.樣本量
應(yīng)針對(duì)所有標(biāo)志物(如適用)分別估算陽性樣本量和陰性樣本量�,建議采用單組目標(biāo)值法公式,目標(biāo)值(P0)設(shè)定應(yīng)有合理依據(jù)��,基因突變或甲基化等核酸標(biāo)志物檢測(cè)目標(biāo)值建議不低于90%��。
3.評(píng)價(jià)指標(biāo)和統(tǒng)計(jì)學(xué)分析
對(duì)于試驗(yàn)體外診斷試劑與對(duì)比試劑/方法的一致性評(píng)價(jià)�,可采用四格表的形式總結(jié)兩種試劑/方法的檢測(cè)結(jié)果,計(jì)算陽性符合率��、陰性符合率��、總符合率及其95%置信區(qū)間。
對(duì)于不一致樣本����,應(yīng)結(jié)合患者便隱血結(jié)果、結(jié)腸鏡和病理診斷結(jié)果進(jìn)行原因分析����。
(四)篩查頻率
申請(qǐng)人應(yīng)基于已有研究成果和文獻(xiàn)數(shù)據(jù)針對(duì)篩查頻率給出合理建議����,同時(shí)應(yīng)于產(chǎn)品上市后持續(xù)開展研究����,分析不同篩查頻率下的臨床性能,并與已有篩查方法進(jìn)行比較��,需要時(shí)進(jìn)一步優(yōu)化篩查頻率。
(五)其他評(píng)價(jià)
在對(duì)申報(bào)產(chǎn)品各項(xiàng)臨床性能進(jìn)行充分評(píng)價(jià)的基礎(chǔ)上��,建議申請(qǐng)人在臨床試驗(yàn)過程中對(duì)試驗(yàn)體外診斷試劑預(yù)期用于目標(biāo)人群的成本效益比以及受試者接受度等進(jìn)行分析��,結(jié)合產(chǎn)品臨床性能指標(biāo)綜合評(píng)價(jià)產(chǎn)品對(duì)篩查人群可能帶來的風(fēng)險(xiǎn)和獲益,并與已有篩查方法的風(fēng)險(xiǎn)和獲益進(jìn)行比較��,評(píng)價(jià)申報(bào)產(chǎn)品的優(yōu)勢(shì)�。
三、參考文獻(xiàn)
[1]體外診斷試劑注冊(cè)與備案管理辦法[Z].
[2]醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范[Z].
[3]體外診斷試劑臨床試驗(yàn)技術(shù)指導(dǎo)原則[Z].
[4]中國(guó)結(jié)直腸癌篩查與早診早治指南 (2020,北京)[Z].
[5]中國(guó)結(jié)直腸癌診療規(guī)范(2023版)國(guó)家衛(wèi)生健康委員會(huì)[Z].
[6]U.S. Preventive Services Task Force Recommendation Statement. Colorectal Cancer: Screening .[Z].
[7]Weiderpass E, Stewart BW. World Cancer Report: Cancer Research for Cancer PreventionWild CP .[Z]..
[8]詹思延.流行病學(xué)[M].8版.北京:人民衛(wèi)生出版社, 2017: 120-139.[Z].