今日頭條
海昶AKT-1抑制劑獲批肝癌II期臨床�。海昶生物宣布其自主研發(fā)的創(chuàng)新型小核酸藥物HC0301已獲得FDA臨床許可,即將在美國馬里蘭大學腫瘤中心開展針對晚期肝癌的國際II期臨床�。HC0301可特異性結合AKT-1 mRNA���,進而降低AKT-1蛋白表達下調(diào)���。AKT-1蛋白與腫瘤增殖、存活���、血管生成和免疫耐藥密切相關����。此前���,F(xiàn)DA已授予HC0301用于治療晚期肝癌的孤兒藥資格認定。
國內(nèi)藥訊
1.羅氏「恩曲替尼」中國獲批治療兒童實體瘤����。羅氏TRK/ROS1酪氨酸激酶抑制劑恩曲替尼膠囊獲國家藥監(jiān)局批準新適應癥,用于治療1月齡以上NTRK融合兒童實體瘤患者����。該新藥能夠穿過血腦屏障�,通過阻斷ROS1和NTRK激酶的活性,造成ROS1陽性或NTRK陽性癌細胞死亡����。此前�,該產(chǎn)品已獲批治療≥12歲����、NTRK融合陽性實體瘤,以及ROS1陽性的非小細胞肺癌患者����。
2.華潤第三代溶栓藥新適應癥報產(chǎn)�。華潤生物第三代溶栓藥物注射用重組人組織型纖溶酶原激酶衍生物(瑞通立)的新適應癥上市申請獲CDE受理,用于“急性缺血性卒中患者的溶栓治療”���。瑞通立僅包含天然組織型纖溶酶原激活劑(tPA)對纖維蛋白的高度特異性和酶活性區(qū)域����,具有更長的半衰期����、更強的溶栓效果。此前�,瑞通立已在中國獲批用于急性心肌梗死的溶栓治療���。
3.曙方引進DMD新藥擬納入優(yōu)先審評���。曙方醫(yī)藥從Santhera公司引進的罕見病新藥vamorolone口服混懸液獲CDE擬納入優(yōu)先審評����,用于治療4歲及以上杜氏肌營養(yǎng)不良(DMD)患者���。在IIb期臨床中,vamorolone的療效與強的松相比達到非劣效標準����;而且并未發(fā)現(xiàn)vamorolone在骨骼健康生物標志與線性生長上有負面的影響����。曙方醫(yī)藥擁有該產(chǎn)品在大中華區(qū)開發(fā)和商業(yè)化的獨家權益。
4.Seagen公司ITGB6-ADC中國報IND�。Seagen公司1類生物藥SGN-B6A的臨床試驗申請獲CDE受理。這是一款靶向整合素β6(ITGB6)的抗體偶聯(lián)藥物(ADC)����,通過蛋白酶可裂解的MC-VC接頭將ITGB6靶向單抗h2A2與微管破壞MMAE偶聯(lián),通MMAE介導的細胞毒性���、旁觀者效應和免疫原性細胞死亡(ICD)發(fā)揮抗腫瘤活性����。去年8月,該新藥已啟動Ⅲ期臨床���,擬評估與多西他賽化療頭對頭相比�,治療復發(fā)性非小細胞肺癌的效果����。
5.普方完成1.12億美元超額B輪融資。普方生物宣布完成1.12億美元超額B輪融資�,以用于推進其靶向FRα的ADC藥物rinatabart sesutecan(Rina-S)開展針對于卵巢癌和子宮內(nèi)膜癌患者的Ⅱ期臨床試驗�。今年1月,該產(chǎn)品已獲得FDA授予快速通道資格�,用于治療表達FRα的高級別漿液性或子宮內(nèi)膜樣鉑耐藥的卵巢癌患者。本輪融資由Ally Bridge Group領投����,現(xiàn)有投資方禮來亞洲基金(LAV)和洲嶺資本(LYFE Capital)持續(xù)參與支持。
國際藥訊
1.度普利尤單抗日本獲批治療慢性CSU���。再生元與賽諾菲開發(fā)的IL-4/IL-13抑制劑度普利尤單抗(Dupixent)獲日本厚生勞動?���。℉LW)批準新適應癥����,用于治療≥12歲、慢性自發(fā)性蕁麻疹(CSU)患者����。去年10月,F(xiàn)DA針對Dupixent這一適應癥sBLA發(fā)出完整回復函(CRL)�,F(xiàn)DA認為需要額外的療效數(shù)據(jù)來支持sBLA的批準���。目前���,再生元正在開展的臨床試驗(Study C)將在今年年底獲得結果����,將提供額外的療效數(shù)據(jù)。
2.武田布地奈德口服混懸液獲批上市�。武田糖皮質(zhì)激素布地奈德口服混懸液Eohilia獲FDA批準上市,成為治療嗜酸性粒細胞性食管炎(EoE)的首款口服療法�,用于治療11歲以上EoE患者。Eohilia能夠局部粘附在粘膜上,從而在食道部位產(chǎn)生活性�。在臨床試驗中,Eohilia較安慰劑顯著提高患者達到組織學緩解的比例(53.1%vs1%���;38%vs2.4%);有更多患者吞咽困難癥狀減輕或自動消除����。
3.羅氏奧馬珠單抗獲批用于食物過敏。羅氏IgE抗體奧馬珠單抗(Xolair)獲FDA批準用于減少成人和1歲以上兒童因意外暴露于一種或多種食物而引發(fā)的過敏反應(包括過敏性休克)�。在Ⅲ期臨床OUtMATCH中,與安慰劑相比���,Xolair顯著增加引起兒童和青少年發(fā)生過敏反應所需的花生以及牛奶���、雞蛋和腰果的數(shù)量。詳細結果將在AAAI2024年會上公布���。
4.DMD基因療法獲FDA優(yōu)先審評資格。Sarepta公司與羅氏開發(fā)的基因療法Elevidys(SRP-9001)的補充生物制品許可申請(sBLA)獲FDA授予優(yōu)先審評資格���,擬尋求由加速批準轉(zhuǎn)變?yōu)橥耆鷾?���,用于治?span style="color:#ff0000;">杜氏肌營養(yǎng)不良癥(DMD)患者。PDUFA日期為今年6月21日�。在Ⅲ期驗證性臨床EMBARK中,Elevidys治療組患者的與運動功能相關的NSAA評分較安慰劑組顯示改善趨勢(但不具統(tǒng)計學意義)����;次要終點TTR和10MWR指標顯著改善。
5.禮來三靶點激動劑啟動頭對頭III期研究�。禮來GLP-1R/GIPR/GCGR三靶點激動劑新藥Retatrutide在clinicaltrials.gov網(wǎng)站上登記一項III期臨床(NCT06260722)���,擬評估retatrutide與司美格魯肽對比治療二甲雙胍聯(lián)合或不聯(lián)合鈉-葡萄糖共轉(zhuǎn)運體2抑制劑(SGLT2i)治療血糖控制不佳的2型糖尿病患者的有效性和安全性�。公布于EASD2023大會上的Ⅱ期臨床數(shù)據(jù)顯示�,接受Retatrutide治療的糖尿病患者在36周時其HbA1c水平最多降低23.6mmol/mol���,患者體重同時減少16.9%����。
6.武田OX2R激動劑嗜睡癥IIb期臨床成功�。武田口服食欲素受體2(OX2R)激動劑TAK-861治療1型嗜睡癥(NT1)的IIb期臨床達到主要終點和關鍵次要終點�。與安慰劑相比,TAK-861治療第8周時患者的覺醒維持測試(MWT)指標顯著改善(p < 0.001);Epworth嗜睡量表(ESS)和每周發(fā)作率(WCR)等指標也具有統(tǒng)計學意義的顯著改善���;TAK-861總體耐受性良好���,沒有治療相關的嚴重不良事件報告。
7.大??笰D激越復方制劑III期臨床失敗����。大冢制藥復方制劑AVP-786(氘代右美沙芬+奎尼丁)治療阿爾茨海默病癡呆相關激越的III期臨床沒有達到在主要療效終點����。與安慰劑相比,AVP-786治療患者的Cohen-Mansfield激越量表(CMAI)總分從基線到第12周的平均變化的統(tǒng)計沒有達到顯著差異���;該組治療相關不良事件--跌倒發(fā)生率高于安慰劑組���。大冢制藥將對數(shù)據(jù)集進行進一步的預設和探索性分析。
醫(yī)藥熱點
1.吉林首批醫(yī)院試點“一次掛號管三天”����。為進一步打通門診就醫(yī)過程中的堵點,日前���,吉林省衛(wèi)健委聯(lián)合省中醫(yī)藥管理局以優(yōu)化門診服務流程為切入點�,探索實行“一次就診只掛一次號”工作���?;颊咴谠圏c醫(yī)院就診時�,因檢查、檢驗結果出具較晚���,當日不能完成一次診治過程需要復診時�,患者憑有效的掛號信息憑證���,3日內(nèi)不再重復收取掛號費�、診察費等相關費用����。首批試點單位包括吉林大學第一醫(yī)院�、吉林大學第二醫(yī)院、吉林大學中日聯(lián)誼醫(yī)院和長春中醫(yī)藥大學附屬醫(yī)院4家醫(yī)院�。
2.廣東省中西醫(yī)結合應急救治中心選址獲批���。近日,廣州市規(guī)劃和自然資源局官網(wǎng)公示了廣東省中西醫(yī)結合應急救治中心(南沙區(qū))建設項目用地預審與選址意見書����。該項目建設單位為廣東省中醫(yī)院�,項目位于廣東省中醫(yī)院南沙醫(yī)院旁邊,擬建設規(guī)模為58440平方米�,地上總用地面積13370平方米,建設用地面積13370平方米�。建設年限為37個月。
3.復旦大學附屬中山醫(yī)院-開立醫(yī)療聯(lián)合實驗室掛牌����。近日,上海市創(chuàng)新醫(yī)療器械應用示范項目啟動會在復旦大學附屬中山醫(yī)院成功舉辦�。國家放射與治療臨床醫(yī)學研究中心與心血管介入治療技術及器械教育部工程研究中心以復旦大學附屬中山醫(yī)院心內(nèi)科為核心建設區(qū)域,并與開立愛聲建立聯(lián)合實驗室���,構建心血管領域創(chuàng)新型理念及技術轉(zhuǎn)化中心�,提升原始創(chuàng)新能力和核心競爭力�。
評審動態(tài)
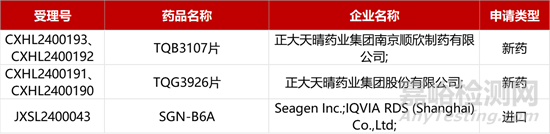
1. CDE新藥受理情況(02月09日)
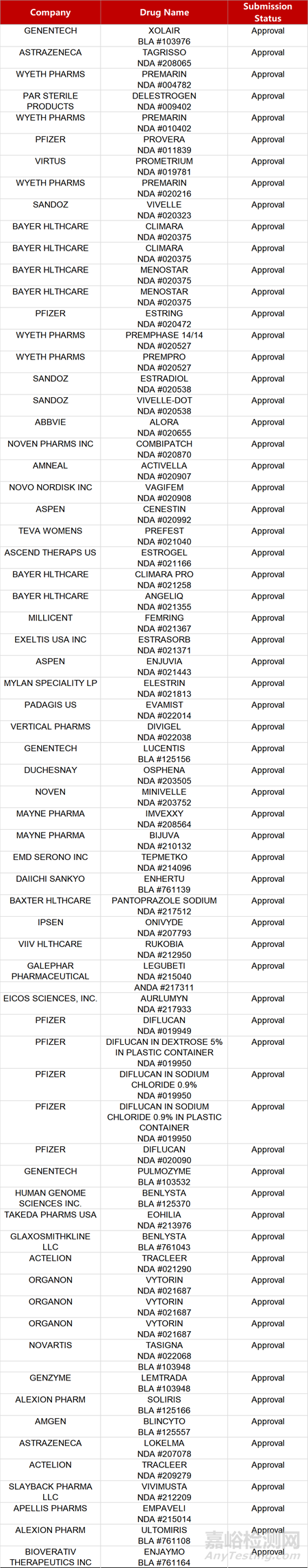
2. FDA新藥獲批情況(北美02月18日)